ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 2. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ - 2014
ЧАСТЬ II. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ
15. ПРИНЦИПЫ РЕГУЛЯЦИИ МЕТАБОЛИЗМА
15.5. Согласованная регуляция синтеза и распада гликогена
Как мы уже обсудили выше, использование запасенного гликогена начинается с действия гликогенфосфорилазы, отщепляющей от гликогена молекулы глюкозо-1-фосфата (рис. 15-25). Регуляция гликогенфосфорилазы — весьма поучительный пример ферментативной регуляции. Для данного фермента одного из первых было обнаружено наличие аллостерической регуляции, и для него впервые было показано, как активность может контролироваться путем обратимого фосфорилирования. Кроме того, он был в ряду первых аллостерических белков, для которых методом рентгеноструктурного анализа была определена детальная трехмерная структура как в активном, так и в неактивном состояниях. На примере гликогенфосфорилазы можно также показать различные функции изоферментов в тканях организма.
Гликогенфосфорилаза подвержена аллостерической и гормональной регуляции
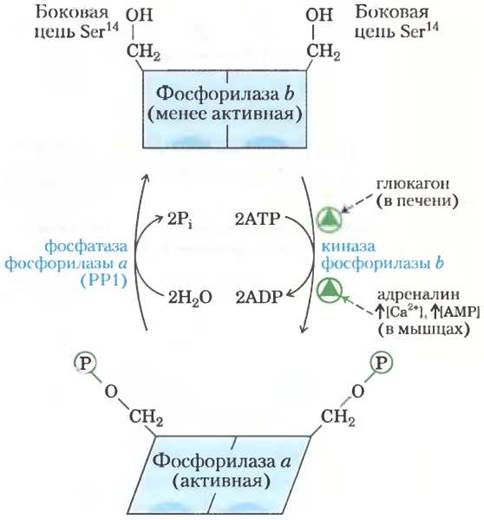
В конце 1930-х гг. Карл и Герти Кори (доп. 15-4) открыли две взаимопревращающиеся формы мышечной гликогенфосфорилазы: каталитически активную гликогенфосфорилазу а и менее активную гликогенфосфорилазу b (рис. 15-34). Исследования, проведенные позднее Эрлом Сазерлендом, показали, что в мышцах в состоянии покоя преобладает фосфорилаза b, а при активной мышечной деятельности гормон адреналин дает команду фосфорилирования специфического остатка Ser в молекуле фосфорилазы b, в результате чего она превращается в более активную фосфорилазу а. Обратите внимание, что гликогенфосфорилазу часто называют просто фосфорилазой, поскольку она была первой изученной фосфорилазой; такое укороченное название закрепилось и в литературе.
Эрл Сазерленд мл., 1915-1974

Рис. 15-34. Регуляция мышечной гликогенфосфорилазы путем ковалентной модификации. В более активной форме фермента, называемой фосфорилазой а, остаток Ser14 в каждой субъединице фосфорилирован. Фосфорилаза а превращается в менее активную фосфорилазу b в результате ферментативного отщепления этих фосфорильных групп, катализируемого фосфатазой фосфорилазы а (РР1). Фосфорилаза b может вновь превратиться в активную фосфорилазу а под действием киназы фосфорилазы b. (0 регуляции гликогенфосфорилазы также см. рис. 6-36.)
Фермент (киназа фосфорилазы b), ответственный за активацию фосфорилазы путем переноса фосфорильной группы на остаток Ser, активируется адреналином или глюкагоном в серии реакций, изображенных на рис. 15-35. Сазерленд открыл вторичный мессенджер сАМР, концентрация которого увеличивается при стимуляции адреналином (в мышцах) или глюкагоном (в печени). Повышенная концентрация сАМР инициирует ферментативный каскад — один катализатор активирует другой, а тот в свою очередь, активирует третий. Каскадный механизм позволяет значительно усилить первоначальный сигнал (см. выделение в рамках розового цвета на рис. 15-35). Увеличение концентрации сАМР активирует сАМР-зависимую протеинкиназу, иначе называемую протеинкиназой А (РКА). Затем РКА фосфорилирует и активирует киназу фосфорилазы b,которая катализирует фосфорилирование остатка Ser в каждой из двух идентичных субъединиц гликогенфосфорилазы, что приводит к активации фермента и стимулирует разложение гликогена. В мышцах этот процесс способствует получению энергии для гликолиза, необходимого для поддержания активности мышц в реакции «борьбы или бегства», сигналом которой служит адреналин. Разложение гликогена и образование глюкозы в печени направлено против снижения уровня глюкозы крови — сигналом служит глюкагон. Различие функций адреналина и глюкагона нашло свое отражение в тонких деталях механизмов регуляции ферментов в мышцах и печени. Гликогенфосфорилазы мышц и печени — изоферменты, они кодируются разными генами и имеют собственные особенности регуляции.
Рис. 15-35. Каскадный механизм действия адреналина и глюкагона. Действие адреналина на клетки мышц (слева) или глюкагона на клетки печени (справа), опосредованное специфическими рецепторами на поверхности клеток, приводит к активации GTP- связывающего белка (см. рис. 12-12). Активный Gsa способствует повышению концентрации сАМР, тем самым активируя РКА. Данные события вызывают серию реакций фосфорилирования; РКА активирует киназу фосфорилазы b, которая затем активирует гликогенфосфорилазу. Подобный каскадный механизм приводит к значительному усилению исходного сигнала; цифры в розовых рамках указывают нижние границы реального увеличения числа молекул на каждой ступени каскада. В результате разложения гликогена образуется глюкоза, которая в миоцитах может стать источником АТР (путем гликолиза) для мышечной активности, а через гепатоциты может выделиться в кровь для повышения слишком низкой концентрации глюкозы крови.
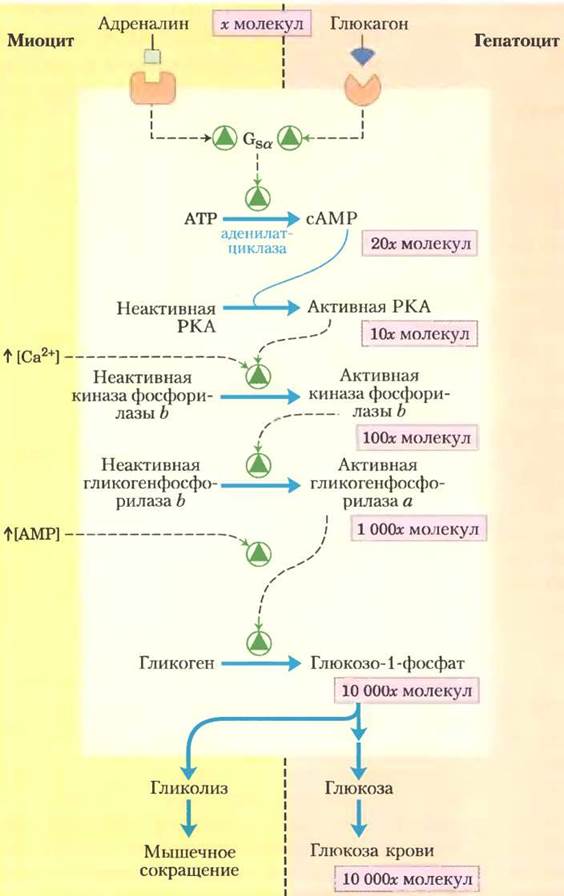
В мышцах регуляция фосфорилазы достигается в результате ковалентной модификации и двух механизмов аллостерического взаимодействия (рис. 15-35). Ионы Са2+, служащие сигналом мышечного сокращения, связываются с киназой фосфорилазы b и активируют ее, в результате чего она превращается в активную форму а. Ионы Са2+связывают киназу фосфорилазы b через ее ∆-субъединицу, представляющую собой кальмодулин (см. рис. 12-11). При активной работе мышц в результате разложения АТР накапливается АМР, который связывается фосфорилазой и активирует ее, ускоряя тем самым высвобождение глюкозо-1-фосфата из гликогена. При определенной концентрации АТР блокирует аллостерический центр, с которым связывается АМР, и тем самым инактивирует фосфорилазу.
Когда мышцы возвращаются в состояние покоя, фермент фосфатаза фосфорилазы а, иначе называемая фосфопротеинфосфатазой-1 (РР1), удаляет от фосфорилазы а фосфатную группу, превращая ее в менее активную фосфорилазу b.
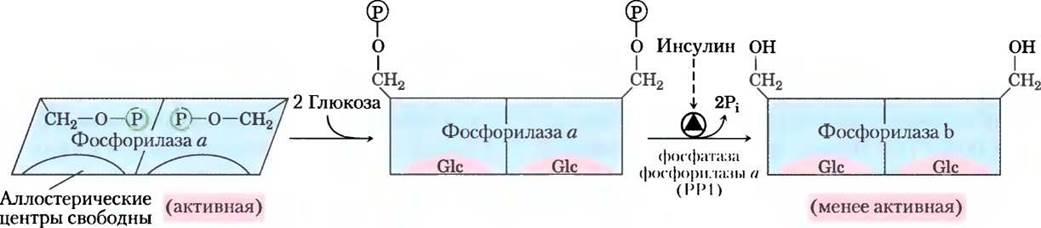
Подобно ферменту из мышц, гликогенфосфорилаза из печени подвержена как гормональной (путем фосфорилирования и дефосфорилирования), так и аллостерической регуляции. Дефосфорилированная форма фермента практически неактивна. При очень низком уровне глюкозы крови глюкагон (в соответствии с тем же каскадным механизмом, что изображен на рис. 15-35) активирует киназу фосфорилазы b, что превращает ее в активную форму а и способствует поступлению в кровь глюкозы. При возвращении уровня глюкозы крови к норме глюкоза проникает в гепатоциты и связывается с ингибиторным аллостерическим центром молекулы фосфорилазы а. Это связывание также приводит к конформационным изменениям, в результате которых фосфорилированные остатки Ser становятся доступными для действия РР1, которая катализирует их дефосфорилирование и инактивирует фосфорилазу (рис. 15-36). Наличие аллостерического центра связывания глюкозы позволяет печеночной форме гликогенфосфорилазы действовать в качестве сенсора глюкозы и соответствующим образом реагировать на изменения уровня глюкозы крови.
Рис. 15-36. Гликогенфосфорилаза печени как сенсор глюкозы. Связывание глюкозы в аллостерическом центре изофермента фосфорилазы а в печени вызывает конформационные изменения, приводящие к тому, что фосфорилированные остатки Ser в молекуле фермента становятся доступны для действия фосфатазы фосфорилазы a(PPi). Эта фосфатаза превращает фосфорилазу а в фосфорилазу b, резко снижая активность фермента и замедляя разложение гликогена; так происходит при высоком уровне глюкозы крови. Косвенным образом инсулин также стимулирует РР1 и замедляет разложение гликогена.
Регуляция гликогенсинтазы также осуществляется путем фосфорилирования-дефосфорилирования
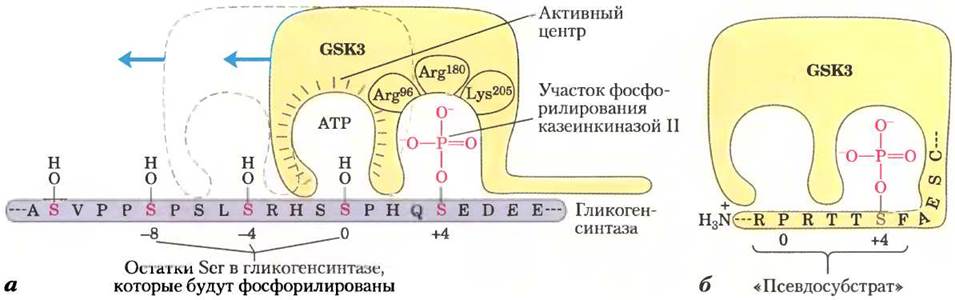
Подобно гликогенфосфорилазе, гликогенсинтаза может существовать в фосфорилированной и дефосфорилированной формах (рис. 15-37). Активная форма этого фермента — гликогенсинтаза а — не фосфорилирована. Фосфорилирование гидроксильных групп некоторых остатков Ser в обеих субъединицах фермента превращает гликогенсинтазу а в гликогенсинтазу b, которая проявляет активность только в присутствии своего аллостерического активатора глюкозо-6-фосфата. Интересно, что фосфорилирование различных остатков гликогенсинтазы могут осуществлять 11 различных протеинкиназ. Наиболее важную роль в регуляции играет киназа 3 гликогенсинтазы (GSK3),присоединяющая фосфатные группы к трем остаткам серина вблизи С-конца молекулы гликогенсинтазы, что полностью инактивирует фермент. Действие GSK3 подчиняется определенной иерархии: она не может осуществлять фосфорилирование до тех пор, пока расположенный поблизости остаток гликогенсинтазы не будет фосфорилирован (праймирован) ферментом казеинкиназой II (СКII; рис. 15-38, а).
Рис. 15-37. Влияние GSK3 на активность гликогенсинтазы. Активная форма фермента — гликогенсинтаза а — в С-концевой области имеет три остатка Ser. которые фосфорилирует киназа 3 гликогенсинтазы (GSK3), переводя фермент в неактивную форму b (GSb). GSK3 может начать свое действие лишь после того, как казеинкиназа (СКII) осуществит фосфорилирование соседнего остатка. Инсулин способствует активации гликогенсинтазы b путем ингибирования GSK3 (подробнее см. рис. 12-16) и стимуляции фосфопротеинфосфатазы (РР1 в мышцах и другой фосфатазы в печени). В мышцах адреналин активирует РКА. которая фосфорилирует гликогенсвязывающий белок GM (см. рис. 15-40) в определенном участке, что приводит к высвобождению РР1 из комплекса с гликогеном. Глюкозоб-фосфат благоприятствует дефосфорилированию гликогенсинтазы, поскольку при его связывании фермент принимает такую конформацию, в которой он является хорошим субстратом для РР1. Глюкоза также способствует дефосфорилированию; связывание глюкозы с гликогенфосфорилазой а приводит к конформационным изменениям, благоприятствующим ее дефосфорилированию и превращению в гликогенфосфорилазу b, в результате чего снимается ингибирование РР1 (см. рис. 15-39).
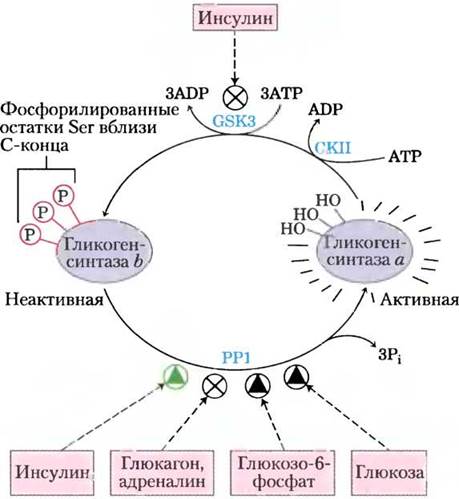
Рис. 15-38. Фосфорилирование гликогенсинтазы под действием GSK3. а — киназа 3 гликоген- синтазы сначала связывается со своим субстратом (гликогенсинтазой) путем взаимодействия между тремя положительно заряженными остатками (Arg96, Arg180 и Lys205) и фосфорилированным остатком Ser в положении +4 в молекуле субстрата. (Здесь тот остаток Thr или Ser в молекуле субстрата, который фосфорилируется первым, находится в положении 0. Остатки, расположенные ближе к N-концу, имеют нумерацию -1, -3 и т. д., а те, что находятся ближе к С-концу, соответствуют положениям +\ +2 и т. д.) Взаимодействие приводит к совмещению активного центра фермента и остатка Ser в положении Q который и фосфорилируется. После этого фермент сдвигается вдоль полипептидной цепи и последовательно фосфорилирует остатки Ser в положениях -4 и -8. 6 — в N-концевой области GSK3 существует остаток Ser, который может подвергаться фосфорилированию под действием РКА или РКВ (см. рис. 15-39). В результате такого фосфорилирования образуется участок, имитирующий субстрат, который закрывает активный центр и делает его недоступным для нормального субстрата. Это ингибирует активность GSK3 до тех пор, пока фосфатная группа в этой «псевдосубстратной» области не будет удалена при помощи РР1. Чтобы GSK3 могла начать свою работу, другие белки — субстраты GSK3 — также должны быть предварительно фосфорилированы по положению +4 под действием другой протеинкиназы. (О регуляции гликогенсинтазы см. также рис. 6-37 и 12-22, б.)
В печени превращение гликогенсинтазы b в активную форму осуществляется при помощи РР1, которая связана с гранулой гликогена. РР1 удаляет фосфатные группы с трех остатков серина, фосфорилированных под действием GSK3. Глюкозо-6-фосфат может связываться с аллостерическим центром на молекуле гликогенсинтазы b, что усиливает дефосфорилирующую активность РР1. По аналогии с гликогенфосфорилазой, действующей в качестве сенсора глюкозы, гликогенсинтазу можно рассматривать как сенсор глюкозо-6-фосфата. Ту роль, что РР1 играет в печени, в мышцах может исполнять другая фосфатаза, которая также активирует гликогенсинтазу путем дефосфорилирования.
Действие инсулина опосредовано киназой 3 гликогенсинтазы
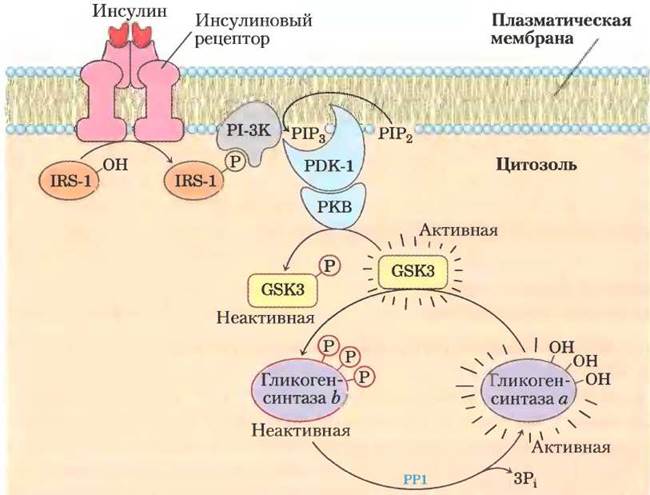
Как мы обсуждали в гл. 12, один из способов действия инсулина — активация протеинкиназы (про- теинкиназы В, РКВ), которая в свою очередь фосфорилирует и инактивирует GSK3 (рис. 15-39; см. также рис. 12-16). Фосфорилирование остатка Ser в N-концевой области GSK3 превращает этот фрагмент белка в псевдосубстрат, который занимает участок, где в норме должно происходить связывание предварительно фосфорилированного остатка серина (рис. 15-38, б). Это предотвращает связывание GSК3 с нормальным фосфорилированным субстратом, что в результате инактивирует фермент и смещает равновесие в сторону дефосфорилирования гликогенсинтазы под действием РР1. Гликогенфосфорилаза также может влиять на фосфорилирование гликогенсинтазы: активная гликогенфосфорилаза ингибирует РР1, не давая ей активировать гликогенсинтазу (рис. 15-37).
Рис. 15-39. Связь между инсулином, GSК3 и гликогенсинтазой. Связывание инсулина с его рецептором активирует тирозинкиназную активность рецептора, что приводит к фосфорилированию субстрата-1 инсулинового рецептора (IRS-1). Далее фосфотирозин данного белка связывается фосфатидилинозит-3-киназой (РI-3К), превращающей фосфатидилинозит- 4,5-бисфосфат (РIР2) в плазматической мембране в фосфатидилинозит-3,4,5-трисфосфат (РIР3). Протеинкиназа РDК-1, активирующаяся при связывании с Р1Р3, активирует вторую протеинкиназу (РКВ), что приводит к фосфорилированию киназы 3 гликогенсинтазы (GSК3) и образованию в ее молекуле «псевдосубстратной» области; это инактивирует фермент в соответствии с механизмом, изображенным на рис. 15-38, б. Инактивация GSК3 позволяет фосфопротеинфосфатазе-1 (РР1) дефосфорилировать гликогенсинтазу и перевести ее в активное состояние. Таким образом инсулин стимулирует синтез гликогена. Подробнее действие инсулина изображено на рис. 12-16.
Хотя сначала была выяснена роль GSК3 в метаболизме гликогена (отсюда и название фермента — киназа гликогенсинтазы), очевидно, что фермент имеет гораздо более широкий диапазон функций, чем только регуляция гликогенсинтазы. Он осуществляет передачу сигнала от инсулина и других факторов роста и питательных веществ, а также принимает участие в определении клеточного развития в эмбриональной фазе. Его мишенями являются белки цитоскелета, а также важные белки, задействованные в синтезе мРНК и белка. Эти мишени, подобно гликогенсинтазе, до начала действия GSК3 должны подвергнуться фосфорилированию другой протеинкиназой.
Центральная роль фосфопротеинфосфатазы 1 в метаболизме гликогена
Один и тот же фермент РР1 способен удалять фосфатные группы со всех трех ферментов, фосфорилированных в ответ на сигнал глюкагона (в печени) и адреналина (в печени и мышцах): киназы фосфорилазы, гликогенфосфорилазы и гликогенсинтазы. Инсулин стимулирует синтез гликогена путем активации РР1 и инактивации GSК3.
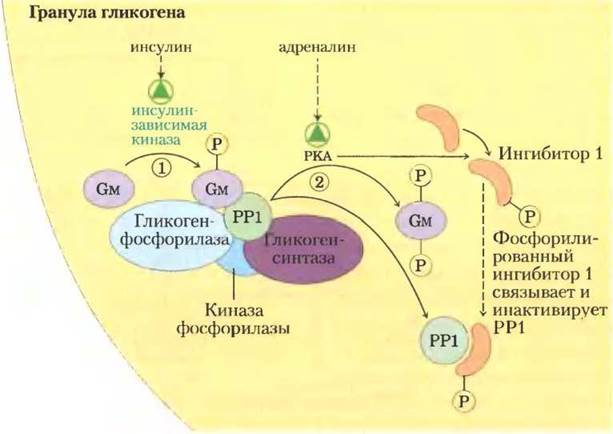
РР1 не существует в свободной форме в цитозоле; она прочно связана со своими белками- мишенями (киназой фосфорилазы, гликоген-фосфорилазой и гликогенсинтазой) с помощью одного из белков из семейства гликогенсвязывающих белков, который связывает гликоген (рис. 15-40). Сама РР1 является объектом ковалентной и аллостерической регуляции; она инактивируется при фосфорилировании под действием РКА и активируется при аллостерическом взаимодействии с глюкозо-6-фосфатом.
Рис. 15-40. Гликогенсвязывающий белок Gм. Гликогенсвязывающий белок относится к семейству белков, связывающих другие белки (в том числе РР1) с гранулами гликогена. В ответ на сигнал инсулина или адреналина белок Gм может фосфорилироваться по двум различным положениям. 1) Фосфорилирование Gм в участке 1, стимулированное инсулином, активирует РР1, которая дефосфорилирует киназу фосфорилазы, гликоген- фосфорилазу и гликогенсинтазу. 2) Фосфорилирование Gм в участке 2, вызванное адреналином, приводит к диссоциации РР1 из частицы гликогена, перекрывая ей доступ к гликогенфосфорилазе и гликогенсинтазе. РКА также фосфорилирует ингибитор 1, который в фосфорилированном состоянии ингибирует РР1. Так инсулин ингибирует разложение гликогена и стимулирует его синтез; адреналин (или глюкагон в печени) оказывает противоположное действие.
Аллостерические и гормональные сигналы координируют метаболизм углеводов
Рассмотрев механизмы, управляющие работой отдельных ферментов, мы можем обратиться к тем изменениям в метаболизме углеводов, которые происходят при нормальном питании, при голодании и при реакции «борьба или бегство»; их сигналами служат инсулин, глюкагон и адреналин соответственно. Мы рассмотрим два случая, в которых регуляция направлена на разные цели: 1) обеспечение крови глюкозой с помощью гепатоцитов; 2) использование углеводов в качестве источника энергии другими тканями (в частности, миоцитами скелетных мышц) для обеспечения собственных нужд.
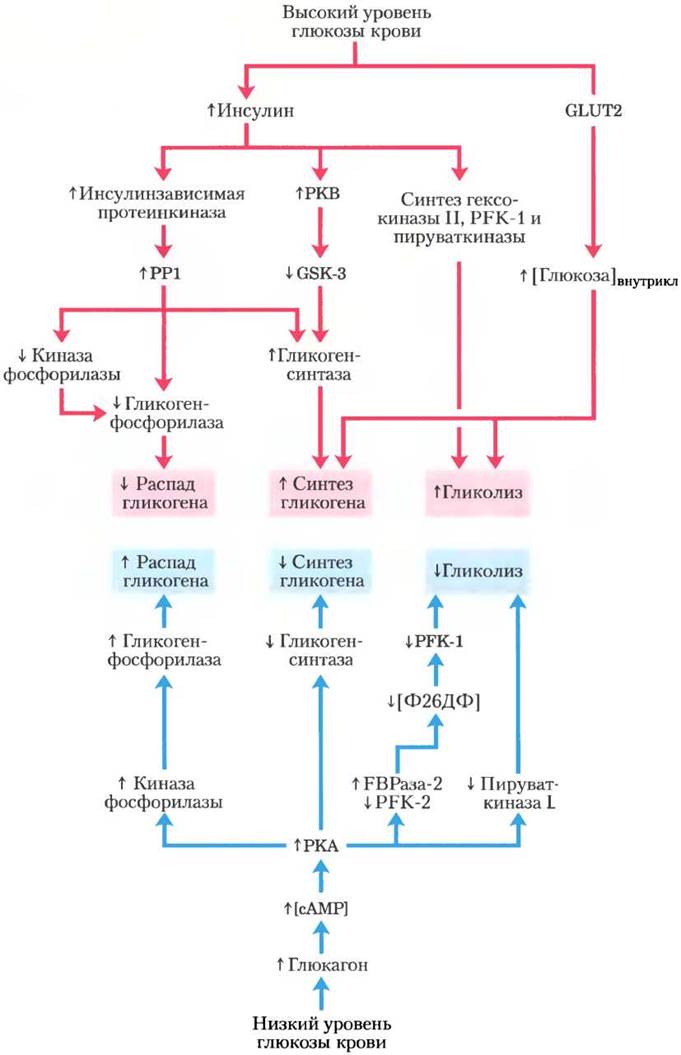
После приема богатой углеводами пищи происходит повышение уровня глюкозы крови, что приводит к высвобождению инсулина (верхняя часть рис. 15-41). В гепатоцитах инсулин немедленно оказывает два действия: инактивирует GSК3 через каскад, изображенный на рис. 15-39, и активирует протеинфосфатазу, возможно, РР1. Эти два действия полностью активируют гликогенсинтазу. Кроме того, путем дефосфорилирования РР1 инактивирует гликогенфосфорилазу а и киназу фосфорилазы, что останавливает разложение гликогена. Глюкоза поступает в гепатоциты с помощью GLUТ2, который всегда присутствует в плазматической мембране; повышенный уровень внутриклеточной глюкозы приводит к диссоциации гексокиназы IV (глюкокиназы) из комплекса с ядерным белком. Гексокиназа IV проникает в цитозоль и фосфорилирует глюкозу, стимулируя гликолиз и поставляя субстрат для синтеза гликогена. В таких условиях гепатоциты используют глюкозу крови для синтеза гликогена, количество которого может достигать 10% общей массы печени.
Между приемами пищи или в период продолжительного голодания падение уровня глюкозы крови приводит к высвобождению глюкагона, который активирует РКА, действуя через каскадный механизм, изображенный на рис. 15-35. РКА опосредует все эффекты, оказываемые глюкагоном (нижняя область рис. 15-41), — фосфорилирует киназу фосфорилазы, активируя ее и приводя к активации гликогенфосфорилазы; фосфорилирует гликогенсинтазу, инактивируя ее и блокируя синтез гликогена; она фосфорилирует белок с активностью РFК-2/ТВРазы-2, что приводит к снижению концентрации фруктозо- 2,6-бисфосфата, а это выражается в свою очередь в инактивации фермента гликолиза РРК-1 и активации фермента глюконеогенеза РВРазы-1; наконец, РКА фосфорилирует и инактивирует гликолитический фермент пируваткиназу. При таких условиях в результате распада гликогена и глюконеогенеза в печени происходит образование глюкозо-6-фосфата, прекращается использование глюкозы для обеспечения энергией гликолиза или для синтеза гликогена, и все это увеличивает количество глюкозы, поступающей из печени в кровь.
Рис. 15-41. Регуляция метаболизма углеводов в гепатоцитах. Стрелки указывают на причинные связи между происходящими изменениями. Обозначение ↓А —> ↑В означает, что снижение А вызывает повышение В. Розовые стрелки относятся к событиям, происходящим при высоком уровне глюкозы крови; голубые — при низком уровне глюкозы.
Подобное высвобождение глюкозы возможно только в печени, поскольку в других тканях отсутствует глюкозо-6-фосфатаза (рис. 15-28).
В регуляции метаболизма физиология скелетных мышц отличается от физиологии печени по трем важным пунктам (рис. 15-42). 1) Мышцы используют запасенный в них гликоген только для собственных нужд. 2) При переходе от состояния покоя к активному мышечному сокращению сильно меняются потребности мышц в АТР, которые обеспечиваются гликолизом. 3) Мышцы не имеют необходимого ферментативного аппарата для проведения глюконеогенеза. Регуляция метаболизма углеводов в мышцах как раз и отражает эти отличия от метаболизма в печени. Во-первых, в миоцитах нет рецептора глюкагона. Во-вторых, мышечная изоформа пируваткиназы не фосфорилируется РКА, так что гликолиз не прекращается при высокой концентрации сАМР. На самом деле сАМР повышает скорость гликолиза в мышцах, возможно, путем активации гликогенфосфорилазы. При поступлении в кровь адреналина при реакции «борьба или бегство» увеличение концентрации сАМР приводит к активации РКА, которая фосфорилирует и активирует киназу гликогенфосфорилазы. Фосфорилирование и активация гликогенфосфорилазы приводят к ускорению распада гликогена. При слабом стрессе адреналин не выделяется, но при любoй нейрональной стимуляции мышц концентрация Са2+ в цитозоле быстро увеличивается, что активирует киназу фосфорилазы через ее субъединицу кальмодулин.
Рис. 15-42. Различная регуляция углеводного обмена в печени и в мышцах. В печени либо глюкагон (при низкой концентрации глюкозы в крови), либо адреналин (в ситуации «борьбы или бегства») вызывают максимальный выброс глюкозы в кровоток. В мышцах адреналин увеличивает распад гликогена и гликолиз, и эти процессы обеспечивают образование необходимого для сокращения количества АТР.
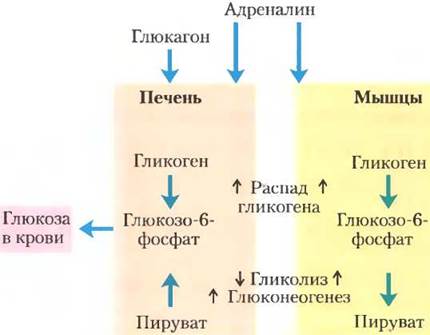
Повышенный уровень инсулина приводит к усилению синтеза гликогена в миоцитах через активацию РР1 и инактивацию GSК3. В отличие от гепатоцитов в миоцитах GLUТ4 запасается во внутриклеточных везикулах. Инсулин провоцирует их перемещение к плазматической мембране, где они усиливают захват глюкозы. Следовательно, в ответ на сигнал инсулина миоциты помогают снизить уровень глюкозы-крови, усиливая ее поглощение, синтез гликогена и гликолиз.
Метаболизм углеводов и жиров связаны гормональными и аллостерическими механизмами регуляции
Как ни сложна регуляция метаболизма углеводов, это лишь часть регуляции всего энергетического обмена. Метаболизм жиров и жирных кислот самым тесным образом связан с метаболизмом углеводов. Такие гормональные сигналы, как сигнал инсулина, изменение питания или физическая нагрузка оказывают одинаково важное воздействие на регуляцию метаболизма жиров и его связь с метаболизмом углеводов. Мы обратимся к теме общего метаболизма у млекопитающих в гл. 23, рассмотрев предварительно пути метаболизма жиров и аминокислот (гл. 17 и 18). Здесь мы лишь хотим подчеркнуть, что пути метаболизма подчиняются строгому контролю, который чрезвычайно чутко реагирует на изменения метаболической ситуации. Механизмы регуляции направлены на то, чтобы привести поток метаболитов через метаболические пути в соответствие с текущими нуждами клетки и организма и сделать это с минимальными изменениями концентраций интермедиатов, задействованных в других метаболических путях.
Краткое содержание раздела 15.5 Согласованная регуляция синтеза и распада гликогена
■ Гликогенфосфорилаза активируется в ответ на действие глюкагона или адреналина, которое повышает концентрацию сАМР и активирует РКА. Далее РКА фосфорилирует и активирует киназу фосфорилазы, которая превращает гликогенфосфорилазу b в активную форму а. Фосфопротеинфосфатаза 1 (РР1) осуществляет обратную реакцию, инактивируя фосфорилазу а. Глюкоза связывается с печеночным изоферментом гликогенфосфорилазой а, способствуя его дефосфорилированию и инактивации.
■ Гликогенсинтаза а инактивируется в результате фосфорилирования, катализируемого GSК3. Инсулин блокирует действие GSК3. Активируемая инсулином РР1 снимает ингибирование путем дефосфорилирования гликогенсинтазы b.
■ Инсулин усиливает поглощение глюкозы миоцитами и адипоцитами, способствуя перемещению переносчика глюкозы GLUT4 к плазматической мембране.
■ Инсулин стимулирует синтез гексокиназ II и IV, PFK-1, пируваткиназы и нескольких ферментов, задействованных в синтезе липидов. Инсулин стимулирует синтез гликогена в печени и мышцах.
■ В печени глюкагон активизирует распад гликогена и глюконеогенез и блокирует гликолиз, тем самым сохраняя глюкозу для нужд головного мозга и других тканей.
■ В мышцах адреналин стимулирует распад гликогена и гликолиз, обеспечивая клетки АТР для мышечного сокращения.