ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 2. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ - 2014
ЧАСТЬ II. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ
15. ПРИНЦИПЫ РЕГУЛЯЦИИ МЕТАБОЛИЗМА
15.4. Метаболизм гликогена в клетках животных
Далее при обсуждении регуляции метаболизма углеводов мы уделим основное внимание синтезу и распаду гликогена. В этом разделе мы рассмотрим реакции данного метаболического пути, а в разд. 15.5 обратимся к механизмам его регуляции.
У позвоночных и у многих микроорганизмов избыток глюкозы запасается в виде высокомолекулярного гликогена, а у растений - в виде крахмала. У позвоночных гликоген откладывается главным образом в печени и в мышцах и может составлять до 10 % массы печени и 1-2% массы мышечных тканей. Если в цитозоле была бы растворена глюкоза в количестве, эквивалентном этому количеству гликогена, ее концентрация достигла бы 0,4 М, что нарушало бы осмотическое равновесие в клетке. Однако концентрация полимерных молекул гликогена при той массе глюкозы в нем составляет лишь 0,01 мкМ. Гликоген запасается в виде больших гранул. Одна гранула гликогена (β-частица) имеет диаметр около 21 нм, состоит из 55 000 остатков глюкозы и содержит примерно 2000 невосстанавливающих концов. От 20 до 40 подобных частиц собираются вместе, образуя α-розетки, которые легко различимы в микроскоп в образцах тканей нормально питающихся животных (рис. 15-24), но исчезают после 24 ч голодания.
Рис. 15-24. Гранулы гликогена в гепатоците. Гликоген — основная форма запасания углеводов в клетках, особенно в гепатоцитах. Гликоген образует электроноплотные структуры, часто в виде агрегатов или розеток. В гепатоцитах гликоген прочно связан канальцами гладкого эндоплазматического ретикулума. На фотографии также видно множество митохондрий. В гепатоцитах гликоген откладывается в зонах гладкого эндоплазматического ретикулума, богатых пузырьками и канальцами.
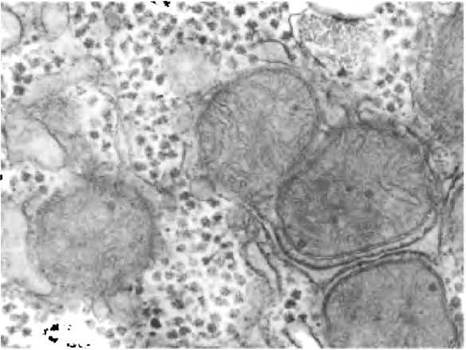
Гликоген мышц используется в качестве доступного источника энергии как для аэробного, так и анаэробного метаболизма. При активной физической нагрузке его запасы могут быть исчерпаны менее чем за час. Гликоген из печени служит источником глюкозы для других тканей в тех случаях, когда глюкоза не поступает с пищей (между приемами пищи или в период голодания); это особенно важно для нейронов головного мозга, которые не могут использовать в качестве источника энергии жирные кислоты. Запасы гликогена в печени могут быть исчерпаны за 12-24 ч. У человека общее количество энергии, запасенной в форме гликогена, гораздо меньше того, что хранится в виде жиров (триацилглицерины; см. табл. 23-5), однако млекопитающие не способны превращать жиры в глюкозу и расщеплять их в анаэробных условиях.
Гранулы гликогена представляют собой сложные агрегаты, состоящие из гликогена, расщепляющих и синтезирующих его ферментов, а также специального аппарата для регуляции этих ферментов. В мышцах и печени механизмы накопления и использования гликогена общие, но у тканеспецифичных ферментов несколько различаются, что связано с разной ролью гликогена в этих двух тканях. Гликоген, кроме того, поступает в организм с пищей и расщепляется в кишечнике; в этом процессе участвует другой набор гидролитических ферментов, превращающих гликоген (и крахмал) в глюкозу. Подобным образом разлагается потребляемый в пищу крахмал. Мы начнем с рассмотрения разложения гликогена до глюкозо-1-фосфата (гликогенолиз), а затем обратимся к путям синтеза гликогена (гликогенез).
Расщепление гликогена катализирует гликогенфосфорилаза
В мышцах и печени глюкозные звенья из внешних ветвей гликогена вовлекаются в гликолиз в результате действия трех ферментов: гликогенфосфорилазы, фермента, расщепляющего цепи в участках ветвления, и фосфоглюкомутазы. Гликогенфосфорилаза катализирует атаку неорганического фосфата Рi на (α1 —> 4)-гликозидную связь между двумя остатками глюкозы на невосстанавливающем конце гликогена, в результате чего концевой остаток глюкозы отщепляется в виде α-D-глюкозо-1-фосфата (рис. 15-25). Данная реакция фосфоролиза отличается от гидролиза гликозидной связи под действием амилазы при переваривании гликогена и крахмала из пищи. При фосфоролизе часть энергии гликозидной связи сохраняется в виде эфира фосфорной кислоты глюкозо-1-фосфата (см. разд. 14-2).
Рис. 15-25. Удаление концевого остатка глюкозы от невосстанавливающего конца цепи гликогена под действием гликогенфосфорилазы. Этот процесс постоянно повторяется; фермент последовательно удаляет остатки глюкозы, пока не остановится за четыре остатка до точки ветвления (см. рис. 15-26).
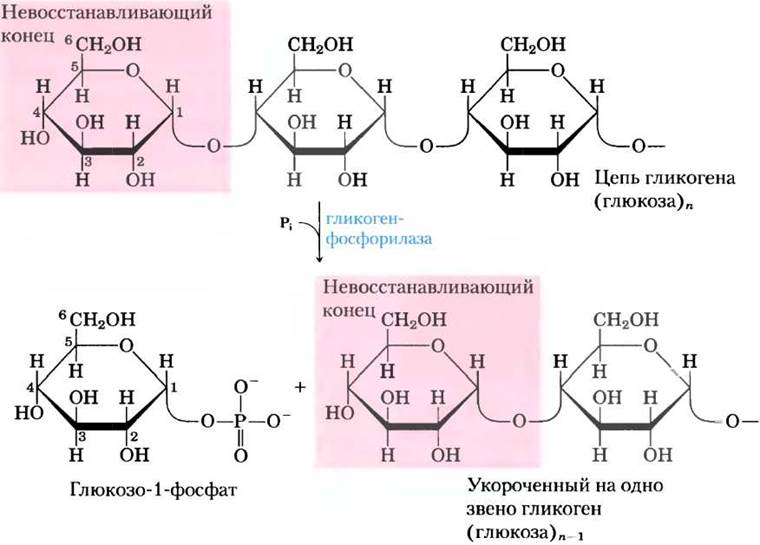
Для реакции с участием гликогенфосфорилазы важно наличие кофактора пиридоксальфосфата, чья фосфатная группа действует как обычная кислота, катализируя атаку Рi на гликозидную связь. Надо сказать, что эта роль необычна для данного кофактора; гораздо чаще он выступает кофактором в метаболизме аминокислот (см. рис. 18-6).
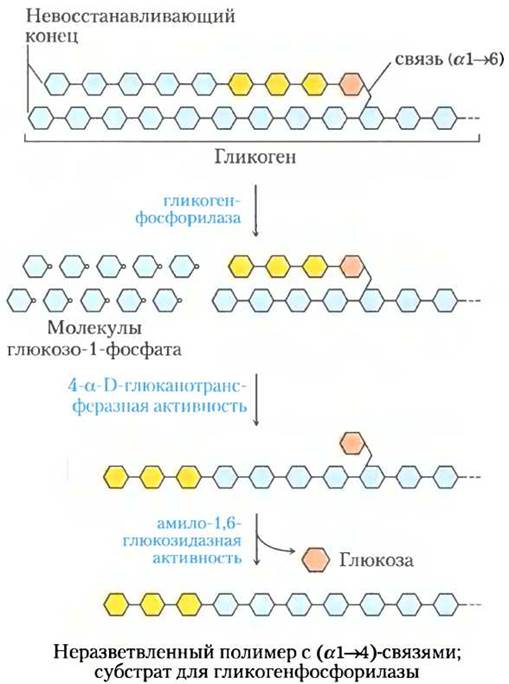
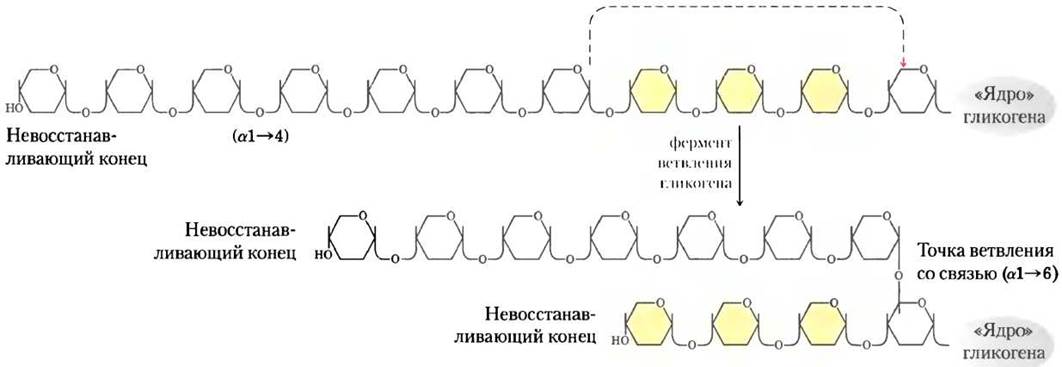
Гликогенфосфорилаза действует на невосстанавливающий конец молекулы гликогена многократно, пока не достигнет участка ветвления с конфигурацией α1 —> 6 (см. рис. 7-14); действие фермента прекращается за четыре остатка глюкозы до этой точки. Дальнейшее разложение гликогена гликогенфосфорилаза сможет продолжать после вмешательства фермента, расщепляющего участок ветвления. Этот фермент, обладающий активностью 4-α-D-глюканотрансферазы и амило-1,6-глюкозидазы, последовательно катализирует перенос участка боковой цепи (трех остатков) и отщепление последнего остатка глюкозы (рис. 15-26); после этого гликогенфосфорилаза может продолжать свою работу.
Рис. 15-26. Разложение гликогена вблизи точки ветвления с гликозидной связью (α1 —> 6). После удаления концевых остатков глюкозы гликогенфосфорилазой (см. рис. 15-25) остатки в участке ветвления отщепляет специальный фермент, обладающий двумя типами активности. Под действием трансферазной активности данного фермента участок из трех остатков глюкозы из боковой цепи перемещается на ближайший невосстанавливающий конец с образованием (α1 —> 4)-связи. Затем оставшийся единственный остаток глюкозы, присоединенный связью (α1 —> 6), отщепляется в виде свободной молекулы глюкозы под действием 1,6-глюкозидазной активности фермента. Здесь остатки глюкозы изображены в виде пиранозных колец без обозначения -Н, -ОН и -СН2ОН-групп.
Глюкозо-1-фосфат может подвергаться гликолизу или, претерпевая превращения в печени, пополнять запасы глюкозы в крови
Конечный продукт реакции с участием гликогенфосфорилазы глюкозо-1-фосфат под действием фосфоглюкомутазы превращается в глюкозо-6- фосфат:
Глюкозо-1-фосфат ⇄ глюкозо-6-фосфат
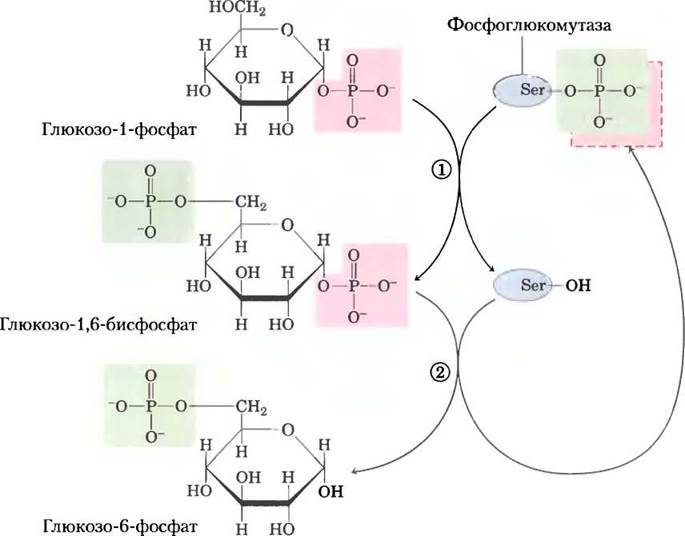
Фермент, изначально фосфорилированный по остатку Ser, передает фосфорильную группу на атом С-6 в молекуле субстрата и забирает фосфорильную группу от атома С-1 (рис. 15-27).
Рис. 15-27. Реакция, катализируемая фосфоглюкомутазой. В начале реакции фермент фосфорилирован по остатку Ser. На стадии (1) фермент передает свою фосфорильную группу (выделена зеленым цветом) глюкозо-1-фосфату, в результате чего образуется глюкозо-1,6- бисфосфат. На стадии (2) фосфорильная группа из положения С-1 глюкозо-1,6-бисфосфата (выделена красным цветом) переносится обратно на фермент, что приводит к регенерации фосфорилированного фермента и образованию глюкозо-6-фосфата.
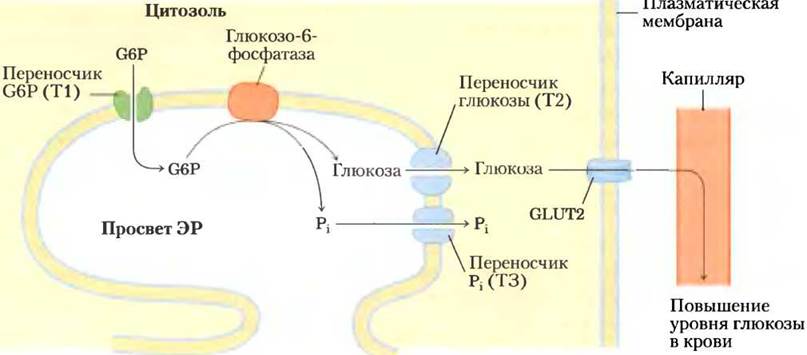
Образующийся из гликогена в мышцах глюкозо-6-фосфат может вовлекаться в гликолиз и служить источником энергии для обеспечения мышечного сокращения. В печени разложение гликогена преследует другую цель: поддерживать уровень глюкозы крови, например, между приемами пищи. В этом процессе задействована глюкозо-6-фосфатаза, обнаруженная только в тканях печени и почек. Данный фермент представляет собой интегральный белок мембраны эндоплазматического ретикулума (ЭР), который, как считают, имеет девять трансмембранных спиралей; активный центр фермента обращен в просвет ЭР. Образовавшийся в цитозоле глюкозо-6- фосфат направляется в просвет ЭР при помощи специализированной транспортной молекулы Т1 (рис. 15-28) и на поверхности ЭР подвергается гидролизу под действием глюкозо-6-фосфатазы. По всей видимости, образующиеся Pi и глюкоза переносятся обратно в цитозоль с помощью двух других молекул (Т2 и Т3), а затем глюкоза покидает гепатоцит с помощью еще одной молекулы- переносчика GLUT2, расположенной в плазматической мембране. Обратите внимание, что, поскольку активный центр глюкозо-6-фосфатазы обращен в просвет ЭР, клетке удается отделить данную реакцию от процесса гликолиза, который происходит в цитозоле и может быть прерван при вмешательстве глюкозо-6-фосфатазы. Генетический дефект как глюкозо-6-фосфатазы, так и Т1 приводит к серьезным нарушениям метаболизма, что выражается в гликогенозе типа Iа (доп. 15-4).
Рис. 15-28. Гидролиз глюкозо-6-фосфата (G6Р) под действием глюкозо-6-фосфатазы в эндоплазматическом ретикулуме (ЭР). Каталитический центр глюкозо-6-фосфатазы обращен в просвет ЭР. Переносчик глюкозо-6-фосфата Т1 транспортирует его из цитозоля в просвет ЭР, а переносчики Т2 и ТЗ транспортируют образующиеся при гидролизе глюкозу и Р1 обратно в цитозоль. Глюкоза выходит из клетки при помощи специализированного переносчика GLUT2, находящегося в плазматической мембране.
Поскольку в мышцах и в жировой ткани глюкозо-6-фосфатаза отсутствует, эти ткани не могут превращать глюкозо-6-фосфат, образовавшийся при распаде гликогена, в глюкозу; таким образом, эти ткани не вносят никакого вклада в поддержание уровня глюкозы крови.
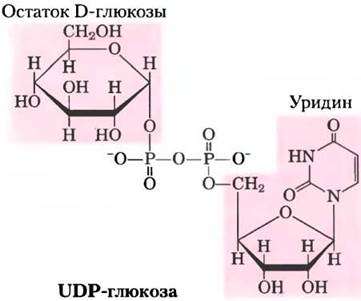
Сахаронуклеотид UDР-глюкоза участвует в синтезе гликогена
Во многих реакциях, в которых происходят превращения или полимеризация гексоз, принимают участие сахаронуклеотиды — соединения, в которых аномерный углерод сахара активирован присоединенным сложноэфирной связью нуклеотидом. Подобные нуклеотидные производные сахаров служат субстратами при полимеризации моносахаридов в дисахариды, гликоген, крахмал, целлюлозу и более сложные внеклеточные полисахариды. Они, кроме того, важные интермедиаты при образовании аминогексоз и дезоксигексоз, обнаруженных в некоторых из этих полисахаридов, а также при синтезе витамина С (L-аскорбиновой кислоты). На участие нуклеотидных производных сахаров в биосинтезе гликогена и многих других производных углеводов первым обратил внимание аргентинский биохимик Луис Лелуар в 1953 г.
Луис Лелуар, 1906-1987

Дополнение 15-4. Карл и Герти Кори — пионеры исследований метаболизма гликогена и связанных с ним заболеваний
Многое из того, что написано в современных учебниках биохимии о метаболизме гликогена, было открыто в период с 1925 по 1950 гг. замечательными исследователями — супругами Карлом Ф. Кори и Герти Т. Кори. Оба они получили медицинское образование в Европе в конце Первой мировой войны (Герти Кори закончила подготовительное отделение и медицинский факультет за один год!). Супруги покинули Европу в 1922 г. и основали исследовательские лаборатории в США: первые девять лет они работали в Буффало, шт. Нью- Йорк, теперь это Мемориальный институт Росвелл парк, а затем с 1931 г. до конца своих дней — в Университете Джорджа Вашингтона в Сент-Луисе.
В своих ранних работах по физиологии, посвященных происхождению и превращениям гликогена в тканях животных, Кори показали, что в мышцах гликоген превращается в лактат, который затем с кровью попадает в печень, где вновь превращается в гликоген; этот цикл позднее стал называться циклом Кори (см. рис. 23-20). В дальнейших биохимических исследованиях они показали, что превращения гликогена начинаются в реакции фосфорилирования под действием открытого ими же фермента, названного гликогенфосфорилазой. Они показали, что продукт реакции глюкозо-1-фосфат («эфир Кори») может быть вновь использован для ресинтеза гликогена по обратной реакции. Это открытие не доказывало, что в клетке гликоген синтезируется именно таким путем, но тем не менее это было первой демонстрацией синтеза макромолекул из мономерных субъединиц in vitro, что заставило других ученых начать поиски ферментов с полимеразной активностью. Артур Корнберг, работавший в лаборатории Кори и открывший первую ДНК-полимеразу, говорил: «К открытию ДНК-полимеразы меня привела гликогенфосфорилаза, а не спаривание оснований».
Таблица 1. Заболевания человека (гликогенозы), связанные с отложением гликогена
Тип гликогеноза (название болезни) |
Дефектный фермент |
Поражаемый орган |
Симптомы |
Тип 0 |
Гликогенсинтаза |
Печень |
Низкий уровень глюкозы крови, много кетоновых тел, ранняя смерть |
Тип Iа (болезнь Гирке) |
Глюкозо-6-фосфатаза |
Печень |
Печень увеличена, почечная недостаточность |
Тип Ib |
Микросомальная глюкозо-6- фосфаттранслоказа |
Печень |
Как в Iа; предрасположенность к бактериальным инфекциям |
Тип Iс |
Микросомальный переносчик Рi |
Печень |
Как в Iа |
Тип II (болезнь Помпа) |
Лизосомальная глюкозидаза |
Скелетные и сердечные мышцы |
Инфантильная форма: смерть до достижения возраста 2 года; ювенильная форма: миопатия; взрослая форма: как при мышечной дистрофии |
Тип IIIа (болезнь Форбса или болезнь Кори) |
4-α-D-глюканотрансфераза и(или) амило-1,6-глюкозидаза |
Печень, скелетные и сердечная мышцы |
У детей увеличена печень: мионатия |
Тип IIIb |
4-α-D-глюканотран сфераза и(или) амило-1,6- глюкозидаза печени (мышечный фермент нормальный) |
Печень |
У детей увеличена печень |
Тин IV (болезнь Андерсена) |
Фосфорилаза печени |
Печень, скелетные мышцы |
Увеличены печень и селезенка, миоглобин в моче |
Тип V (болезнь Мак-Ардля) |
Мышечная фосфорилаза |
Скелетные мышцы |
Судороги и боль при физической нагрузке; миоглобин в моче |
Тип VI (болезнь Герса) |
Фосфорилаза печени |
Печень |
Печень увеличена |
Тип VII (болезнь Таруи) |
Мышечная РFК-1 |
Мышцы, эритроциты |
Как в V; гемолитическая анемия |
Тип VIb, VIII или IX |
Киназа фосфорилазы |
Печень, лейкоциты, мышцы |
Печень увеличена |
Тип XI (синдром Фанкони-Бикель) * |
Переносчик глюкозы (GLUТ2) |
Печень |
Нарушение роста, рахит, увеличение печени, дисфункция почек |
Герти Кори заинтересовалась генетическими заболеваниями человека, при которых в печени накапливается избыток гликогена. В некоторых случаях ей удалось идентифицировать биохимическую природу нарушения и показать, что диагностику болезни можно осуществлять, анализируя ферменты метаболизма гликогена в небольших образцах тканей, взятых при биопсии. В табл. 1 обобщены современные знания о 13 болезнях такого рода. ■
Карл и Гетри Кори разделили врученную им в 1947 г. Нобелевскую премию по физиологии и медицине с Бернардо Усаем из Аргентины, который был награжден за исследования в области гормональной регуляции метаболизма углеводов. В 1940-1950-х гг. лаборатория Кори в Сент-Луисе была международным центром биохимических исследований. Шестеро уче- ных, работавших с Кори, стали лауреатами Нобелевской премии: Артур Корнберг (1959) за открытие механизма синтеза ДНК, Северо Очоа (1959) за открытие механизма синтеза РНК, Луис Лелуар (1970) за определение роли нуклеотидных производных сахаров в синтезе полисахаридов, Эрл Сазерленд (1971) за открытие сАМР и установление его роли в регуляции метаболизма углеводов, Кристиан де Дюв (1974) за открытия в области структурной и функциональной организации клетки, Эдвин Кребс (1991) за открытие киназы фосфорилазы.
Супруги Кори в лаборатории Герти Кори. Около 1947 г.

Участие нуклеотидных производных сахаров в реакциях биосинтеза вытекает из нескольких приведенных ниже соображений.
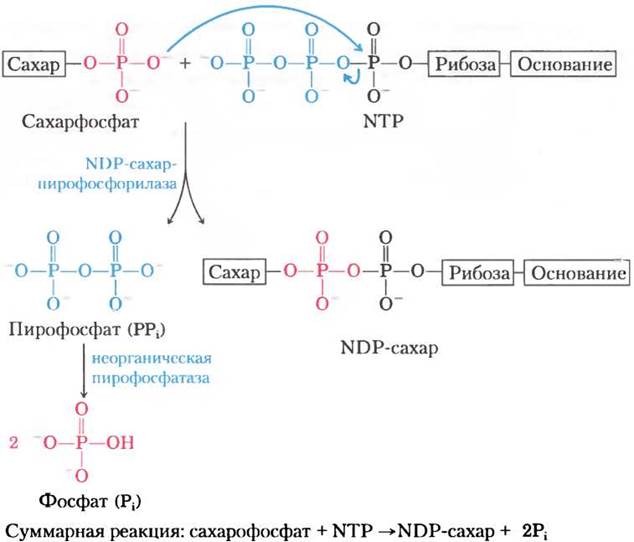
1. Образование этих соединений происходит необратимо, что способствует необратимости тех метаболических путей, в которых они задействованы. Реакция конденсации нуклеозидтрифосфата с гексозо-1 -фосфатом характеризуется небольшим положительным изменением свободной энергии, однако при этом освобождается неорганический пирофосфат PPi, который в ходе экзергонической реакции быстро гидролизуется под действием неорганической пирофосфатазы
(∆G′° = -19,2 кДж/моль; рис. 15-29). В результате концентрация PPi в клетке остается низкой, а реальное изменение свободной энергии всего процесса оказывается благоприятным. Как и во многих биохимических реакциях полимеризации в живых организмах, быстрое удаление продукта, в данном случае связанное с отрицательным изменением свободной энергии при гидролизе PPi, способствует продвижению всего процесса синтеза.
Рис. 15-29. Образование нуклеозиддифосфатсахаров. Между сахарофосфатом и нуклеозидтрифосфатом (NTР) происходит реакция конденсации. Отрицательно заряженный кислород сахарофосфата выступает в роли нуклеофила, атакуя α-фосфат нуклеозидтрифосфата и вытесняя пирофосфат. Равновесие реакции сдвинуто вправо, поскольку образующийся РРi быстро гидролизуется неорганической пирофосфатазой.
2. Хотя в химических реакциях с участием нуклеотидных производных сахаров нуклеозиды непосредственно не задействованы, различные функциональные группы нуклеозидов могут вступать в нековалентные взаимодействия с ферментом, при этом дополнительная свободная энергия связывания может вносить заметный вклад в каталитическую активность фермента (гл. 6; см. также т. 1, с. 425).
3. Подобно фосфату, нуклеотиды (например, UМР или АМР) — прекрасные уходящие группы и облегчают нуклеофильную атаку, активируя тот атом углерода в остатке сахара, с которым они связаны.
4. «Помечая» определенные молекулы гексоз нуклеотидными группами, клетка может использовать их для различных целей (например, для синтеза гликогена), отделив таким образом от гексозофосфатов, направляемых в другие реакции (например, гликолиз).
Синтез гликогена происходит практически во всех тканях организма, но особенно интенсивно в печени и скелетных мышцах. Отправной точкой для синтеза служит глюкозо-6-фосфат. Как мы уже показали, это соединение может образоваться из свободной глюкозы под действием изоферментов — гексокиназы I и гексокиназы II в мышцах или гексокиназы IV (глюкокиназы) в печени:
D-Глюкоза + АТР —> D-глюкозо-6-фосфат + ADP
Однако некоторая часть глюкозы, попадающей в организм с пищей, вовлекается в гликолиз более сложным путем. Она сначала захватывается эритроцитами и в процессе гликолиза превращается в лактат, затем лактат попадает в печень и в результате глюконеогенеза превращается там в глюкозо-6-фосфат.
На первом этапе синтеза гликогена глюкозоб-фосфат превращается в глюкозо-1-фосфат под действием фосфоглюкомутазы:
Глюкозо-6-фосфат ⇄ глюкозо-1-фосфат
Ключевым моментом в синтезе гликогена является превращение продукта реакции в UDP- глюкозу с помощью фермента UDP-глюкозо- пирофосфорилазы:
Глюкозо-1-фосфат + UTP —> UDP-глюкоза + PPi
Обратите внимание, что название данного фермента связано с обратной реакцией. В клетке реакция протекает в сторону образования UDP- глюкозы, поскольку выделяющийся пирофосфат быстро гидролизуется под действием неорганической пирофосфатазы (рис. 15-29).
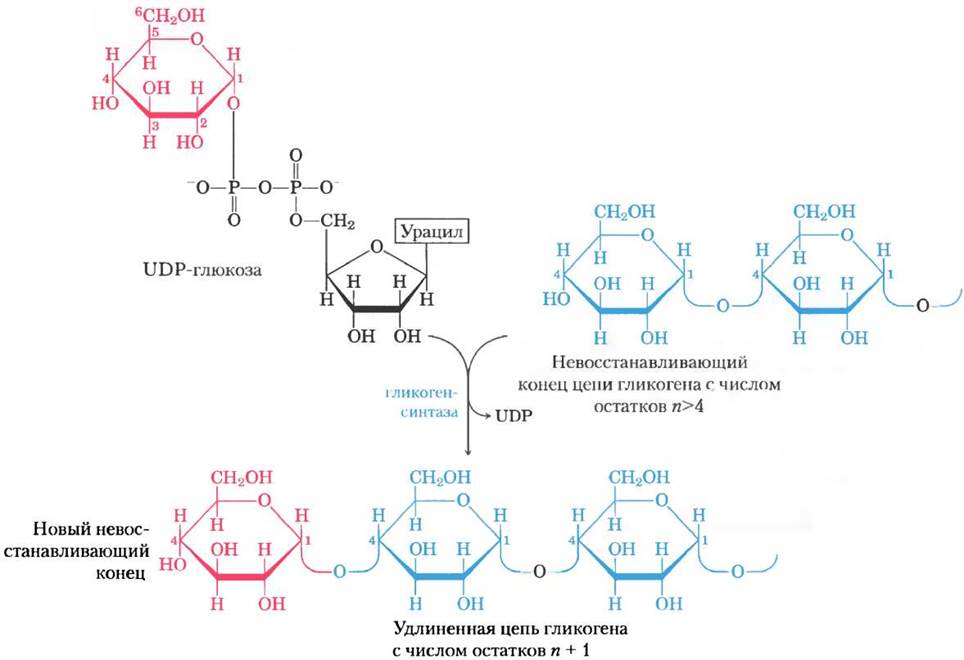
UDP-глюкоза выступает в качестве прямого донора остатков глюкозы в реакции, катализируемой гликогенсинтазой, которая способствует переносу остатка глюкозы от UDP-глюкозы на невосстанавливающий конец разветвленной молекулы гликогена (рис. 15-30). Общее равновесие при встраивании глюкозо-6-фосфата в растущую цепь гликогена сильно сдвинуто в сторону синтеза.
Рис. 15-30. Синтез гликогена. Удлинение цепи гликогена происходит под действием гликогенсинтазы. Фермент переносит остаток глюкозы от UDР-глюкозы на невосстанавливающий конец цепи гликогена (см. рис. 7-14), создавая новую (α1 —> 4)-связь.
Гликогенсинтаза не может формировать (α1 —> 6)-связи, находящиеся в точках ветвления молекул гликогена. Эти связи создает специальный фермент ветвления гликогена — 1,4 —> 1,6- трансгликозидаза (гликозил-4,6-трансфераза). Данный фермент катализирует перенос концевого участка из 6-7 остатков глюкозы от невосстанавливающего конца цепи гликогена, состоящего не менее чем из 11 остатков, на ОН-группу атома С-6 остатка глюкозы, расположенного ближе к началу той же или другой цепи гликогена, создавая тем самым новую ветвь (рис. 15-31). Дальнейшее удлинение этого фрагмента осуществляет гликогенсинтаза. Биологический «смысл» синтеза разветвленного полимера состоит в улучшении его растворимости и создании максимального количества невосстанавливающих концов. Тем самым достигается увеличение числа участков, доступных для гликогенфосфорилазы и гликогенсинтазы, поскольку оба фермента действуют только на невосстанавливающие концы цепи.
Рис. 15-31. Образование разветвлений в цепи гликогена. Фермент ветвления гликогена 1,4 —> 1,6-трансгликозидаза (или гликозил-4,6-трансфераза) в процессе синтеза гликогена создает новые точки ветвления.
Гликогенин обеспечивает связывание первых остатков сахара при синтезе гликогена
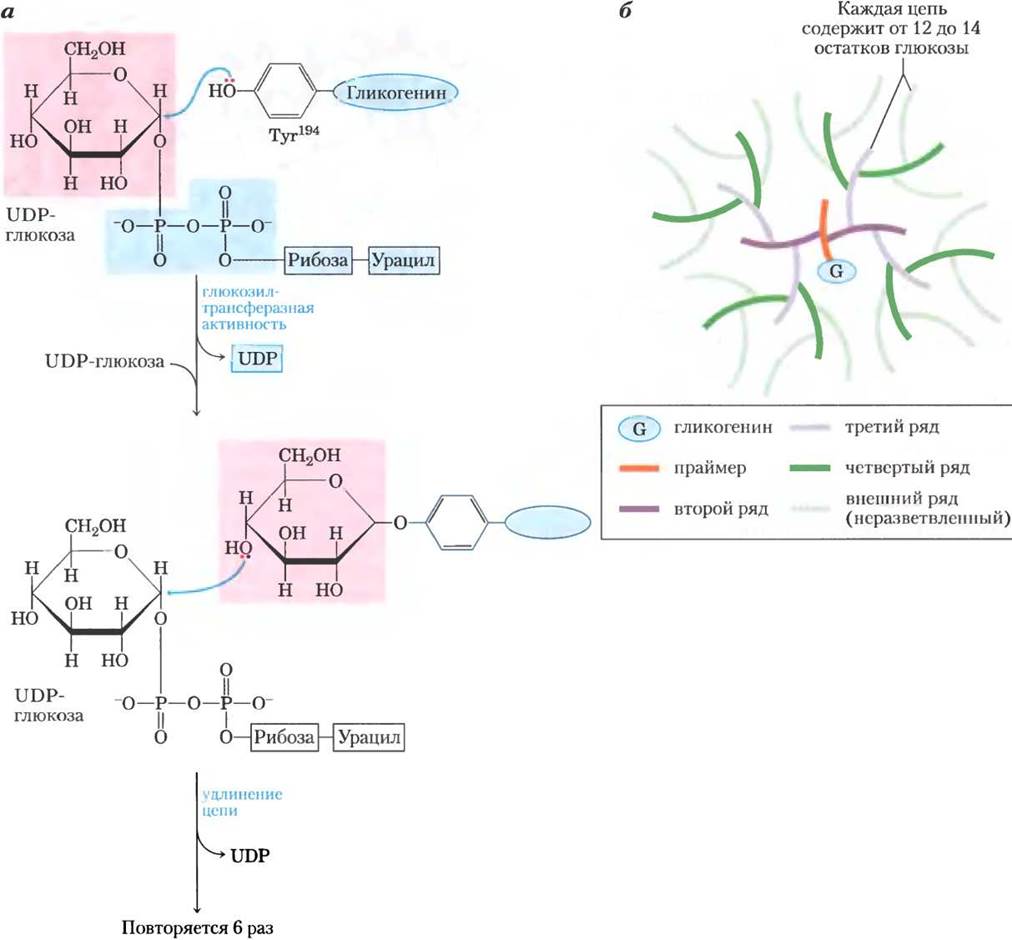
Гликогенсинтаза не может инициировать синтез цепи гликогена de novo. Для этого необходим праймер, в качестве которого обычно выступает фрагмент цепи, по меньшей мере, из восьми остатков глюкозы, связанных (α1 —> 4)-связью. Как же происходит связывание первых остатков глюкозы в молекуле гликогена? Замечательный белок гликогенин (рис. 15-32) является одновременно и праймером, на котором происходит сборка новой цепи, и ферментом, катализирующим процесс сборки. Первый шаг на пути синтеза новой молекулы гликогена состоит в переносе остатка глюкозы от UDP-глюкозы на гидроксильную группу Туr194 гликогенина под действием глюкозилтрансферазной активности фермента (рис. 15-33). Зарождающаяся цепь удлиняется путем присоединения еще семи остатков глюкозы, каждый из которых поступает от UDP-глюкозы. Катализатором этих реакций вновь выступает гликогенин. Далее к процессу подключается гликогенсинтаза, удлиняющая цепь гликогена. Будучи ковалентно связан с одним восстанавливающим концом молекулы гликогена, гликогенин остается внутри образующейся гранулы глигена (рис. 15-33, б).
Рис. 15-32. Структура гликогенина (PDB ID 1772). Мышечный гликогенин (Мr = 37 000 Да) в растворе существует в виде димера. В печени человека присутствует другая изоформа белка — гликогенин-2. Субстрат UDP-глюкоза (изображена в виде красной структуры из шариков и стержней) связан с укладкой Россмана в N-концевой области белка на некотором удалении от остатка Туr194 (бирюзового цвета): на расстоянии 15 А от этого остатка «своей» мономерной единицей и 12 А от него второй молекулой в составе димера. Каждая молекула UDP-глюкозы связана через фосфатную группу с ионом Мn2+ (зеленый), который играет важную роль в катализе. Считается, что Мn2+ выступает в качестве акцептора электронной пары (кислоты Льюиса), стабилизируя уходящую группу (UDP). В продукте реакции реакции гликозидная связь имеет такую же конфигурацию при атоме С-1, как в UDP-глюкозе, вероятно, перенос глюкозы от UDP на Туr194 происходит в две стадии: сначала остаток Asp162 (оранжевый) осуществляет нуклеофильную атаку, приводящую к образованию промежуточного продукта с обращенной конфигурацией, а следующая нуклеофильная атака остатком Туг194 восстанавливает исходную конфигурацию.
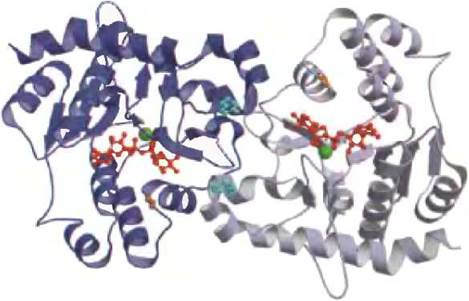
Рис. 15-33. Гликогенин и строение частицы гликогена, а — гликогенин катализирует две различные реакции. Сначала происходит атака гидроксильной группы остатка Туr194 на атом С-1 глюкозы в молекуле UDP-глюкозы, что приводит к гликозилированию остатка Туr. Затем гидроксильная группа у С-4 концевого остатка глюкозы атакует С-1 другой молекулы UDР-глюкозы; такая последовательность реакций повторяется до тех пор, пока не образуется участок молекулы гликогена из восьми остатков глюкозы, связанных (α1—> 4)-связями. б — строение частицы гликогена. От расположенной в центре молекулы гликогенина расходятся цепи гликогена (12-14 остатков), располагаясь слоями. Внутренние цепи имеют по две точки ветвления с конфигурацией (α1 —> 6). Цепи, образующие внешний слой, не разветвляются. В зрелой частице гликогена 12 слоев (здесь изображено только пять), в состав которых входит около 55 000 остатков глюкозы; диаметр молекулы около 21 нм, молекулярная масса ~107.
Краткое содержание раздела 15.4 Метаболизм гликогена в клетках животных
■ Гликоген запасается в мышцах и печени в виде крупных гранул. Внутри этих гранул содержатся также ферменты, участвующие в метаболизме гликогена, и регуляторные ферменты.
■ Гликогенфосфорилаза катализирует фосфоролиз цепи гликогена, начиная от невосстанавливающего конца молекулы, в результате чего образуется глюкозо-1-фосфат. Специальный фермент, расщепляющий связи в участках ветвления, переносит остатки ветвей на основную цепь, а последний остаток, присоединенный (α1 —> 6)-связыо, высвобождает в виде молекулы глюкозы.
■ Фосфоглюкомутаза осуществляет взаимопревращения глюкозо-1-фосфата и глюкозо- 6-фосфата. Глюкозо-6-фосфат может далее подвергаться гликолизу или (в печени) под действием глюкозо-6-фосфатазы превращаться в свободную глюкозу в эндоплазматическом ретикулуме, а затем поступать в кровоток.
■ Производное сахара и нуклеотида — UDР- глюкоза — предоставляет остаток глюкозы для синтеза гликогена под действием гликогенсинтазы; остатки присоединяются к невосстанавливающему концу цепи. Специальный фермент ветвления гликогена создает (α1 —> 6)-связи в точках ветвления.
■ Формирование новой частицы гликогена начинается с образования гликозидной связи между остатком глюкозы в UDР-глюкозе и остатком Туr в белке гликогенине. Затем из нескольких остатков глюкозы образуется короткий фрагмент-праймер для дальнейшего синтеза гликогена под действием гликоген- синтазы. Обе стадии процесса катализирует сам гликогенин.