ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 2. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ - 2014
ЧАСТЬ II. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ
Не терпит жирного Джек Спрат,
А постного — жена,
Но вместе, что им ни подай.
Съедают всё до дна.
Джон Кларк, Paroemiologia Anglo-Latina (Английские и латинские поговорки), 1639
17. КАТАБОЛИЗМ ЖИРНЫХ КИСЛОТ
Окисление длинноцепочечных жирных кислот до ацетил-СоА — главный способ получения энергии для многих организмов и тканей. Например, в сердце и печени млекопитающих этот путь обеспечивает примерно 80% энергетических потребностей при любых физиологических условиях. Электроны, забираемые у молекул жирных кислот в процессе окисления, проходят через дыхательную цепь, способствуя синтезу АТР; ацетил-СоА, полученный из жирных кислот, можно полностью окислить до СО2 в цикле Кребса, что приведет к дальнейшему сохранению энергии. У некоторых видов организмов и тканей есть альтернативные пути превращения ацетил-СоА. В печени ацетил-СоА может превратиться в кетоновые тела — водорастворимые богатые энергией вещества, доставляемые в мозг и другие ткани при отсутствии глюкозы. У высших растений ацетил-СоА в первую очередь служит биосинтетическим предшественником и лишь потом — питательным веществом. Несмотря на то что биологическая роль окисления жирных кислот у разных организмов различна, его механизм практически одинаков. Повторяющийся (циклический) четырехстадийный процесс β-окисления, в ходе которого жирные кислоты превращаются в ацетил-СоА, и есть главная тема данной главы.
В гл. 10 были описаны свойства триацилглицеринов (которые также называют триглицеринами или нейтральными жирами), благодаря которым их особенно удобно использовать в качестве запасаемых источников энергии. В состав жирных кислот входят длинные алкильные цепочки углеводородной природы, т. е. сильно восстановленные структуры для полного окисления которых необходима энергия (-38 кДж/г) вдвое больше, чем для окисления белков или углеводов при той же массе. Это преимущество сочетается с исключительной нерастворимостью липидов воде; в клетке триацилглицерины собираются в липидные капли, которые не повышают осмолярность цитозоля и не сольватируются. (В запасных полисахаридах, наоборот, вода, удерживаемая там при сольватации, может составлять примерно две трети общей массы запасаемых молекул.) А благодаря своей относительной химической инертности триацилглицерины могут накапливаться в клетках в больших количествах без риска нежелательных химических реакций с другими веществами клетки.
Однако те свойства, которые делают триацилглицерины хорошими запасными веществами, создают проблемы при использовании их в качестве источников энергии. Поскольку триацилглицерины нерастворимы в воде, их после всасывания сначала надо превратить в эмульсию, прежде чем расщеплять водорастворимыми ферментами в кишечнике, а усвоенные в кишечнике или взятые из запасающих тканей триацилглицерины должны находиться в кровотоке в связанном с белками виде, чтобы устранить проблему нерастворимости. Для преодоления относительной стабильности связей С-С в жирной кислоте, карбоксильная группа в положении С-1 активируется присоединением кофермента А, что способствует окислению ацильной группы жирной кислоты в положении С-3, или β — отсюда и название β-окисления.
В начале этой главы мы кратко обсудим синтез жирных кислот в организме и пути, которые приводят их к месту окисления, уделив особое внимание процессам у позвоночных. После этого будут описаны химические реакции окисления жирных кислот в митохондриях. Полное окисление жирных кислот до СО2 и Н2О происходит в три стадии: окисление длинноцепочечных жирных кислот до двухуглеродных фрагментов в виде ацетил-СоА (β-окисление); окисление ацетил-СоА до СО2 в цикле трикарбоновых кислот (гл. 16); и, наконец, передача электронов с восстановленных переносчиков в дыхательной цепи митохондрий (гл. 19). В этой главе основное внимание уделено первой стадии. Обсуждение β-окисления начнется с наиболее простого случая — полностью насыщенная жирная кислота с четным числом атомов углерода расщепляется до ацетил-СоА. Затем вкратце остановимся на дополнительных превращениях при распаде ненасыщенных жирных кислот или жирных кислот с нечетным числом атомов углерода. И наконец, обсудим различные пути β-окисления в особых органеллах пероксисомах и глиоксисомах, а также два менее распространенных пути катаболизма жирных кислот — ω- и α-окисление. В конце главы описан совсем другой путь превращения ацетил-СоА, полученного при β-окислении, у позвоночных: образование кетоновых тел в печени.
17.1. Расщепление, активация и транспорт жиров
Клетки способны получать богатые энергией жирные кислоты тремя способами: из жиров, содержащихся в пище, жиров, запасенных в клетке в виде липидных капель, и жиров, синтезированных в одном органе для экспорта в другой. Некоторые виды организмов в различных условиях используют все три способа, остальные — один или два. Например, позвоночные получают жиры с пищей, активируют жиры, запасенные в особых тканях (жировые ткани, состоящие из клеток, которые называются адипоцитами), и превращают в печени избыток углеводов пищи в жиры для экспорта в другие ткани. У населения промышленно развитых стран в среднем более 40% энергетических потребностей организма обеспечивается триацилглицеринами, содержащимися в пище (несмотря на то, что в большинстве диет рекомендуется получать в виде жиров не более 30% ежедневного запаса энергии). Триацилглицерины обеспечивают более половины энергетических потребностей некоторых органов, в частности печени, сердца и скелетных мышц в покое. Запасенные триацилглицерины являются чуть ли не единственным источником энергии у зимующих животных и перелетных птиц. Простейшие получают жиры, поглощая организмы, стоящие ниже их в цепи питания, а некоторые из них запасают жиры в виде липидных капель в цитозоле. Сосудистые растения в период роста активируют жиры, хранящиеся в семенах, однако в других ситуациях у них получение энергии не зависит от жиров.
Жиры пищи всасываются в тонкой кишке
Прежде чем потребленные с пищей триацилглицерины смогут всосаться стенками кишечника позвоночных, их надо перевести из нерастворимых макроскопических жировых капель в мелкодисперсные микроскопические мицеллы. Такую солюбилизацию осуществляют соли желчных кислот, например, таурохолевой кислоты (с. 506, т. 1), которые образуются в печени из холестерина, накопленного в желчном пузыре, и выводятся в тонкую кишку после поглощения жирной пищи. Соли желчных кислот имеют амфифильную природу соединения и действуют как биологические детергенты, которые превращают жиры пищи в мицеллы из смеси солей желчных кислот и триацилглицеринов (рис. 17-1, стадия (1)). При образовании мицелл значительно увеличивается доля липидных молекул, доступных для действия водорастворимых липаз в кишечнике, которые в свою очередь превращают триацилглицерины в моноацилглицерины (моноглицерины) и диацилглицерины (диглицерины), свободные жирные кислоты и глицерин (стадия (2)).
Рис. 17-1. Путь липидов пищи у позвоночных. Расщепление и всасывание липидов пищи происходит в тонкой кишке, а жирные кислоты, полученные из триацилглицеринов, упаковываются и доставляются в мышцы и жировые ткани. Все восемь стадий обсуждаются в тексте.
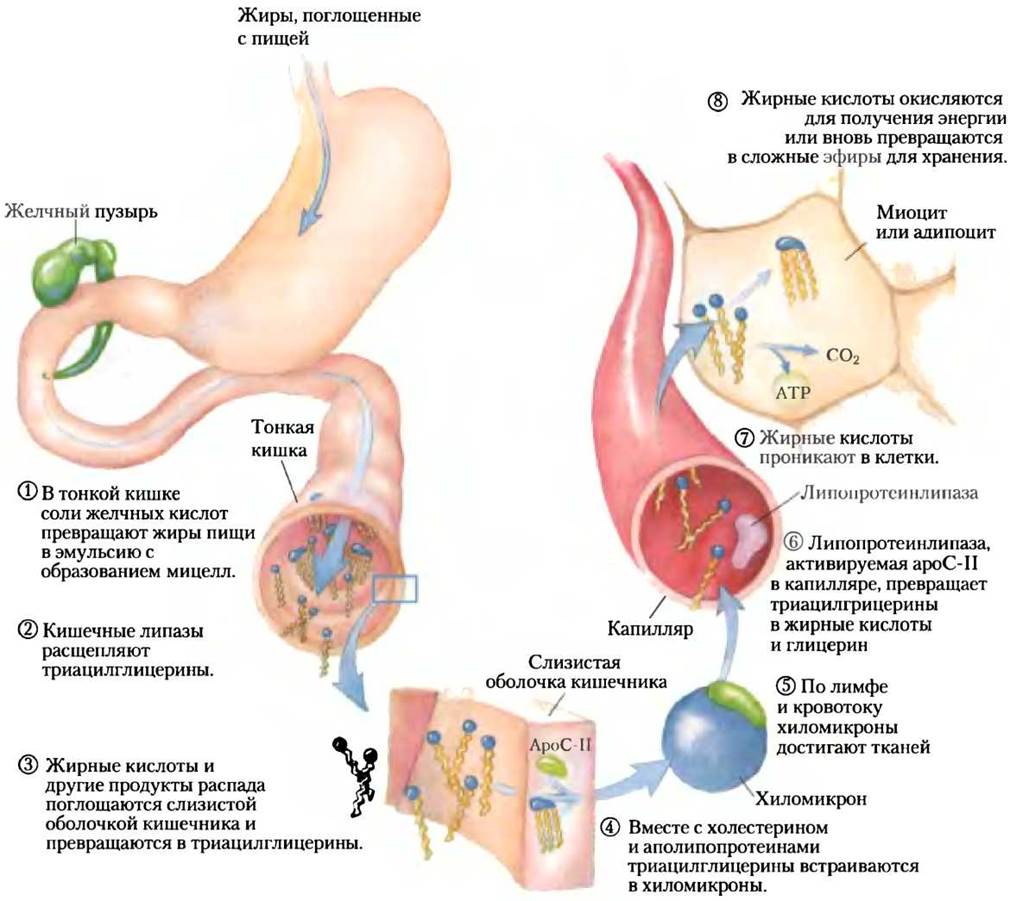
Эти продукты действия липаз диффундируют в клетки эпителия (слизистая оболочка кишечника), выстилающие кишечник (стадия (3)), где они вновь превращаются в триацилглицерины, а соединяясь с холестерином пищи и специфическими белками, образуют липопротеиновые комплексы — хиломикроны (рис. 17-2; см. также рис. 17-1, стадия (4)).
Рис. 17-2. Молекулярная структура хиломикрона. На поверхности слой фосфолипидов с «головками», обращенными к водной фазе. Триацилглицерины (показаны желтым) изолированы и находятся внутри; они составляют более 80% массы частицы. Несколько аполипопротеинов, выступающих на поверхности (В-48, С-III, С-II), — это сигналы при поглощении и метаболизме содержимого хиломикрона. Диаметр хиломикрона составляет от 100 до 500 нм.
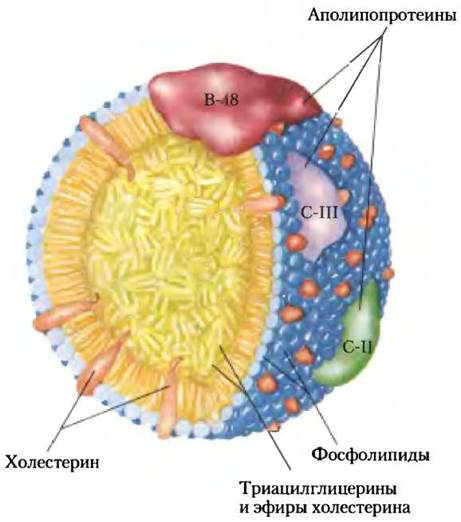
Аполипопротеины — белки крови, связывающие липиды; они отвечают за транспорт триацилглицеринов, фосфолипидов, холестерина и его эфиров между органами. Аполипопротеины («апо» означает «отделенный» или «изолированный», т. е. белок в его свободной от липидов форме), соединяясь с липидами, могут образовать несколько липопротеиновых частиц сферической формы с гидрофобными липидами внутри, а с гидрофильными боковыми цепями белков и липидными «головками» на поверхности. Разнообразные комбинации липидов и белков образуют частицы разной плотности, начиная с хиломикронов и липопротеинов очень низкой плотности (ЛПОНП) и заканчивая липопротеинами очень высокой плотности (ЛПВП), которые можно разделить ультрацентрифугированием. Структура этих липопротеиновых частиц и их роль в липидном транспорте подробно описываются в гл. 21.
Белковые фрагменты липопротеинов распознаются рецепторами на поверхности клеток. При всасывании липидов из кишечника хиломикроны, содержащие аполипопротеин С-II (ароС-II), направляются в лимфатическую систему, после чего поступают в кровь, которая доставляет их к мышцам и жировым тканям (рис. 17-1, стадия (5)). В капиллярах этих тканей внеклеточный фермент липопротеинлипаза, активируемая ароС-II, гидролизует триацилглицерины до жирных кислот и глицерина (стадия (6)), которые поглощаются клетками тканей (стадия (7)). В мышцах для получения энергии жирные кислоты окисляются; в жировых тканях они вновь превращаются в сложные эфиры и хранятся в виде триацилглицеринов (стадия (8)).
Остатки хиломикронов, лишенные большинства своих триацилглицеринов, но пока содержащие холестерин и аполипопротеины, поступают через кровь в печень, где поглощаются в процессе эндоцитоза при содействии рецепторов аполипопротеинов. Триацилглицерины, попадающие таким путем в печень, могут быть окислены для получения энергии или предоставления исходных молекул для синтеза кетоновых тел, как описано в разд. 17.3. Если в рационе питания жирных кислот содержится больше, чем их требуется в качестве непосредственных источников энергии или предшественников молекул, в печени они превращаются в триацилглицерины, которые со специфическими аполипопротеинами упаковываются в ЛПОНП. По кровотоку ЛПОНП достигают жировых тканей, где в ади- поцитах триацилглицерины извлекаются и собираются в липидные (жировые) капли.
Активацию запасенных триацилглицеринов инициируют гормоны
Нейтральные липиды накапливаются в адипоцитах (и в синтезирующих стероиды клетках коры надпочечников, яичников и семенников) в виде липидных капель с триацилглицеринами и стериновыми эфирами в центре и монослоем из фосфолипидов вокруг. Поверхность этих капель покрыта перилипинами (семейство белков), ограничивающими доступ к липидным каплям, предотвращая таким образом несвоевременную активацию липидов. Когда гормоны передают сигнал о потребности в энергии для метаболизма, триацилглицерины в жировой ткани активируются (покидают жировые капли) и доставляются к тканям (скелетным мышцам, сердцу и корковому веществу почек), в которых жирные кислоты могут быть окислены для получения энергии. Гормоны адреналин и глюкагон, секретируемые в ответ на низкий уровень глюкозы крови, активируют фермент аденилатциклазу в плазматической мембране клеток жировой ткани (рис. 17-3), а она в свою очередь порождает внутриклеточный вторичный мессенджер — циклический АМР (сАМР; см. рис. 12-4). сАМР- зависимая протеинкиназа (РКА) фосфорилирует перилипин А, который после этого заставляет гормон-чувствительную липазу в цитозоле переместиться к поверхности липидной капли, где она может начать гидролиз триацилглицеринов до жирных кислот и глицерина. Кроме того, РКА фосфорилирует гормон-чувствительную липазу, удваивая или утраивая ее активность, однако более чем 50-кратный рост активации жиров, инициируемый адреналином, обусловлен в первую очередь фосфорилированием перилипина. Клетки с дефектными генами перилипина практически не реагируют на возрастающий уровень сАМР; их гормон-чувствительная липаза не взаимодействует с липидными каплями.
Рис. 17-3. Активация триацилглицеринов, запасенных в жировой ткани. Как только низкий уровень глюкозы в крови вызывает высвобождение глюкагона, (1) гормон связывается со своим рецептором на мембране клетки жировой ткани и тем самым посредством G-белка (2) стимулирует аденилатциклазу к образованию сАМР. Это активирует РКА, которая фосфорилирует (3) гормон- чувствительную липазу и (4) молекулы перилипина на поверхности липидной капли. Фосфорилирование перилипина позволяет гормон-чувствительной липазе подобраться к поверхности липидной капли, где (5) она гидролизует триацилглицерины до свободных жирных кислот. (6) Жирные кислоты покидают жировую клетку и переносятся кровотоком, связываясь с сывороточным альбумином; затем они освобождаются от альбумина и (7) проникают в миоцит с помощью особого переносчика жирных кислот. (8) В миоците жирные кислоты окисляются до СО2, а выделившаяся энергия сохраняется в форме АТР, который «питает» сокращение мышц и другие процессы метаболизма в клетке, нуждающиеся в энергии.
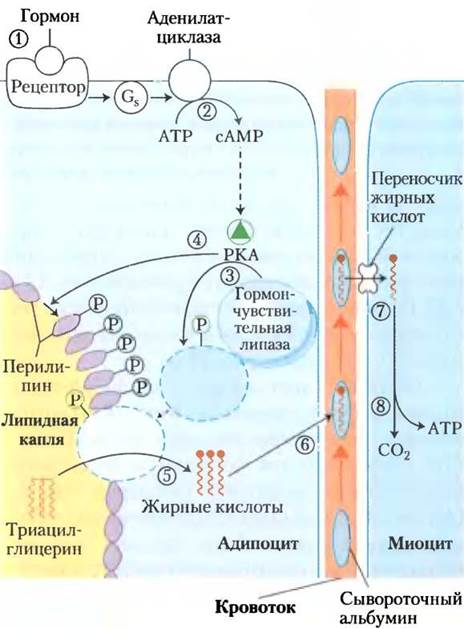
Как только гормон-чувствительная липаза гидролизует триацилглицерины в адипоцитах, образовавшиеся жирные кислоты (свободные жирные кислоты, СЖК) попадают из жировой клетки в кровь, где они связываются с белком сывороточным альбумином. Этот белок (Мr 66 000), на который приходится примерно половина общего белка сыворотки, нековалентно связывает 10 жирных кислот на одну мономерную единицу белковой молекулы. Связанные с этим растворимым белком нерастворимые жирные кислоты переносятся к тканям, например, к скелетным мышцам, сердцу и корковому веществу почек. В этих тканях жирные кислоты отделяются от альбумина и с помощью переносчиков на плазматической мембране доставляются внутрь клеток для выполнения своих энергетических функций.
Рис. 17-4- Глицерин в гликолитическом пути.
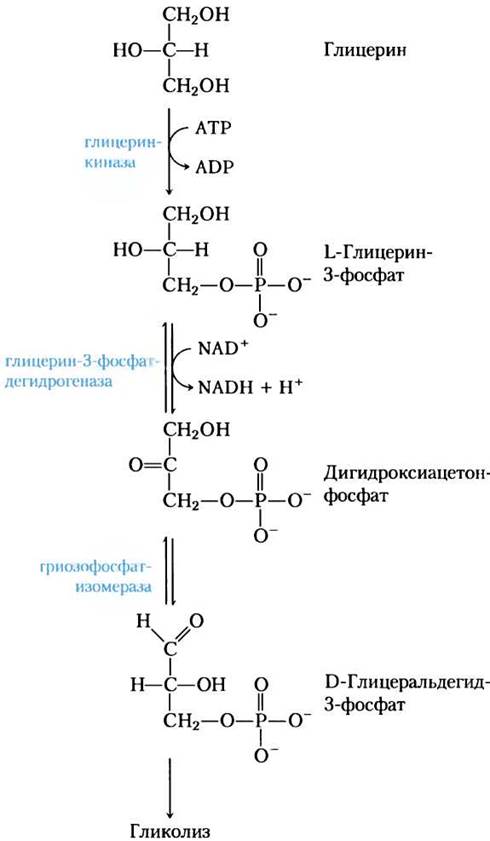
Около 95% биологически полезной энергии триацилглицеринов сконцентрировано в их трех длинноцепочечных жирных кислотах; а на глицериновый остаток приходится всего лишь 5%. Глицерин, образующийся при действии липазы, фосфорилируется глицеринкиназой (рис. 17-4), а получающийся в результате глицерин-3-фосфат окисляется до дигидрок- сиацетонфосфата. Гликолитический фермент триозофосфатизомераза превращает это соединение в глицеральдегид-3-фосфат, который окисляется в процессе гликолиза.
Жирные кислоты активируются и переносятся в митохондрии
В 1948 г. Юджин Кеннеди и Альберт Ленинджер показали, что ферменты окисления жирных кислот в клетках животных находятся в матриксе митохондрий. Жирные кислоты с цепями из 12 и менее атомов углерода попадают в митохондрии без помощи мембранных переносчиков. Состоящие из 14 и более атомов углерода, а это большинство СЖК, получаемых с пищей или из жировой ткани, не способны пройти через митохондриальные мембраны. Вначале они должны пройти через три ферментативные реакции карнитинового переноса. Первая реакция катализируется особыми изоферментами (они специфичны к жирным кислотам с короткой, средней или более длинной углеродными цепями), которые находятся на внешней митохондриальной мембране. Это ацил- СоА-синтетазы, и они активируют главным образом следующую реакцию:
Жирная кислота + СоА + АТР ⇄ ацил-СоА + АМР + PPi
Таким образом, ацил-СоА-синтетазы катализируют образование тиоэфирной связи между карбоксильной группой жирной кислоты и тиоловой группой кофермента А, что дает образование ацил-СоА-производных жирной кислоты и сопряжено с распадом АТР до АМР и PPi. (Чтобы представить себе, как выделение свободной энергии разрыва фосфоангидридных связей в молекуле АТР может быть сопряжено с образованием высокоэнергетического соединения, обратитесь к описанию этой реакции в гл. 13 на с. 37.) Реакция идет в две стадии и включает ациладенилат жирной кислоты в качестве промежуточного соединения (рис. 17-5).
Рис. 17-5. Механизм реакции. Превращение жирной кислоты в ацил-СоА-производное. Превращение катализируется ацил-СоА-синтетазой и неорганической пирофосфатазой. Активация жирной кислоты путем образования ацил-СоА-производного происходит в две стадии. Суммарная реакция сильно экзергоничная. Механизм действия ацил-СоА-синтетазы
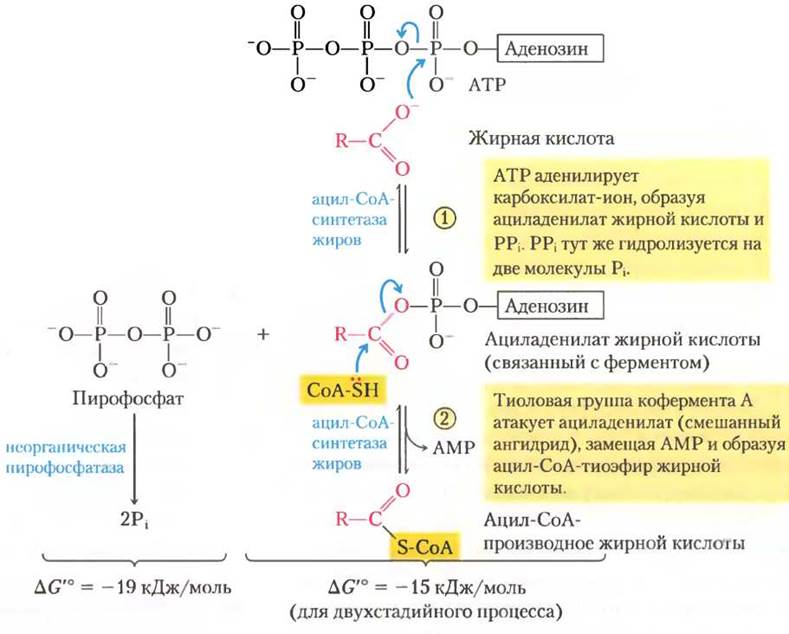
Подобно ацетил-СоА, ацил-СоА-производные жирных кислот — это высокоэнергетические соединения; их гидролиз до СЖК и СоА сопровождается большим отрицательным изменением стандартной свободной энергии (∆G'° « -31 кДж/моль). Образование ацил-СоА- производных гораздо более выгодно благодаря гидролизу двух высокоэнергетических связей в АТР; пирофосфат, образующийся в реакции активации, тут же подвергается гидролизу под действием неорганической пирофосфатазы (рис. 17-5, слева), которая направляет реакцию активации в сторону образования ацил-СоА-производного жирной кислоты. Суммарная реакция:
Жирная кислота + СоА + АТР —> ацил-СоА +AMP+2Pi (17-1)
∆G'° = -34 кДж/моль
Ацил-СоА-эфиры жирных кислот, образующиеся на цитозольной стороне внешней митохондриальной мембраны, могут переноситься в митохондрию и окисляться для образования АТР или же используются в цитозоле для синтеза мембранных липидов. Жирные кислоты, предназначенные для окисления в митохондриях, временно присоединяются к гидроксильной группе карнитина, образуя ацилкарнитиновое производное, что и есть вторая стадия трансмембранного транспорта. Эта переэтерификация катализируется карнитинацилтрансферазой I (Мr 88 000) на внешней мембране. В настоящее время нет свидетельств того, проникает ли ацил-СоА через внешнюю мембрану и превращается в карнитиновый эфир в межмембранном пространстве (рис. 17-6) или же карнитиновый эфир образуется в цитозоле снаружи от внешней мембраны, а затем уже через нее попадает в межмембранное пространство. В любом из этих случаев переход в межмембранное пространство происходит через огромные поры (образованные белком порином) на внешней мембране. После этого ацилкарнитиновый эфир жирной кислоты поступает в матрикс по механизму облегченной диффузии через ацилкарнитиновый/карнитиновый переносчик внутренней митохондриальной мембраны (рис. 17-6).
Рис. 17-6. Проникновение жирной кислоты в митохондрию через ацилкарнитиновый/ карнитиновый переносчик. После того как ацилкарнитиновое производное жирной кислоты образуется вблизи внешней мембраны или в межмембранном пространстве, оно проникает в матрикс по механизму облегченной диффузии через переносчик на внутренней мембране. В матриксе ацильная группа переносится на митохондриальный кофермент А, освобождая карнитин для последующего возвращения в межмембранное пространство через тот же самый переносчик. Ацилтрансфераза I ингибируется малонил-коферментом А, первым промежуточным соединением в синтезе жирных кислот (см. рис. 21-1). Это ингибирование предотвращает одновременный синтез и распад жирных кислот.
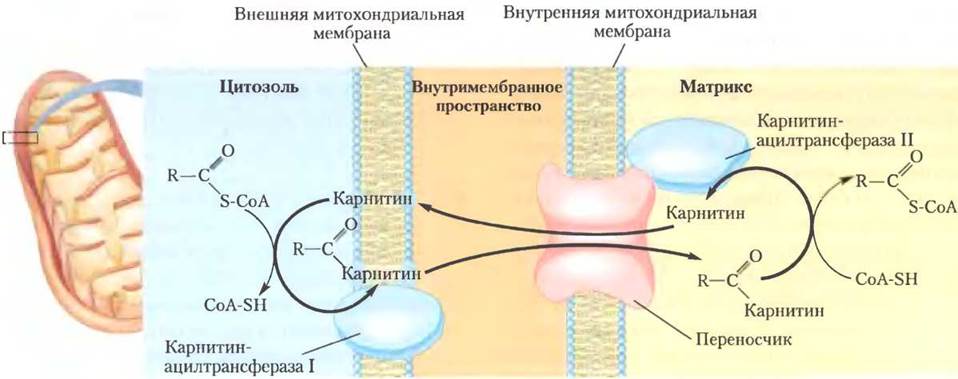
Третья (последняя) стадия карнитинового переноса состоит в том, что ацильная группа жирной кислоты с помощью карнитинацилтрансферазы II (т. е. ферментативно) переносится с карнитина на внутримитохондриальный кофермент А. Этот изофермент, расположенный на внутренней поверхности внутренней митохондриальной мембраны, регенерирует ацил-СоА-производное жирной кислоты и высвобождает его вместе со свободным карнитином в матрикс (рис. 17-6). Карнитин вновь проникает в межмембранное пространство через ацилкарнитиновый/карнитиновый переносчик.
Этот трехстадийный процесс переноса жирных кислот в митохондрии, включающий образование сложного эфира с СоА, трансэтерификацию с карнитином, после чего следует перенос и образование нового сложного эфира с СоА, связывает между собой два изолированных друг от друга пула кофермента А и ацил-СоА-производного жирной кислоты, один из которых находится в цитозоле, а другой в митохондриях. Эти пулы выполняют различные функции. Кофермент А в митохондриальном матриксе активно используется в окислительном расщеплении пирувата, жирных кислот и некоторых аминокислот, тогда как кофермент А в цитозоле участвует в биосинтезе жирных кислот (см. рис. 21-10). Ацил-СоА-производное жирной кислоты в цитозольном пуле может использоваться для синтеза мембранных липидов или участвовать в переносе в митохондриальный матрикс для окисления и образования АТР. Превращение в карнитиновый эфир направляет ацильный фрагмент жирной кислоты на путь окисления.
Опосредованное карнитином проникновение лимитирует общую скорость окисления жирных кислот в митохондриях и, как следует из дальнейшего обсуждения, служит точкой регуляции. Как только ацил-СоА-производное жирной кислоты оказывается внутри митохондрии, оно подвергается действию целого ряда ферментов матрикса.
Краткое содержание раздела 17.1 Расщепление, активация и транспорт жиров
■ У животных жирные кислоты триацилглицеринов дают значительную долю окислительной энергии. Триацилглицерины пищи в тонком кишечнике превращаются в эмульсию под действием солей желчных кислот, гидролизуются кишечными липазами, всасываются эпителиальными клетками кишечника, вновь превращаются в триацилглицерины, а затем включаются в состав хиломикронов вместе со специфическими аполипопротеинами.
■ Хиломикроны доставляют триацилглицерины к тканям, где липопротеинлипаза высвобождает из них свободные жирные кислоты для проникновения в клетки. Триацилглицерины, хранящиеся в жировой ткани, активируются гормон-чувствительной триацилглицеринлипазой. Образовавшиеся жирные кислоты связываются с сывороточным альбумином и переносятся кровью к сердцу, скелетным мышцам и другим тканям, использующим жирные кислоты в качестве источников энергии.
■ Оказавшись внутри клетки, жирные кислоты активируются у внешней митохондриальной мембраны превращением в ацил- СоА-тиоэфиры жирных кислот. Ацил-СоА- производные, которые должны быть окислены, проникают в митохондрию с помощью карнитинового челнока в три стадии.