ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 2. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ - 2014
ЧАСТЬ II. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ
17. КАТАБОЛИЗМ ЖИРНЫХ КИСЛОТ
17.2. Окисление жирных кислот
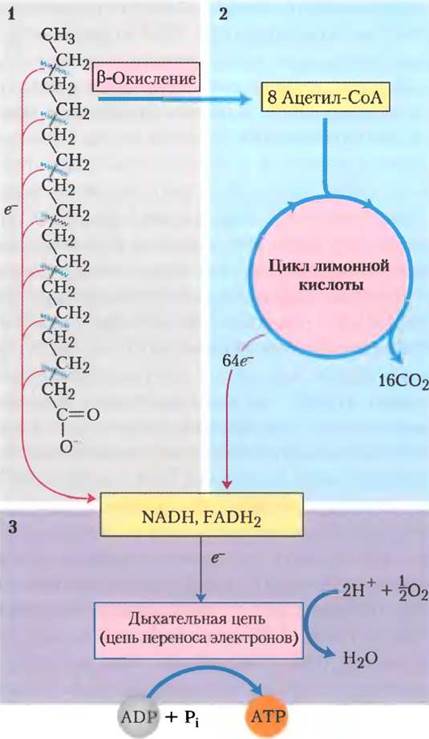
Как уже отмечалось, митохондриальное окисление жирных кислот происходит в три стадии (рис. 17-7). На первой стадии происходит β-окисление, где жирные кислоты подвергаются последовательному окислительному отщеплению двух-углеродных фрагментов в виде ацетил-СоА, начиная с карбоксильного конца. Например, пальмитиновая кислота (при pH 7 пальмитат-ион), состоящая из 16 атомов углерода, подвергается семи последовательным окислениям, теряя каждый раз по два атома углерода в виде ацетил-СоА. После седьмой реакции последние два углерода от пальмитата (в пальмиате они были С-15 и С-16) остаются в виде ацетил-СоА. Конечным результатом является превращение 16-углеродной цепи пальмитата в восемь двухуглеродных (ацетильных) групп в ацетил-СоА. Для образования каждой молекулы ацетил-СоА необходимо удаление дегидрогеназами четырех атомов водорода (двух пар электронов и четырех Н+) от ацила жирной кислоты.
На второй стадии окисления жирных кислот ацетильные группы ацетил-СоА окисляются до СО2 в цикле трикарбоновых кислот, который также происходит в матриксе митохондрий. Так, ацетил-СоА, образованный из жирных кислот, попадает на конечный общий путь окисления вместе с ацетил-СоА, полученным из глюкозы в процессе гликолиза и окисления пирувата (см. рис. 16-1). На первых двух стадиях окисления жирных кислот образуются восстановленные переносчики электронов NADH и FADH2, отдающие на третьей стадии свои электроны в дыхательную цепь митохондрий, где электроны попадают на кислород и происходит фосфорилирование ADP до АТР (рис. 17-7). Таким образом, энергия, выделяемая при окислении жирных кислот, запасается в виде АТР.
Рис. 17-7. Стадии окисления жирных кислот. 1. Жирная кислота с длинной углеродной цепью окисляется, образуя ацетильные остатки ацетил-СоА. Этот процесс называется β-окислением. 2. В цикле трикарбоновых кислот ацетильные группы окисляются до СО2. 3. Электроны, полученные при окислении в путях 1 и 2, переходят на О2 в дыхательной цепи митохондрий, давая энергию для синтеза АТР путем окислительного фосфорилирования.
Теперь вернемся к первой стадии окисления жирных кислот, и начнем с простого случая окисления ацила насыщенной жирной кислоты с четным числом атомов углерода, а затем обратимся к немного более сложному окислению ненасыщенной жирной кислоты и кислоты с нечетным числом атомов. Кроме того, рассмотрим регуляцию окисления жирных кислот, процессы β-окисления, происходящие в других органеллах (не в митохондриях), и наконец, два менее распространенных процесса катаболизма жирных кислот — α- и ω-окисление.
β-Окисление насыщенных жирных кислот проходит в четыре основные стадии
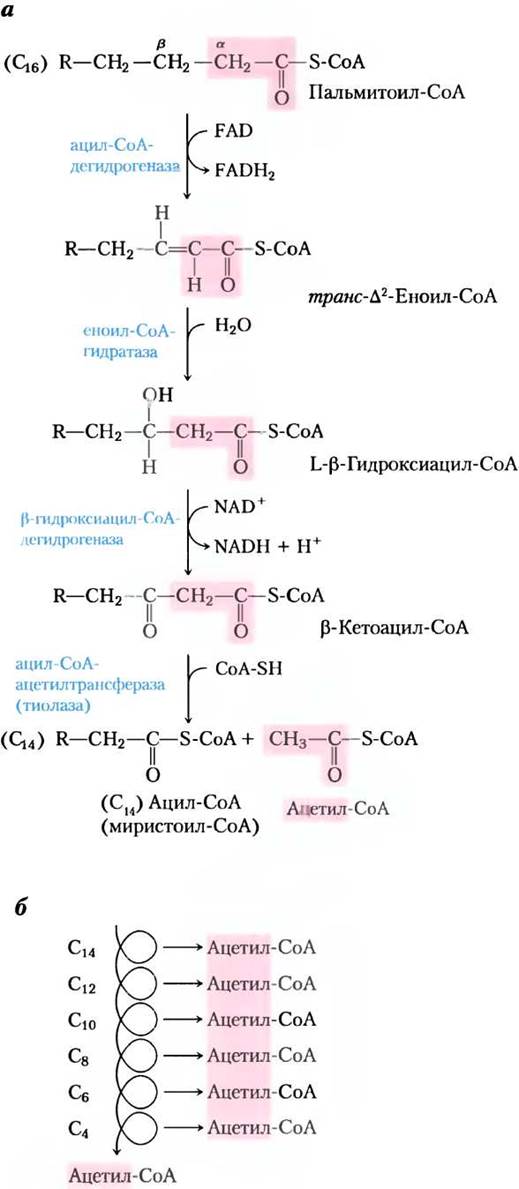
Первая стадия окисления жирных кислот состоит из четырех ферментативных катализируемых реакций (рис. 17-8, а). В первой реакции при дегидрировании ацил-СоА-производного жирной кислоты образуется двойная связь между α- и β-атомами углерода (С-2 и С-3) и получается транс-∆2-еноил-СоА (символ ∆2 означает положение двойной связи при С-2; номенклатуру жирных кислот см. на с. 489, т. 1). Обратите внимание, что новая двойная связь имеет транс-конфигурацию, а у природных ненасыщенных жирных кислот при двойных связях цис-конфигурации. Какую роль играет эта конфигурация, рассмотрено позднее.
Рис. 17-8. β-Окисление. а — в четырех последовательных реакциях от карбоксильного конца кислоты (здесь пальмитат (16С) в виде пальмитоил-СоА) отщепляется по одной ацетильной группе (выделена розовым цветом) в виде ацетил-СоА. б — в результате шести реакций образуются семь молекул ацетил-СоА, а седьмая возникает из последних двух атомов углерода 16-углеродной цепи. Всего получается восемь молекул ацетил-СоА.
Первая реакция катализируется одним из трех изоферментов, которые называются ацил- СоА-дегидрогеназами, каждый из этих изоферментов специфичен к ацилу жирной кислоты с определенной длинной углеродной цепи: ацил- СоА-дегидрогеназа очень длинной цепи (VLCAD, от англ. very-long-chain acyl-CoA dehydrogenase) действует на жирные кислоты с 12-18 атомами углерода; ацил-СоА-дегидрогеназа средней цепи (MCAD, от англ. medium-chain acyl-CoA dehydrogenase) — на жирные кислоты с 4-14 атомами углерода и ацил-СоА-дегидрогеназа короткой цепи (SCAD, от англ. short-chain acyl-CoA dehydrogenase) — на жирные кислоты с 4-8 атомами углерода. Эти три изофермента относятся к флавопротеинам и содержат FAD (см. рис. 13-27) в качестве простетической группы. Электроны от ацил-СоА-производного переносятся на FAD, и восстановленная форма дегидрогеназы тут же отдает их переносчику электронов в дыхательной цепи митохондрий — электронпереносящему флавопротеину (ETF, от англ. electron-transferringflavoprotein) (см. рис. 19-8). Катализируемое ацил-СоА-дегидрогеназой окисление аналогично дегидрированию сукцината в цикле трикарбоновых кислот (с. 198); в обеих реакциях фермент прикреплен к внутренней мембране, между α- и β-атомами углерода карбоновой кислоты образуется двойная связь, в роли акцептора электронов выступает FAD и в итоге электроны поступают в дыхательную цепь и попадают на кислород, при этом синтезируется примерно 1,5 молекул АТР на одну пару электронов.
Во второй реакции цикла β-окисления (рис. 17-8, а) по двойной связи транс-∆2-еноил- СоА присоединяется вода с образованием L-стерео- изомера β-нидроксиацил-СоА β-гидроксиацил- СоА). Эта реакция, катализируемая еноил-СоА- гидратазой, формально аналогична реакции фумаразы в цикле трикарбоновых кислот, в которой Н2О присоединяется по двойной α-β-связи (с. 198).
В третьей реакции L-β-гидроксиацил-СоА дегидрируется под действием β-гидроксиацил- СоА-дегидрогеназы, образуя β-кетоацил-СоА; в роли акцептора электронов выступает NAD+. Этот фермент полностью специфичен к L-стереоизомеру гидроксиацил-СоА. Образующийся в реакции NADH отдает электроны NADH- дегидрогеназе, электронному переносчику дыхательной цепи, и как только электроны попадают на О2, из ADP образуется АТР. Реакция, катализируемая p-гидроксиацил-СоА-дегидрогеназой, очень напоминает реакцию малатдегидрогеназы в цикле трикарбоновых кислот (с. 199).
Четвертая (последняя) реакция цикла 13- окисления катализируется ацил-СоА-ацетилтрансферазой, которую чаще называют тиолазой, и которая способствует реакции β-кетоацил-СоА с молекулой свободного кофермента А для отщепления терминального двухуглеродного карбоксильного фрагмента исходной жирной кислоты в виде ацетил-СоА. Другим продуктом является тиоэфир кофермента А и жирной кислоты, теперь уже укороченный на два атома углерода (рис. 17-8, а). Эта реакция называется тиолизом (по аналогии с гидролизом), поскольку β-кетоацил-СоА расщепляется в реакции с тиоловой группой кофермента А.
Последние три «шага» этой четырехстадийной последовательности катализируются одним из двух наборов ферментов в зависимости от длины ацильной цепочки жирной кислоты. Что касается цепей, состоящих из 12 и более атомов углерода, такие реакции катализируются мультиферментным комплексом, связанным с внутренней митохондриальной мембраной, трехфункциональным белком (TFP, от англ. trifunctional protein). TFP представляет собой гетерооктамер из α4β4-субъединиц. Каждая субъединица а выполняет две функции: еноил-СоА-гидратазы и β-гидроксиацил-СоА-дегидрогеназы; субъединицы β обладают тиолазной активностью. Такое тесное взаимодействие трех ферментов способно обеспечить эффективную передачу субстрата от одного активного центра другому, обходясь без диффузии промежуточных соединений с поверхности фермента. Как только TFP укорачивает ацильную цепь жирной кислоты до 12 и менее атомов углерода, дальнейшие процессы окисления в матриксе катализирует набор из четырех растворимых ферментов.
Как уже упоминалось ранее, одинарная связь между метиленовыми группами (-СН2-) жирных кислот достаточно стабильна. β-Окислительный каскад реакций является превосходным механизмом дестабилизации и разрыва этих связей. Первые три реакции β-окисления делают связь С-С гораздо менее прочной, в ней теперь α-углерод (С-2) связан с двумя карбонильными углеродами (β-кетоацил-СоА). Влияние кетона на p-углерод (С-3) делает его удачной мишенью для нуклеофильной атаки -SH-группы кофермента А, которую катализирует тиолаза. Кислотность а-водорода и резонансная стабилизация карбаниона, образующегося при отщеплении этого водорода, делает -CH2-CO-S-CoA хорошей уходящей группой, облегчая тем самым разрыв α-β-связи.
Ацетил-СоА и АТР образуются при повторении четырех реакций β-окисления
При каждом цикле последовательных реакций β-окисления от ацил-СоА-производного длинноцепочечной жирной кислоты отщепляется одна молекула ацетил-СоА, две пары электронов и четыре протона (Н+), укорачивая ацил на два атома углерода. Уравнение одного цикла, начинающегося с эфира кофермента А, в данном случае пальмитата, таково:
Пальмитоил-СоА + СоА + FAD + NAD+ + Н2О —> миристоил-СоА + ацетил-СоА + FADH2 + NADH + Н+ (17-2)
После отщепления от пальмитоил-СоА одной молекулы ацетил-СоА остается тиоэфир кофермента А и укороченной на два углерода жирной кислоты (миристат — 14 атомов углерода). Миристоил-СоА теперь может пройти через еще один цикл из четырех реакций β-окисления, который в точности аналогичен первому, образуя вторую молекулу ацетил-СоА и лауроил-СоА — тиоэфир кофермента А и 12-углеродного лаурата. Чтобы окислить одну молекулу пальмитоил- СоА до восьми молекул ацетил-СоА, требуется семь оборотов цикла реакций β-окисления (рис. 17-8, б). Общее уравнение имеет вид
Пальмитоил-СоА + 7СоА + 7FAD + 7NAD+ + 7Н2О —> 8 ацетил-СоА + 7FADH2 + 7NADH + 7Н+ (17-3)
Каждая молекула FADH2, образующаяся при окислении жирной кислоты, отдает два электрона в дыхательную цепь, а при переносе каждой электронной пары на О2образуется примерно 1,5 молекул АТР. Точно так же каждая образующаяся молекула NADH отдает пару электронов митохондриальной NADH-дегидрогеназе, а в последующем переносе каждой пары электронов на О2 образуется примерно 2,5 молекул АТР. Таким образом, в один оборот цикла при отщеплении двухуглеродного фрагмента образуется 4 молекулы АТР. Обратите внимание, что в этом процессе также образуется вода. Перенос электронов с NADH или FADH2 на О2 дает одну молекулу Н2О на пару электронов. При восстановлении О2 также затрачивается один Н+ на молекулу NADH: NADH + Н+ + 1/2О2 — NAD+ + Н2О. Окисление жирных кислот обеспечивает животных, впадающих в зимнюю спячку, метаболической энергией, теплом и водой — всем необходимым для выживания животного, которое не ест и не пьет длительное время (доп. 17-1). Верблюды в дополнение к скудным ресурсам их природной среды обитания получают воду при окислении жиров, которые запасают в своем горбу.
Общее уравнение окисления пальмитоил- СоА до восьми молекул ацетил-СоА, включая перенос электронов и окислительное фосфорилирование, таково
Пальмитоил-СоА + 7СоА + 7О2 + 28Рi + 28ADP —> 8 ацетил-СоА + 28АТР + 7Н2O (17-4)
Дополнение 17-1. У медведей во время зимней спячки происходит β-окисление жиров
Многие животные зависят от запасов жира для получения энергии во время зимней спячки, в периоды миграции и в других ситуациях. Один из наиболее ярких примеров, как может быть приспособлен обмен жиров у животных, встречается у впадающих в зимнюю спячку медведей-гризли. Эти животные пребывают в состоянии спячки в течение семи месяцев. В отличие от большинства спящих в зимний период животных, медведи поддерживают температуру тела в интервале 32-35 °С, т. е. вблизи нормального уровня (вне периода спячки). Хотя медведь и тратит около 25 000 кДж/сут (6000 ккал/сут), он не ест, не пьет и не испражняется несколько месяцев.
Экспериментальные исследования показали, что зимующие медведи-гризли используют жир своего тела в качестве источника энергии. Окисление жиров дает достаточно энергии для поддержания температуры тела, синтеза аминокислот и белков и другой активности, связанной с потреблением энергии, например, для трансмембранного транспорта. Как говорилось в основном тексте, при окислении жиров также в больших количествах образуется вода, что восполняет ее потерю в процессе дыхания. Глицерин, выделяющийся при разложении триацилглицеринов, превращается в глюкозу крови в процессе глюконеогенеза. Моча, образующаяся при распаде аминокислот, вновь всасывается в почках и перерабатывается, аминогруппы повторно используются для синтеза аминокислот с целью поддержания баланса белков в теле.
Подготавливаясь к продолжительному периоду спячки, медведи запасают жиры в огромных количествах. Поздней весной и летом взрослому медведю- гризли необходимо около 38 000 кДж/сут, а с приближением зимы он ест 20 часов в сут с тем, чтобы получать энергию до 84 000 кДж в сут. Такое изменение питания происходит в ответ на сезонные изменения в гормональном синтезе. Из-за исключительно интенсивного потребления углеводов в период набора веса в организме животного образуются в огромных количествах триацилглицерины. Другие впадающие в зимнюю спячку виды животных, включая карликовую соню, также накапливают в теле значительное количество жиров.
Гризли в окрестностях р. Макнейл (Канада) готовится к спячке.

В дальнейшем ацетил-СоА может окисляться в цикле трикарбоновых кислот
Ацетил-СоА, образующийся при окислении жирных кислот, может окисляться до СО2 и Н2О в цикле трикарбоновых кислот. Следующее уравнение отражает сопряжение второй стадии окисления пальмитоил-СоА с фосфорилированием на третьей стадии:
8 Ацетил-СоА + 16 О2 + 80 Рi + 80 ADP —> 8 СоА + 80 АТР + 16 СO2 + 16 Н2O (17-5)
Суммируя уравнения 17-4 и 17-5, получаем уравнение полного окисления пальмитоил-СоА до углекислого газа и воды:
Пальмитоил-СоА + 23 O2 + 108 Рi + 108 ADP —> СоА + 108 АТР + 16 СO2 + 23 Н2O (17-6)
В табл. 17-1 представлен суммарный выход NADH, FADH2 и АТР на последовательных реакциях окисления пальмитоил-СоА. Обратите внимание, что при активации пальмитата до пальмитоил- СоА разрываются обе фосфоангидридные связи в молекуле АТР (рис. 17-5), значит энергетические затраты на активацию жирной кислоты эквивалентны двум АТР, и поэтому в целом на одну молекулу пальмитата образуется 106 АТР. Изменение стандартной свободной энергии окисления пальмитата до СO2 и Н2Oсоставляет около 9800 кДж/моль. В стандартных условиях энергия, возвращенная в виде энергии фосфатных связей АТР, равна 106 • 30,5 кДж/моль = 3230 кДж/моль, т. е. около 33% теоретического значения. Однако, если рассчитывать изменения свободной энергии, исходя из действующих концентраций реагентов и продуктов во внутриклеточных условиях (см. доп. 13-1), возврат свободной энергии составит более 60%; таким образом, сохранение энергии чрезвычайно эффективно.
Таблица 17-1. Выход АТР при окислении одной молекулы пальмитоил-СоА до СО2 и Н2О
Фермент, катализирующий стадию окисления |
Количество образующихся NADH или FADH2 |
Количество образующегося ATP* |
Ацил- СоА-дегидрогеназа |
7 FADH2 |
10,5 |
β-Оксиацил- СоА-дегидрогеназа |
7 NADH |
17,5 |
Изоцитратдегид рогеназа |
8 NADH |
20 |
α-Кетоглутарат дегидрогеназа |
8 NADH |
20 |
Сукцинил-СоА-синтетаза |
8** |
|
Сукцинатдегидрогеназа |
8 FADH2 |
12 |
Малатдегидрогеназа |
8 NADH |
20 |
Всего |
108 |
* Согласно расчетам, в митохондриях при окислительном фосфорилировании образуется 1,5 АТР на одну окисленную молекулу FADH2 и 2,5 АТР на одну окисленную молекулу NADH.
** GTP, получающийся непосредственно на этой стадии, дает АТР в реакции, катализируемой нуклеозиддифосфаткиназой (с. 41).
Для окисления ненасыщенных жирных кислот требуются две дополнительные реакции
Описанная выше последовательность окисления жирных кислот свойственна насыщенным кислотам (т. е. имеющим только одинарные связи в углеродной цепи). Однако большинство жирных кислот в триацилглицеринах и фосфолипидах животных и растений ненасыщенны, они содержат одну или несколько двойных связей. Эти связи находятся в цис-конфигурации, и поэтому не могут подвергаться действию еноил-СоА-гидратазы, фермента, катализирующего присоединение Н2О по двойной связи в транс-конфигурации ∆2-еноил-СоА, который образуется в процессе β-окисления. Для β-окисления природных ненасыщенных жирных кислот требуются два дополнительных фермента: изомераза и редуктаза. Проиллюстрируем эти вспомогательные реакции на двух примерах.
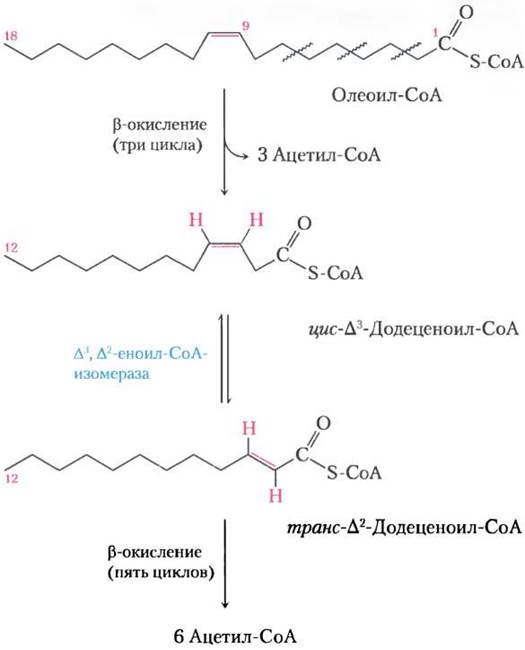
Олеат — распространенная 18-углеродная мононенасыщенная жирная кислота с цис-конфигурацией при двойной связи между С-9 и С-10 (обозначается ∆9). На первой стадии окисления олеат превращается в олеоил-СоА и, как и насыщенные жирные кислоты, с помощью карнитинового переносчика попадает в матрикс митохондрий (рис. 17-6). После этого олеоил-СоА три раза проходит через цикл окисления жирных кислот, образуя три молекулы ацетил-СоА и эфир кофермента А и ∆3,12-углеродной ненасыщенной жирной кислоты, цис-∆3-додеценоил-СоА (рис. 17-9). Этот продукт не может служить субстратом для еноил-СоА-гидратазы, которая действует только на транс-двойные связи. Вспомогательный фермент ∆3, ∆2-еноил-СоА-изомераза делает из цис- ∆3-еноил-СоА изомерный транс-∆2-еноил-СоА, который превращается еноил-СоА-гидратазой в соответствующий L-β-гидроксиацил-СоА (транс- ∆2-додеценоил-СоА). Теперь на этот промежуточный продукт действуют остальные ферменты β-окисления, образуя ацетил-СоА и эфир кофермента А и 10-углеродной насыщенной жирной кислоты, деканоил-СоА. Последний еще четыре раза проходит через этот путь с образованием дополнительных пяти молекул ацетил-СоА. В итоге из одной молекулы 18-углеродного олеата образуется 9 молекул ацетил-СоА.
Рис. 17-9. Окисление мононенасыщенной жирной кислоты. Здесь рассмотрена олеиновая кислота в виде олеоил-СоА (∆9). Для репозиции двойной связи и успешного окисления требуется дополнительный фермент еноил-СоА-изомераза, которая превращает цис-изомер в трансизомер, промежуточный продукт β-окисления.
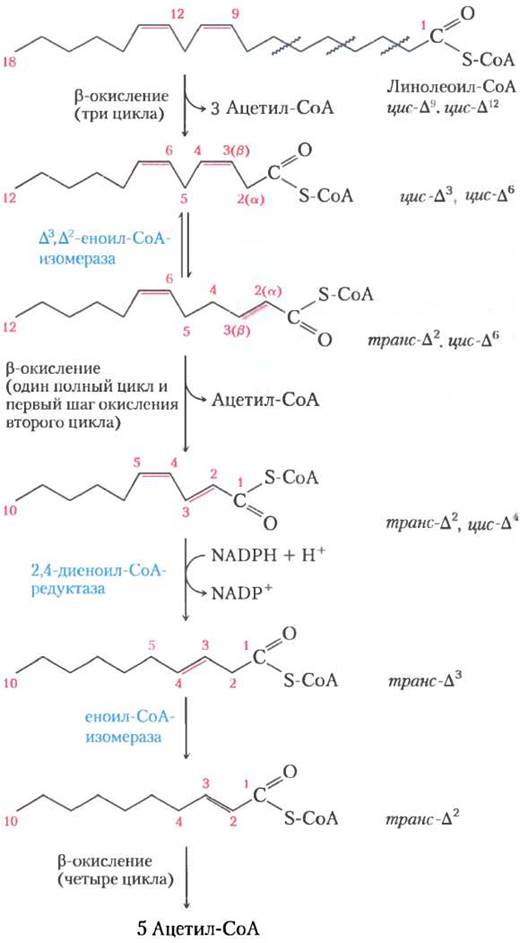
Для окисления полиненасыщенных жирных кислот, например, 18-углеродного линолеата, имеющего конфигурацию цис-∆9, цис-∆12, нужен дополнительный фермент редуктаза (рис. 17-10). Линолеоил-СоА проходит три раза через последовательность β-окисления, образуя три молекулы ацетил-СоА и эфир кофермента А и 12-углеродной ненасыщенной жирной кислоты с конфигурацией цис-∆3, цис-∆6. Этот промежуточный продукт не подвержен действию ферментов β-окисления; его двойные связи находятся не в том положении и имеют не ту конфигурацию (цис-, а не транс-). Однако, как показано на рис. 17-10, совместное действие еноил-СоА-изомеразы и 2,4-диеноил-СоА- редуктазы дает возможность этому интермедиату вновь попасть в цикл β-окисления и при расщеплении дать шесть молекул ацетил-СоА. Общим результатом является превращение линолеата в девять молекул ацетил-СоА.
Рис. 17-10. Окисление полиненасыщенной жирной кислоты. Здесь рассмотрена линолевая кислота в виде линолеоил-СоА (∆9,12). Кроме еноил-СоА-изомеразы для окисления требуется второй фермент NADРН- зависимая 2,4-диеноил-СоА-редуктаза. Благодаря совместному действию этих двух ферментов промежуточное соединение транс-∆2, цис-∆4-диеноил-СоА превращается в субстрат транс-∆2-еноил-СоА, пригодный для β-окисления.
Для полного окисления жирных кислот с нечетным числом атомов углерода требуются три дополнительные реакции
Большинство природных липидов содержат жирные кислоты с нечетным числом атомов углерода; жирные кислоты с четным числом атомов углерода встречаются в липидах многих растений и некоторых морских организмов. У крупного рогатого скота и других жвачных животных в процессе ферментации углеводов в рубце в огромных количествах образуется трехуглеродный пропионат (СН3-СН2-СОО-); он всасывается в кровь и окисляется в печени и других тканях. Пропионат в небольших количествах добавляют в некоторые хлебопродукты в качестве ингибитора образования плесени.
Жирные кислоты с длинной углеродной цепью и нечетным числом атомов углерода окисляются тем же путем, что и кислоты с четным числом, начиная с карбоксильного конца цепи. Однако субстратом для последнего прохождения через цикл β-окисления является ацил-СоА- производное жирной кислоты с пятью атомами углерода. Из этого вещества при окислении образуются ацетил-СоА и пропионил-СоА. Ацетил-СоА, конечно же, можно окислить в цикле трикарбоновых кислот, однако пропионил- СоА поступает в другой цикл, включающий три фермента.
Там пропионил-СоА карбоксилируется с образованием D-стереоизомера метилмалонил- СоА (рис. 17-11) под действием пропионил- СоА-карбоксилазы, содержащей кофактор биотин. Как и в реакции пируваткарбоксилазы (см. рис. 16-16), в этом ферментативном процессе СO2 или ион гидроксикарбоната НСО3- активируется, присоединяясь к биотину еще до того, как попасть на субстрат (в данном случае пропионатный остаток). Для образования промежуточного соединения карбоксибиотина требуется энергия, которая поступает от распада АТР до ADP и Pi. Образованный таким образом D-метилмалонил-СоА ферментативно эпимеризуется метилмалонил-СоА-эпимеразой в L-стереоизомер (рис. 17-11). После этого L-метилмалонил-СоА подвергается внутримолекулярной перегруппировке с образованием сукцинил-СоА, который теперь может поступить в цикл трикарбоновых кислот. Эта перегруппировка катализируется метилмалонил-СоА-мутазой, которой в качестве кофермента требуется 5'-дезоксиаденозилкобаламин, или кофермент В12, получаемый из витамина В12 (кобаламина). В доп. 17-2 объясняется роль кофермента В12 в этой поразительной реакции обмена.
Рис. 17-11. Окисление пропионил-СоА, полученного в цикле β-окисления жирных кислот с нечетным числом атомов углерода. Последовательность реакций включает карбоксилирование пропионил-СоА до D-метилмалонил-СоА и превращение последнего в сукцинил-СоА. Для этого превращения требуется эпимеризация D- в L-метилмалонил-СоА с последующей замечательной реакцией, в которой заместители при соседних атомах углерода меняются своими местами (см. доп. 17-2).
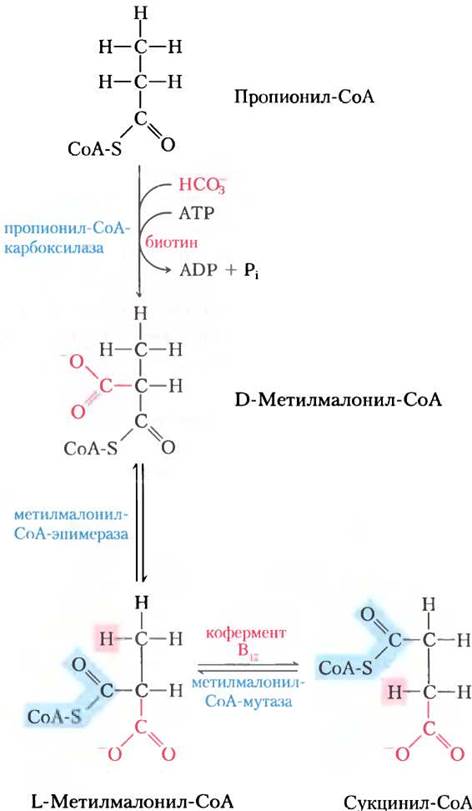
Дополнение 17-2. Кофермент В12: «радикальное» решение сложной задачи
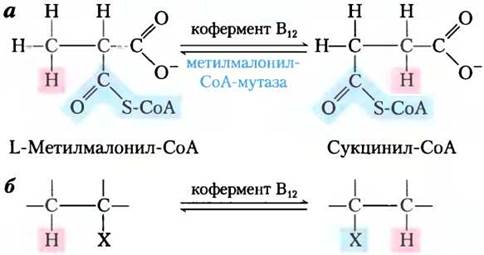
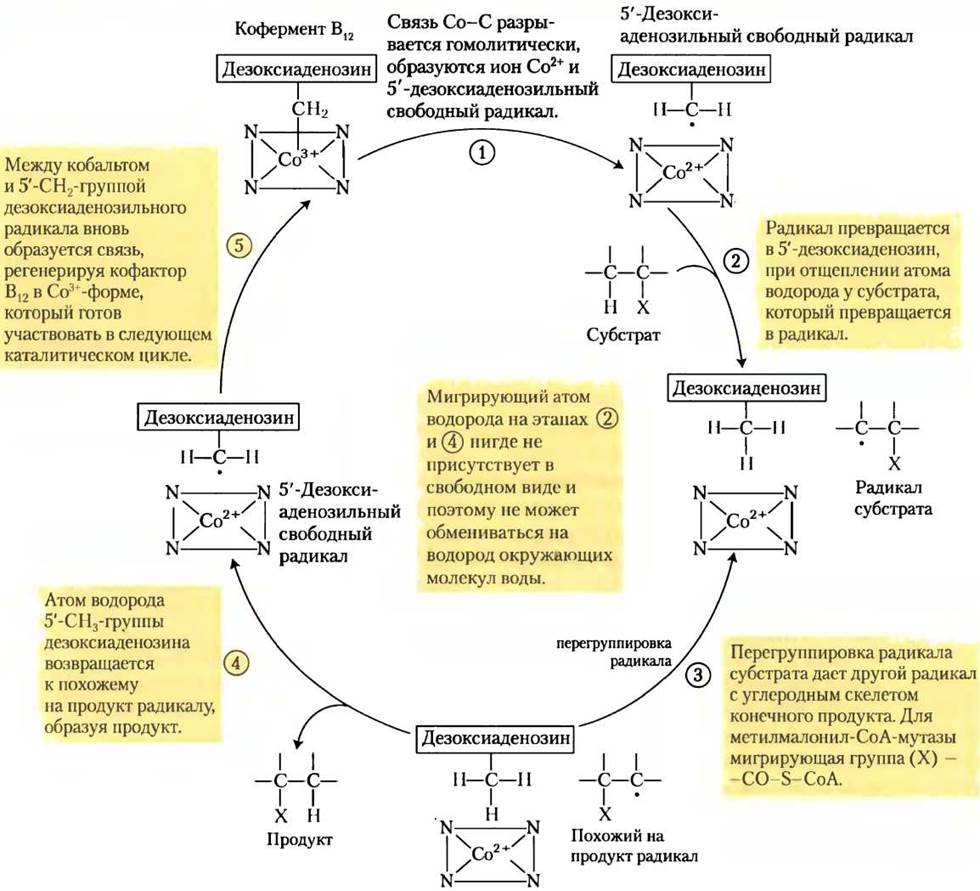
В реакции метилмалонил-СоА-мутазы (см. рис. 17-11) группа -CO-S-CoA в положении С-2 исходного пропионата обменивается на атом водорода в положении С-3 (рис. 1, а). Кофермент В12 выступает кофактором, как и практически для всех ферментов, которые катализируют реакции главным образом этого типа (рис. 1, б). Такие кофермент В12-зависимые процессы относятся к очень редким в биологии ферментативным реакциям, где происходит обмен между алкильной или замещенной алкильной группы (X) и атомом водорода при соседнем углероде, причем в этом обмене никогда не участвует водород растворителя Н2O. Как же атом водорода способен передвигаться между двумя атомами углерода, не смешиваясь с водородом растворителя, присутствующего в огромном избытке?
Рис. 1.
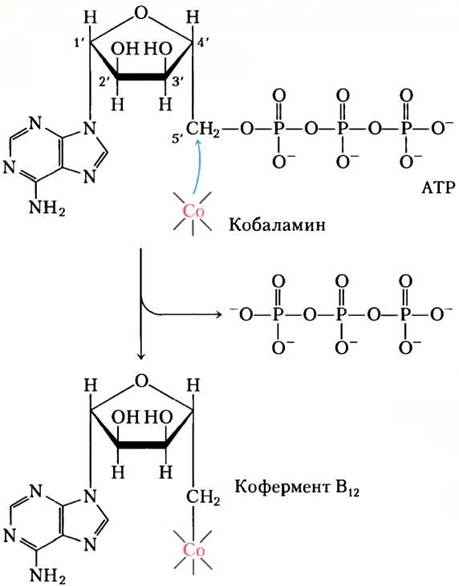
Кофермент В12 — кофакторная форма витамина В12; среди всех других витаминов он уникален тем, что включает в свой состав не только сложную органическую молекулу, но и микроэлемент кобальт Со. Сложная корриновая кольцевая система витамина В12 (на рис. 2 окрашена синим), в которой координирован кобальт (Со3+), родственна порфириновой кольцевой системе гема и гемсодержащих белков (см. рис. 5-1). В координационной сфере кобальта пятым лигандом является диметилбензимидазолрибонуклеотид (выделен желтым), ковалентно связанный своей 3'- фосфатной группой с боковой цепью корринового кольца через аминоизопропанол. Образование такого сложного кофактора известно всего лишь для двух реакций, где от АТР отщепляется трифосфат (рис. 3); другая реакция — образование S-аденозилметионина из АТР и метионина (см. рис. 18-18).
Рис. 2.
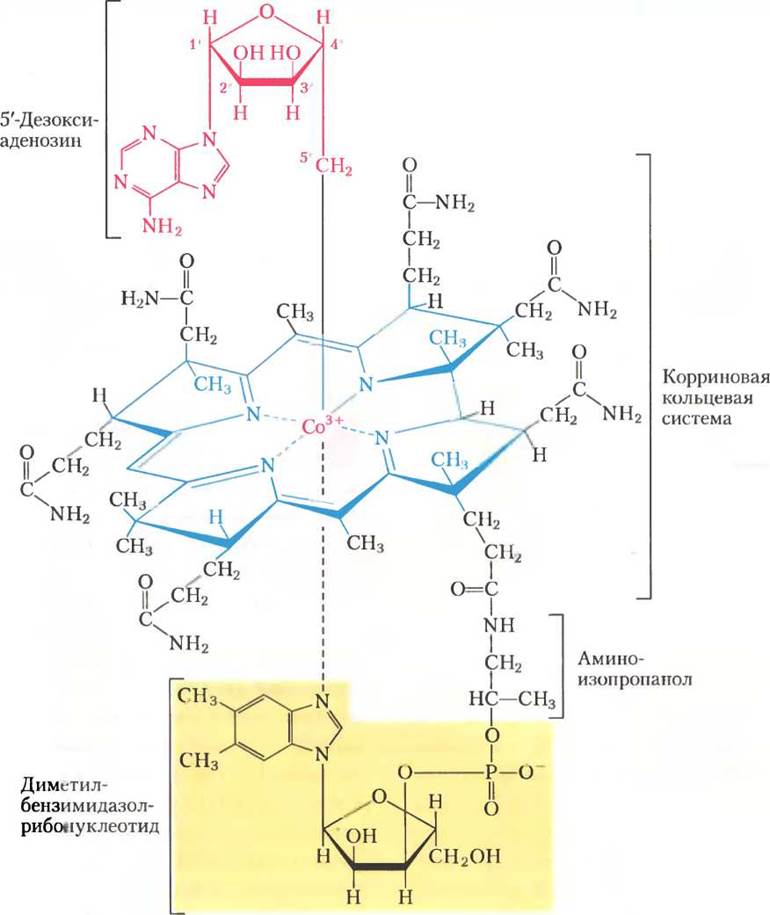
Витамин В12, как правило, называют цианокобаламином; он содержит цианогруппу, которая присоединена к кобальту как шестой лиганд в координационной сфере. В 5'-дезоксиаденозилкобаламине, кофакторе метилмалонил-СоА-мутазы, цианогруппа замещена на 5'-дезоксиаденозильную группу (на рис. 2 красная), которая ковалентно связана с кобальтом через атом С-5'. Трехмерная структура кофактора впервые была определена Дороти Кроуфут Ходжкин в 1956 г. по данным рентгеноструктурного анализа.
Дороти Кроуфут Ходжкин, 1910-1994

Ключ к пониманию того, как кофермент В12 катализирует обмен заместителями (алкил-водород), находится в свойствах ковалентной связи между кобальтом и атомом С-5' дезоксиаденозильной группы (рис. 2). Эта связь довольно слабая; энергия ее диссоциации составляет около 110 кДж/моль по сравнению с 348 кДж/моль для одинарной связи С-С или 414 кДж/моль для связи С-Н. Чтобы разорвать связь Со-С, достаточно просто подвергнуть соединение действию видимого света. (Такая чрезвычайная фотолабильность объясняет отсутствие витамина В12 в растениях.) При диссоциации получается 5'-дезоксиаденозильный радикал и Со2+-форма витамина. Химическая функция 5'-дезоксиаденозилкобаламина заключается в образовании свободных радикалов и инициации таким образом множества превращений, например, представленного на рис. 4 механизма реакции, катализируемой метилмалонил-СоА-мутазой, и ряда других кофермент В12-зависимых превращений. В предложенном механизме мигрирующий атом водорода нигде не присутствует в свободном виде и поэтому никогда не способен вступить в обмен с водородом окружающих молекул воды.
Рис. 3.
Недостаток витамина В12 приводит к серьезному заболеванию. Этот витамин не образуется ни у растений, ни у животных, он синтезируется всего несколькими видами микроорганизмов. Здоровым людям он необходим лишь в малых количествах, около 3 мкг/сут. Из-за неспособности эффективно всасывать витамин В12 из кишечника, где он синтезируется кишечной микрофлорой или образуется при переваривании мяса, возникает редкое заболевание злокачественная анемия. У человека с этим заболеванием не образуется в достаточном количестве внутренний фактор — гликопротеин, необходимый для всасывания витамина В12. При злокачественной анемии в анализе крови эритроциты ниже нормы, низкий уровень гемоглобина; наблюдаются также симптомы прогрессирующего повреждения центральной нервной системы; в некоторых случаях введение больших доз витамина В12 смягчает эти симптомы. ■
Рис. 4. Механизм реакции.
Окисление жирных кислот строго регулируется
При окислении жирных кислот расходуется драгоценный для организма источник энергии, и поэтому его регуляция устроена так, что процесс происходит только в случае недостатка энергии. В печени у ацил-СоА-производного жирной кислоты, образованного в цитозоле, есть два возможных пути: (1) β-окисление ферментами в митохондриях или (2) превращение в триацилглицерины и фосфолипиды ферментами цитозоля. Выбор пути зависит от скорости транспорта в митохондрии длинного
«хвоста» ацил-СоА-производного жирной кислоты. Трехстадийный процесс (карнитиновый перенос), с помощью которого ацильные группы ацил- СоА-производного переносятся из цитозоля в митохондриальный матрикс (рис. 17-6), является стадией, лимитирующей скорость окисления жирных кислот и важным местом регуляции. Как только ацильные группы жирной кислоты попадают в митохондрии, они окисляются до ацетил-СоА.
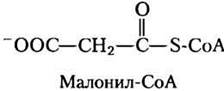
Концентрация малонил-СоА, первого промежуточного соединения в биосинтезе длинноцепочечных жирных кислот из ацетил-СоА в цитозоле (см. рис. 21-1), увеличивается всякий раз, когда животное получает много углеводов; избыток глюкозы, которую организм не может окислить или сохранить в виде гликогена, превращается в цитозоле в жирные кислоты для хранения в виде триацилглицеринов. Ингибированием карнитинацилтрансферазы I малонил-СоА обеспечивает подавление окисления жирных кислот каждый раз, когда в печень поступает слишком много глюкозы — из ее избытка активно синтезируются триацилглицерины.
Два фермента β-окисления тоже регулируются метаболитами, передающими сигнал о том, что количество энергии достаточно. Если соотношение [NАDН]/(NAD+] велико, β-гидроксиацил- СоА-дегидрогеназа ингибируется; кроме того, высокие концентрации ацетил-СоА ингибируют тиолазу (рис. 17-12).
Вспомните, в гл. 15 мы говорили о том, что при большой мышечной нагрузке или при голоде падение концентрации АТР и повышение концентрации АМР активируют АМР-зависимую протеинкиназу (АМРК). АМРК фосфорилирует несколько ферментов-мишеней, включая ацетил- СоА-карбоксилазу, катализирующую синтез малонил-СоА. Ингибирование ацетил-СоА- карбоксилазы, вызванное фосфорилированием, приводит к снижению концентрации малонил- СоА, что в свою очередь снимает ингибирование транспорта ацилкарнитина в митохондрии (рис. 17-12) и способствует окислительным процессам, восполняющим запасы АТР.
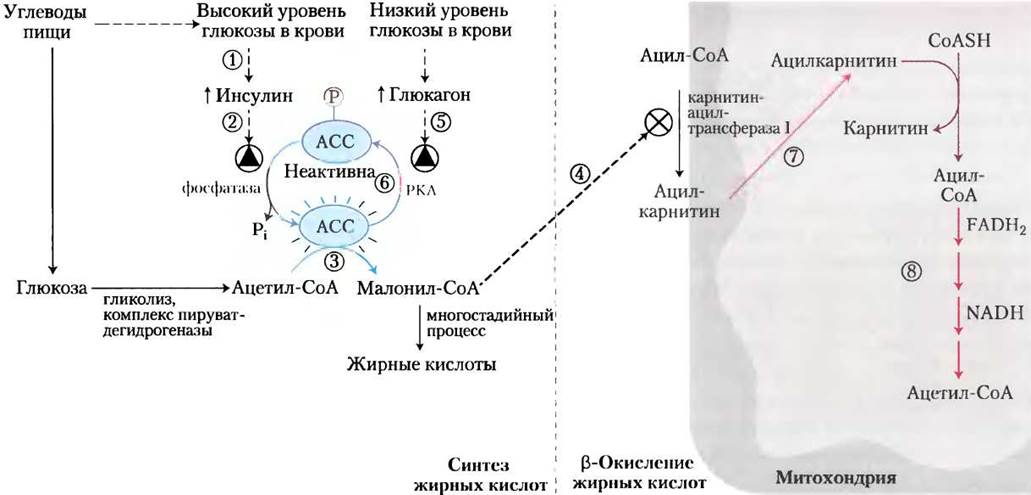
Рис. 17-12. Координированная регуляция синтеза и распада жирных кислот. Если в рационе питания в качестве источника энергии присутствуют углеводы, β-окисление жирных кислот уже не требуется и поэтому тормозится. Ключевую роль в координации метаболизма жирных кислот играют два фермента: ацетил-СоА-карбоксилаза (АСС), первый фермент в синтезе жирных кислот (см. рис. 21-1), и карнитинацилтрансфераза I, которая при β-окислении ограничивает транспорт жирных кислот в митохондриальный матрикс (см. рис. 17-6). Потребление пищи с высоким содержанием углеводов повышает уровень глюкозы крови и поэтому (1) инициирует выделение инсулина. (2) Инсулин-зависимый белок фосфатаза дефосфорилирует АСС, активируя ее. (3) АСС катализирует образование малонил-СоА (первое промежуточное соединение в синтезе жирных кислот), а (4) малонил-СоА ингибирует карнитинацилтрансферазу I, препятствуя, таким образом, попаданию жирных кислот в митохондриальный матрикс. Когда между приемами пищи уровень глюкозы крови падает, (5) выделение глюкагона активирует сАМР-зависимую протеинкиназу (РКА), которая (6) фосфорилирует и инактивирует АСС. Концентрация малонил-СоА падает, ингибирование поступления жирных кислот в митохондрию ослабляется, (7) они попадают в митохондриальный матрикс и (8) становятся основным источником энергии. Поскольку глюкагон ко всему прочему инициирует активацию жирных кислот в жировой ткани, их запасы начинают поступать в кровь.
Синтезу белков, необходимых для катаболизма липидов, способствуют факторы транскрипции
Кроме различных короткодействующих регуляторных механизмов, модулирующих активность уже имеющихся ферментов, существует регуляция транскрипции, изменяющая количество молекул ферментов, участвующих в окислении жирных кислот; причем в данном случае речь идет о более протяженных временных интервалах — от нескольких минут до нескольких часов. Семейство ядерных рецепторов PPAR представлено факторами транскрипции, участвующими во многих метаболических процессах и реагирующими на сигналы лигандов, таких как жирные кислоты. Ранее эти ядерные рецепторы получили название рецепторов, активированных пролифераторами пероксисомы (peroxisome proliferator-activated receptors, PPAR), однако позднее выяснилось, что их действие гораздо шире. В мышцах, жировой ткани и печени PPARa приводят в действие гены ферментов, необходимых для окисления жирных кислот, в том числе гены транспортеров жирных кислот — карнитинацилтрансфераз I и II, ацил- СоА-дегидрогеназы жирных кислот с короткой, средней, длинной и очень длинной цепью, а также гены других родственных ферментов. Такой клеточный ответ возникает, когда организму или клетке необходимо большое количество энергии, получаемой от катаболизма жиров, например, в промежутке между приемами пищи или при длительном голодании. Высвобождающийся при низком содержании глюкозы в крови глюкагон, действуя через сАМР и фактор транскрипции CREB, также включает некоторые гены, связанные с катаболизмом липидов.
Серьезные изменения экспрессии генов ферментов, связанных с окислением жирных кислот, происходят также в сердце при переходе от метаболизма зародыша к метаболизму новорожденного. Основными топливными молекулами в сердце зародыша являются глюкоза и лактат, однако у новорожденного как источник топлива используются жирные кислоты. Во время этого перехода происходит активация рецепторов PPARa, которые в свою очередь активируют гены ферментов, необходимых для метаболизма жирных кислот. Как мы увидим в гл. 23, два других члена семейства факторов транскрипции PPAR тоже играют важную роль в образовании ферментов и, следовательно, в метаболической активности специфических тканей в определенные моменты времени (см. рис. 23-42).
В основном окисление жирных кислот в организме происходит в скелетных мышцах — как в состоянии покоя, так и при физической нагрузке. При постоянных тренировках повышается уровень экспрессии PPARa в мышцах, что ведет к увеличению содержания ферментов, окисляющих жирные кислоты, и повышению окислительной способности мышц.
Генетические нарушения в ацил-СоА-дегидрогеназах — причина серьезных заболеваний
Запасные триацилглицерины обычно являются основным источником энергии для сокращения мышц, и неспособность окислять жирные кислоты из триацилглицеринов имеет серьезные последствия для здоровья. Самое распространенное генетическое нарушение в катаболизме жирных кислот у населения США и Северной Европы обусловлено мутацией в гене, кодирующем ацил-СоА-дегидрогеназу средней цепи (MCAD). Среди северных европейцев носителем такой рецессивной мутации в одной из двух гомологичных хромосом оказывается примерно один человек из 40, а один из 10 000 болеет, т. е. имеет две копии мутантного аллеля MCAD и неспособен окислять жирные кислоты, несущие от 6 до 12 атомов углерода. Для этой болезни характерны периодические проявления: накопление жиров в печени, высокое содержание каприловой кислоты в крови, низкий уровень глюкозы крови (гипогликемия), сонливость, рвота, что может привести к коме. Распределение органических кислот в моче помогает в диагностике этой болезни: как правило, наблюдается высокое содержание дикарбоновых кислот, имеющих от 6 до 10 атомов углерода (образующихся в процессе ω-окисления), и низкий уровень кетоновых тел в моче (ω-окисление рассмотрено ниже, а кетоновые тела — в разд. 17-3). Между отдельными проявлениями болезни может и не быть симптомов, хотя при возникновении эпизодов болезни они очень опасны; в период раннего детства смертность от этой болезни составляет 25-60%. Если генетический дефект обнаружить сразу после рождения, младенцу можно назначить высокоуглеводную диету с низким содержанием жиров. При раннем обнаружении и выполнении тщательно спланированной диеты, включая избегания длительных интервалов между приемами пищи, чтобы не дать телу обратиться к своим собственным запасам жиров ради получения энергии, прогноз для таких пациентов благоприятный.
У человека зафиксировано более 20 других генетических нарушений в транспорте и окислении жирных кислот, которые гораздо менее распространены, чем дефект в MCAD. Причиной одного из наиболее тяжелых нарушений является утрата длинноцепочечной β-гидроксиацил- СоА-дегидрогеназной активности трехфункционального белка (TFP). К другим нарушениям относятся дефекты в α- или β-субъединицах TFP, которые оказывают влияние на все три активности TFP и вызывают тяжелые болезни сердца и аномалии скелетных мышц. ■
Пероксисомы тоже участвуют в β-окислении
Основным местом окисления жирных кислот в клетках животных служит митохондриальный матрикс, однако у некоторых клеток в других компартментах также содержатся ферменты, способные окислять жирные кислоты до ацетил-СоА по пути, который подобен, но не совсем идентичен митохондриальному. В клетках растений β-окисление в основном происходит не в митохондриях, а в пероксисомах.
В пероксисомах, заключенных в мембрану органеллах животных и растительных клеток, в роли промежуточных соединений β-окисления жирных кислот выступают производные кофермента А, а сам процесс состоит из четырех стадий, как и в митохондриальном β-окислении (рис. 17-13): (1) дегидрирование, (2) присоединение воды к образующейся двойной связи, (3) окисление p-гидроксиацил-СоА до кетона и (4) его тиолитический разрыв коферментом А. (Как увидим в дальнейшем, аналогичные реакции происходят и в глиоксисомах.)
Одно из различий между пероксисомальным и митохондриальным путями заключается в химии первого шага. В пероксисомах флавопротеин ацил-СоА-оксидаза, генерирующая двойную связь, передает электроны непосредственно на O2, образуя Н2O2 (рис. 17-13). Этот сильный и потенциально разрушительный окислитель тут же распадается на Н2O и O2 под действием каталазы. Напомним, что в митохондриях электроны, взятые на первом шаге окисления, попадают на O2 через дыхательную цепь, образуя Н2O, и этот процесс сопровождается синтезом АТР. В пероксисомах энергия, выделяющаяся на первом шаге окислительного распада жирных кислот, не сохраняется в виде АТР, а выделяется в виде теплоты.
Рис. 17-13. Сравнение β-окисления в митохондриях и в пероксисомах и глиоксисомах. Пероксисомальная/глиоксисомалъная система отличается от митохондриальной в двух отношениях: (1) на первом шаге окисления электроны попадают непосредственно на O2, образуя Н2O2 и (2) NADH, образованный на втором шаге окисления, не может быть вновь окислен в пероксисоме и глиоксисоме, поэтому восстановительные эквиваленты выводятся в цитозоль, вновь проникая со временем в митохондрии. Ацетил-СоА, образующийся в пероксисомах и глиоксисомах, тоже выводится; ацетат из глиоксисом (органелл, обнаруженных только в прорастающих семенах) служит биосинтетическим предшественником (см. рис. 17-14). Ацетил-СоА, образующийся в митохондриях, в дальнейшем окисляется в цикле трикарбоновых кислот.
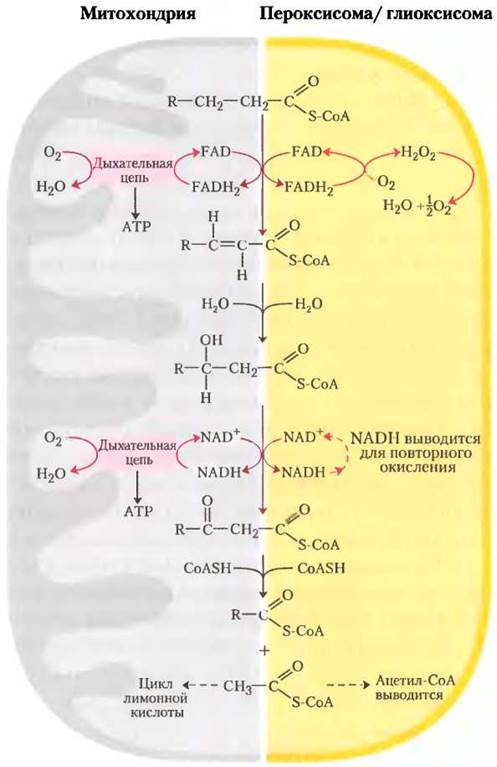
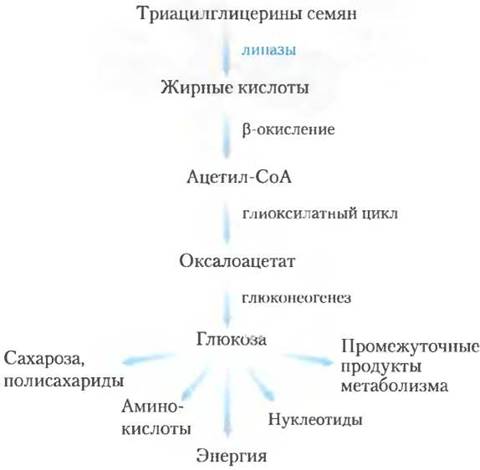
Рис. 17-14. Триацилглицерины в качестве источника глюкозы в семенах. У прорастающих семян β-окисление — одна из стадий превращения запасенных триацилглицеринов в глюкозу. Подробнее см. на рис. 16-22.
Второе важное различие между митохондриальным и пероксисомальным β-окислением у млекопитающих состоит в специфичности к ацил-СоА-производным жирных кислот; пероксисомальная система намного более активна в отношении жирных кислот с очень длинными цепями, например, таким, как церотиновая кислота (26:0), и с разветвленными цепями, таким как фитановая и пристановая кислоты (см. рис. 17-17). Эти малораспространенные жирные кислоты содержатся в молочных продуктах, жирах жвачных животных, мясе и рыбе. В их катаболизме участвует несколько вспомогательных ферментов в пероксисомах, которые уникальны для этих органелл. У человека неспособность окислять эти соединения вызывает некоторые тяжелые болезни. Больной с синдромом Цельвегера лишен биогенеза пероксисом, и в связи с этим у него организм испытывает недостаток во всем том метаболизме, который уникален для этих органелл. При сцепленной с Х-хромосомой адренолейко дистрофии(XALD, от англ. X-linked adrenoleukodystrophy) пероксисомы не могут окислять жирные кислоты с очень длинными цепями, по-видимому, из-за нехватки в пероксисомальной мембране функциональных переносчиков этих жирных кислот. Оба нарушения приводят к накоплению в крови жирных кислот с очень длинными цепями, особенно 26:0. ХАLD проявляется у мальчиков в возрасте до 10 лет, вызывая потерю зрения, поведенческие нарушения и смерть в течение нескольких лет. ■
У млекопитающих высокие концентрации жиров в рационе питания приводят к усиленному синтезу в печени ферментов пероксисомального β-окисления. Пероксисомы печени не содержат ферментов цикла трикарбоновых кислот и поэтому не могут катализировать окисление ацетил- СоА до СO2. Вместо этого длинноцепочечные или разветвленные жирные кислоты в процессе катаболизма превращаются в короткоцепочечные продукты, например, в гексаноил-СоА, которые экспортируются в митохондрии и полностью окисляются там.
Пероксисомы и глиоксисомы растений используют ацетил-СоА, полученный при β-окислении, как предшественник в биосинтезе
У растений окисление жирных кислот происходит в основном не в митохондриях, а в пероксисомах тканей листа и в глиоксисомах прорастающих семян. Пероксисомы и глиоксисомы растений схожи по своей структуре и функциям; глиоксисомы, встречающиеся только в прорастающих семенах, можно считать специализированными пероксисомами. Биологическая роль |3-окисления в этих органеллах заключается в использовании запасенных липидов преимущественно для предоставления биосинтетических предшественников, а не энергии.
В период роста семян, запасенные триацилглицерины превращаются в глюкозу, сахарозу и целый ряд важнейших метаболитов (рис. 17-14). Жирные кислоты, высвобождаемые из триацилглицеринов, вначале активируются, превращаясь в производные кофермента А, и окисляются в глиоксисомах в ходе точно такого же четырехстадийного процесса, как и в пероксисомах (рис. 17-13). Образующийся ацетил-СоА превращается в глиоксилатном цикле (см. рис. 16-20) в четырехуглеродные предшественники для глюконеогенеза (рис. 14-19). Глиоксисомы, как и пероксисомы, содержат в высокой концентрации каталазу, которая превращает образующийся в процессе β-окисления Н2O2 в Н2O и O2.
Ферменты β-окисления из разных органелл в ходе эволюции приобрели отличия
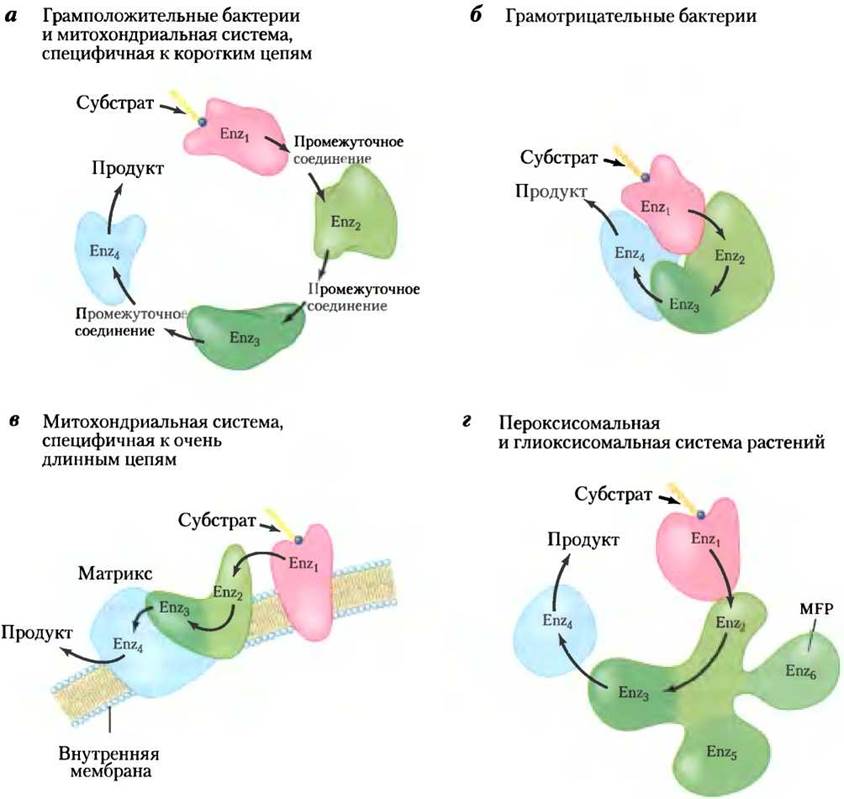
Хотя реакции β-окисления в митохондриях по существу те же, что и в пероксисомах и глиоксисомах, ферменты (изоферменты) в этих органеллах имеют значительные различия, что, по-видимому, возникло как результат эволюционной дивергенции на ранних этапах вместе с разделением грамположительных и грамотрицательных бактерий (см. рис. 1-6).
В митохондриях четыре фермента β-окисления, действующие на ацил-СоА-производные короткоцепочечных жирных кислот, — это самостоятельные растворимые белки (как уже отмечалось ранее), сходные по структуре с аналогичными ферментами грамположительных бактерий (рис. 17-15, а). Грамотрицательные бактерии обладают четырьмя активностями в трех растворимых субъединицах (рис. 17-15, б), а ферментативная система эукариот, трехфункциональный белок ТFР, действующий на длинноцепочечные жирные кислоты, обладает тремя ферментативными активностями в двух мембраносвязанных субъединицах (рис. 17-15, в). Однако ферменты β-окисления пероксисом и глиоксисом растений формируют комплекс из белков, один из которых в одной полипептидной цепи несет сразу четыре ферментативные активности (рис. 17-15, г). Первый фермент, ацил-СоА-оксидаза, состоит из одной полипептидной цепи; мультифункциональный белок (MFP, от англ. multifunctional
protein) обладает второй и третьей ферментативными активностями (еноил-СоА-гидратазы и гидроксиацил-СоА-дегидрогеназы), а также двумя дополнительными активностями, необходимыми для окисления ненасыщенных жирных кислот (D-3-гидроксиацил-СоА-эпимеразы и ∆3,∆2-еноил-СоА-изомеразы); четвертый фермент, тиолаза, является самостоятельным растворимым полипептидом.
Рис. 17-15. Ферменты β-окисления. Показано различное строение субъединиц ферментов β-окисления в грамположителъных и грамотрицателъных бактериях, митохондриях, пероксисомах и глиоксисомах растений. Еnz1 — ацил-СоА-дегидрогеназа; Еnz2 — еноил- СоА-гидратаза; Еnz3 — L-β-гидроксиацил-СоА-дегидрогеназа; Еnz4 — тиолаза; Еnz5 — D-3- гидроксиацил-СоА-эпимераза, а Еnz6 — ∆3,∆2-еноил-СоА-изомераза. а — четыре фермента β-окисления грамположителъных бактерий, как и митохондриальной системы, специфичной к коротким цепям, — самостоятельные растворимые единицы, б — у грамотрицателъных бактерий четыре ферментативные активности свойственны трем полипептидам; ферменты 2 и 3 являются частью одной полипептидной цепи, в — митохондриальная система, специфичная к очень длинным цепям, тоже состоит из трех полипептидов, один из которых включает активность ферментов 2 и 3; в данном случае система связана с внутренней митохондриальной мембраной, г — в пероксисомальной и глиоксисомальной системах β-окисления растений ферменты 1 и 4 — это самостоятельные полипептиды, однако ферменты 2 и 3, а также два вспомогательных фермента входят в состав одной полипептидной цепи мультифункционального белка МFР.
Интересно, что ферменты, в синтезе жирных кислот катализирующие процесс, обратный β-окислению, тоже по-разному организованы у прокариот и эукариот; у бактерий семь ферментов, необходимых для синтеза жирных кислот, — самостоятельные полипептиды, а у млекопитающих все семь ферментативных активностей свойственны одной очень большой полипептидной цепи. Одно из преимуществ клеток, в которых несколько ферментов одного и того же пути кодируются в одну полипептидную цепь, состоит в том, что это решает проблему регуляции синтеза ферментов, позволяя им взаимодействовать функционально; регуляция экспрессии одного гена обеспечивает образование одинакового числа активных центров всех ферментов этого пути. Если каждая ферментативная активность относится к отдельному полипептиду, нужен некий механизм, координирующий синтез всех генных продуктов. Недостатком обладания несколькими ферментативными активностями у одного полипептида является то, что чем длиннее его полипептидная цепь, тем больше вероятность ошибки в ее синтезе: одна неверная аминокислота в цепи может сделать непригодной ферментативную активность всей цепи. Сравнение структур генов этих белков у нескольких видов может пролить свет на причины выбора той или иной стратегии в эволюции.
ω-Окисление жирных кислот происходит в эндоплазматическом ретикулуме
Хотя митохондриальное β-окисление, в котором ферменты действуют на карбоксильном конце жирной кислоты, и является важнейшим путем катаболиза жирных кислот в клетках животных, у некоторых видов, включая позвоночных, есть другой путь, приводящий к окислению ω (омега) углерода — атома углерода, который наиболее удален от карбоксильной группы. Свойственные ω-окислению ферменты находятся (у позвоночных) в эндоплазматическом ретикулуме печени и почек, а в качестве субстратов предпочтение отдается жирным кислотам с 10-12 атомами углерода. У млекопитающих ω-окисление — это обычно второстепенный путь распада жирных кислот, однако в случае нарушения β-окисления (например, из-за мутации или из-за нехватки карнитина) оно приобретает намного большее значение.
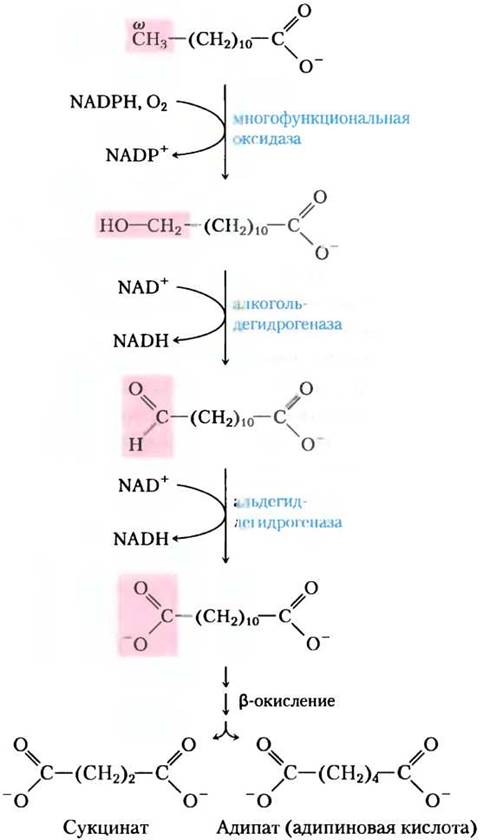
На первой стадии гидроксильная группа присоединяется к ω-углероду (рис. 17-16). Кислород для этой группы приходит от молекулярного кислорода в результате сложной реакции, включающей цитохром Р450 и донор электронов NADPH. Реакции такого типа катализируют многофункциональные оксидазы, которые описаны в доп. 21-1. После этого на ω-углерод действуют еще два фермента: алкогольдегидрогеназа окисляет гидроксильную группу до альдегида, а альдегидцегидрогеназа окисляет альдегидную группу до карбоновой кислоты, образуя жирную кислоту с карбоксильными группами на каждом конце. На этом этапе любой из концов можно присоединить к коферменту А так, чтобы молекула смогла попасть в митохондрию и подвергнуться β-окислению привычным способом. При каждом прохождении по маршруту β-окисления жирные кислоты с «двойными концами» образуют дикарбоновые кислоты, например, янтарную кислоту, которая поступает в цикл трикарбоновых кислот, и адипиновую кислоту (рис. 17-16).
Рис. 17-16. ω-Окисление жирных кислот в эндоплазматическом ретикулуме. Эта альтернатива β-окислению начинается с окисления атома углерода, наиболее удаленного от α-углерода, — ω (омега) углерода. Субстратом обычно выступает жирная кислота со средней длиной цепи; здесь приведена лауриновая кислота (лаурат). Как правило, этот путь не основной при окислительном катаболизме жирных кислот.
Фитановая кислота подвергается α-окислению в пероксисомах
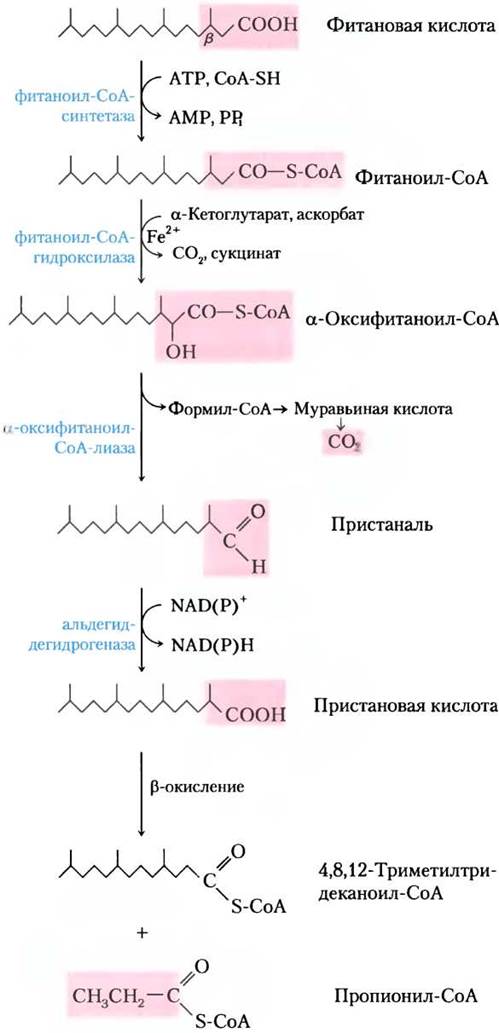
Наличие метильной группы у β-углерода жирной кислоты делает β-окисление невозможным, поэтому катаболизм таких разветвленных жирных кислот происходит в пероксисомах клеток животных путем α-окисления. При окислении, например, фитановой кислоты (рис. 17-17) фитаноил-СоА гидроксилируется по α-углероду в реакции, включающей молекулярный кислород; декарбоксилируется с образованием альдегида, который на один атом углерода короче; а затем окисляется до соответствующей карбоновой кислоты, у которой теперь уже нет заместителя на β-углероде и которую в дальнейшем можно окислить в процессе β-окисления. Болезнь Рефсума, возникающая из-за генетического дефекта в фитаноил-СоА- гидроксилазе, приводит к очень высокому содержанию фитановой кислоты в крови и серьезным неврологическим проблемам, включая слепоту и глухоту. ■
Рис. 17-17. α-Окисление жирной кислоты с разветвленной цепью (фитановой кислоты) в пероксисомах. Фитановая кислота содержит β-углерод с метильным заместителем и поэтому не может подвергаться β-окислению. Совместное действие изображенных здесь ферментов удаляет карбоксильный углерод фитановой кислоты с образованием пристановой кислоты, у которой при β-углероде нет заместителя, что делает возможным β-окисление. Обратите внимание, что при β-окислении пристановой кислоты образуется пропионил-СоА, а не ацетил-СоА. Дальнейший его катаболизм происходит в соответствии с рис. 17-11. (Детали реакции с образованием пристаналя остаются спорными.)
Краткое содержание раздела 17.2 Окисление жирных кислот
■ На первой стадии р-окисления с карбоксильного конца ацил-СоА-производного насыщенной жирной кислоты каждый раз удаляется молекула ацетил-СоА в ходе четырех реакций: (1) дегидрирование α- и β-углеродов (С-2 и С-3) связанными с FAD ацил-СоА-дегидрогеназами, (2) гидратация образовавшейся транс-А2 двойной связи еноил-СоА-гидратазой, (3) дегидрирование получившегося L-β-оксиацил-СоА связанной с NAD β-оксиацил-СоА-дегидрогеназой и (4) разрыв образовавшегося β-кетоацил- СоА тиолазой при участии СоА с образованием ацетил-СоА и ацил-СоА-производного жирной кислоты, укороченного на два атома углерода. Затем укороченное ацил-СоА- производное вновь проходит через эту последовательность реакций.
■ На второй стадии окисления жирных кислот ацетил-СоА окисляется до СO2 в цикле трикарбоновых кислот. Теоретически рассчитанная свободная энергия окисления жирных кислот в основном превращается в АТР в процессе окислительного фосфорилирования — финальной стадии окислительного пути.
■ Малонил-СоА, одно из первых промежуточных соединений синтеза жирных кислот, ингибирует карнитинацилтрансферазу I, препятствуя попаданию жирных кислот в митохондрии. Это блокирует распад жирных кислот, пока идет их синтез.
■ Генетические дефекты в ацил-СоА-дегид- рогеназе средней цепи приводят к серьезному заболеванию человека, наравне с мутациями в остальных компонентах системы β-окисления.
■Для окисления ненасыщенных жирных кислот необходимы два дополнительных фермента: еноил-СоА-изомераза и 2,4-ди- еноил-СоА-редуктаза. Жирные кислоты с нечетным числом атомов углерода подвергаются β-окислению с образованием ацетил-СоА и пропионил-СоА. Последний карбоксилируется до метилмалонил-СоА, который изомеризуется до сукцинил-СоА в реакции, катализируемой метилмалонил- СоА-мутазой, ферментом, нуждающимся в коферменте В12.
■ β-Окисление в пероксисомах растений и животных, и глиоксисомах растений состоит из тех же четырех стадий, что и на митохондриальном пути у животных. Однако на первом шаге окисления электроны переносятся непосредственно на O2, образуя Н2O2. Пероксисомы тканей животных специализируются на окислении жирных кислот с очень длинными цепями и разветвленных жирных кислот. В глиоксисомах прорастающих семян β-окисление — одна из стадий превращения запасенных липидов во множество промежуточных соединений и продуктов.
■ В реакциях ω-окисления, которые происходят в эндоплазматическом ретикулуме, образуются как промежуточные соединения дикарбоновые производные жирных кислот, которые подвергаются β-окислению с любого конца, образуя короткие дикарбоновые кислоты, например сукцинат.