ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 2. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ - 2014
ЧАСТЬ II. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ
Я выбрал исследование синтеза мочевины в печени, потому что это казалось мне относительно простой проблемой.
Ханс Кребс, статья из «Perspectives in Biology and Medicine», 1970
18. ОКИСЛИТЕЛЬНОЕ РАСЩЕПЛЕНИЕ АМИНОКИСЛОТ И ОБРАЗОВАНИЕ МОЧЕВИНЫ
Теперь рассмотрим аминокислоты — последний класс биомолекул, при окислительном расщеплении которых организмы способны получать значительное количество энергии. Энергетический вклад аминокислот, входящих в состав белков пищи или белков тканей организма, сильно различается в зависимости от типа и условий метаболизма. Хищники могут получать (сразу после поступления пищи) до 90% необходимой энергии путем окисления аминокислот, в то время как травоядные используют только небольшое количество энергии, полученной таким способом. Большинство микроорганизмов могут усваивать из питательной среды даже примеси аминокислот и использовать их в качестве топлива при определенных условиях питания. Растения же лишь очень редко окисляют аминокислоты для получения энергии; их главный источник энергии — углеводы, которые образуются из СO2 и Н2O при фотосинтезе. Концентрация аминокислот в растительных тканях тонко регулируется для обеспечения нужного соотношения скоростей процессов биосинтеза белков, нуклеиновых кислот и других молекул, необходимых для поддержания роста. Таким образом, катаболизм аминокислот происходит в растениях, но с целью образования метаболитов для других биосинтетических путей.
В животных клетках аминокислоты подвергаются окислительному расщеплению в трех случаях:
1. В процессе обычного синтеза и деградации клеточных белков (круговорот белков, гл. 27, т. 3). Если аминокислоты, высвобождающиеся при распаде белков, не требуются для синтеза новых белков, они подвергаются окислительному расщеплению.
2. При потреблении пищи, богатой белками, количество поступающих аминокислот превосходит потребности организма для белкового синтеза и их излишек поступает в катаболические пути. Аминокислоты не могут запасаться.
3. Во время голодания или при сахарном диабете, когда углеводы либо недоступны, либо не усваиваются в качестве топлива, используются белки клетки.
Во всех этих ситуациях аминокислоты теряют свою аминогруппу с образованием α-кетокислот — «углеродного скелета» аминокислот. α-Кетокислоты окисляются до СO2 и Н2O или, что часто более важно, с образованием трех- или четырехуглеродных единиц, которые в процессе глюконеогенеза могут превращаться в глюкозу для обеспечения энергией мозга, скелетных мышц и других тканей.
Катаболические пути аминокислот довольно похожи у большинства организмов. В центре внимания в этой главе находятся метаболические пути позвоночных, потому что они наиболее изучены. Как и распад углеводов и жирных кислот, процессы деградации аминокислот в конце концов сходятся в центральных катаболических путях, где углеродный скелет большинства аминокислот попадает в цикл трикарбоновых кислот. Некоторые реакции распада аминокислот очень похожи на реакции расщепления жирных кислот (гл. 17).
От других катаболических процессов, описанных до этого момента, распад аминокислот отличает одна важная особенность: каждая аминокислота содержит аминогруппу, и пути распада аминокислот включают поэтому ключевой шаг, в котором α-аминогруппа отделяется от углеродного скелета и попадает в метаболизм аминогрупп (рис. 18-1). Сначала мы рассмотрим метаболизм аминогрупп и выведение азота, а затем судьбу углеродного скелета, оставшегося от аминокислоты, и мы увидим, как эти пути пересекаются.
Рис. 18-1. Обзор катаболизма аминокислоту млекопитающих. Аминогруппы и углеродные скелеты метаболизируются в разных, но пересекающихся путях.
18.1. Метаболические пути аминогрупп
Азот N2 — самый распространенный в атмосфере газ, но он слишком инертен для того, чтобы участвовать в большинстве биохимических процессов. Так как, только немногие микроорганизмы могут превращать N2 в биологически полезные формы, такие как NН3 (гл. 22), аминогруппы заботливо сберегаются в биологических системах.
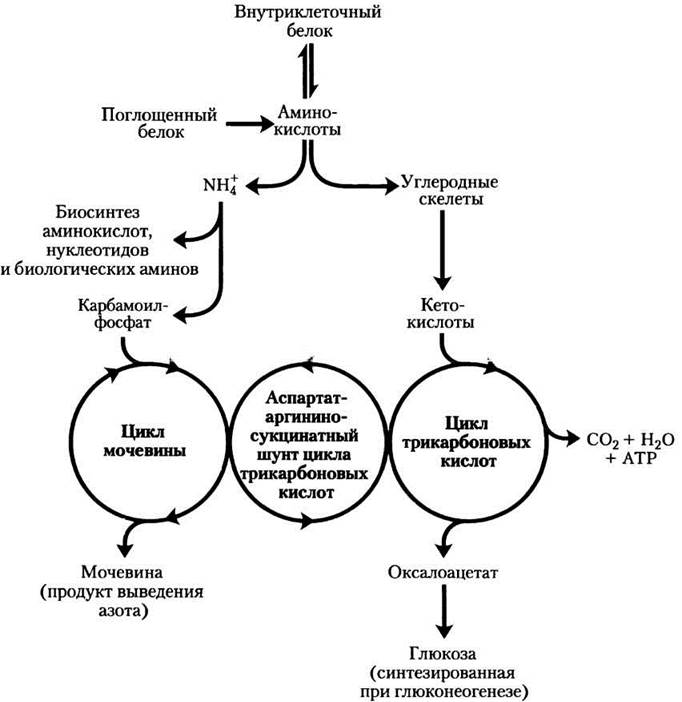
На рис. 18-2, а изображен обзор катаболических путей аммиака и аминогрупп позвоночных. Источником большей части аминогрупп являются аминокислоты, полученные из белков пищи. Большинство аминокислот метаболизируется в печени. Аммиак, образующийся в этом процессе, перерабатывается и используется в разнообразных путях биосинтеза; избыток аммиака либо просто выводится, либо перед выделением превращается в мочевину или мочевую кислоту, что зависит от
организма (рис. 18-2, б). Избыток аммиака, образующегося в других (внепеченочных) тканях, доставляется к печени (в виде аминогрупп, как будет описано ниже) для превращения в форму, которая экскретируется.
Рис. 18-2. Катаболизм аминогрупп, а — обзор катаболизма аминогрупп в печени позвоночных. б — экскретируемые формы азота. Избыток NH+4 выводится в виде аммония (микробы, костные рыбы), мочевины (большинство наземных позвоночных) или мочевой кислоты (птицы и наземные рептилии). Обратите внимание на то, что углерод в мочевине и мочевой кислоте наиболее окислен; организм выводит углерод только после извлечения максимально возможного количества энергии при его окислении.
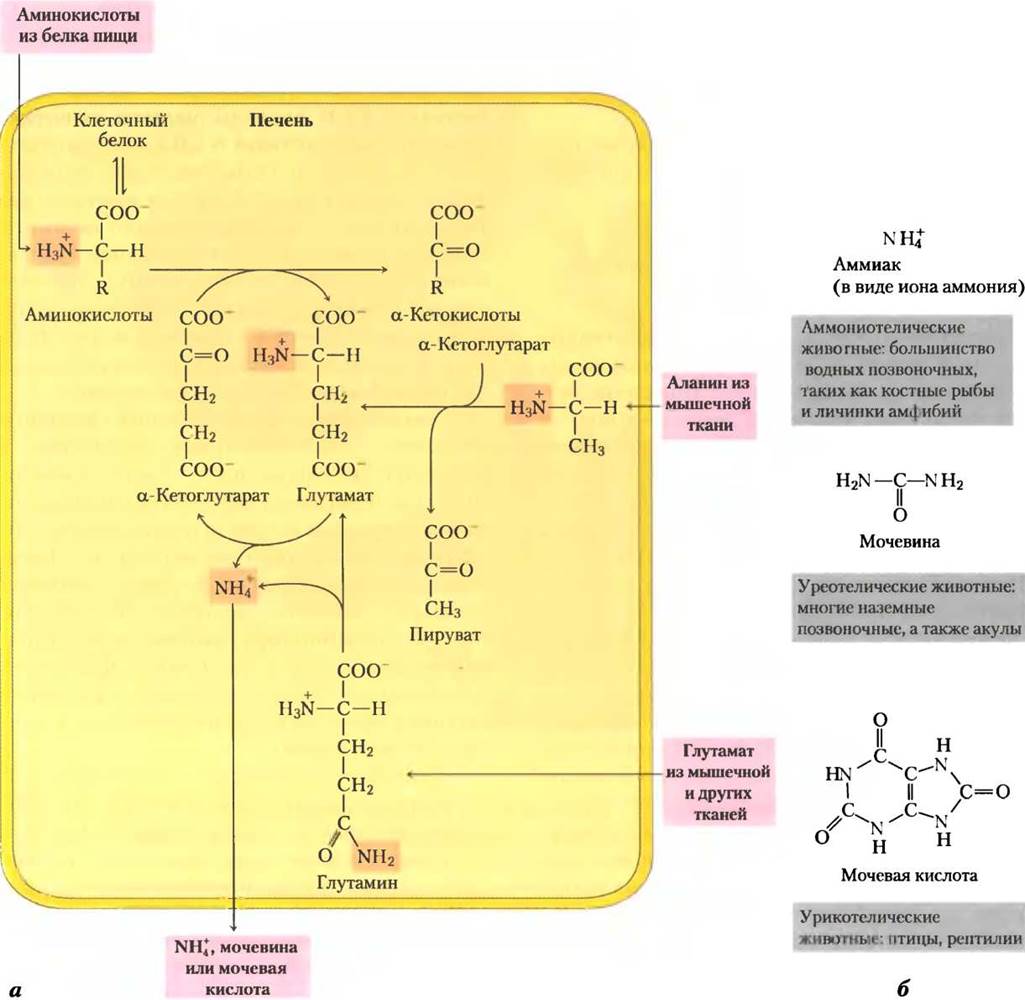
Глутамат и глутамин играют особенно важную роль в метаболизме азота, работая в качестве главных «сборщиков» аминогрупп. В цитозоле гепатоцитов аминогруппы большинства аминокислот переносятся на α-кетоглутарат с образованием глутамата, который попадает в митохондрии. Там от него отщепляются аминогруппы в виде NH+4. Избыток аммиака, образованного в большинстве других тканей, превращается в азот амидной группы глутамина, который попадает в печень, а затем в митохондрии печени. Почти во всех тканях концентрация глутамина и/или глутамата выше, чем концентрация других аминокислот.
В скелетных мышцах избыток аминогрупп переносится главным образом на пируват с образованием аланина, который тоже принимает участие в транспорте аминогрупп в печень.
Мы начнем обсуждение с расщепления белков пищи, а затем в общих чертах дадим описание метаболических путей аминогрупп.
Белки пищи подвергаются ферментативному расщеплению до аминокислот
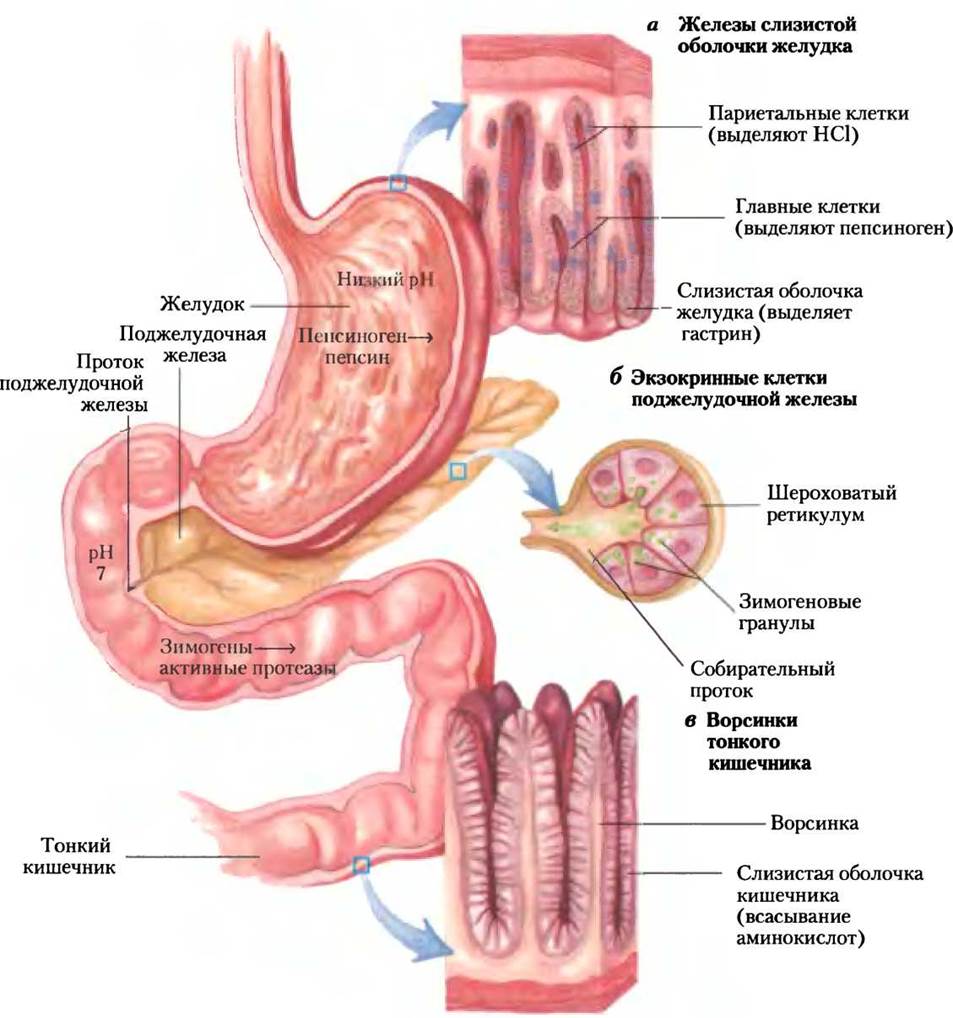
В организме человека расщепление полученных с пищей белков на аминокислоты происходит в желудочно-кишечном тракте. Попадание белков пищи в желудок стимулирует секрецию в слизистой оболочке желудка гормона гастрина, который в свою очередь стимулирует секрецию соляной кислоты париетальными клетками и пепсиногена главными клетками желез желудка (рис. 18-3, а). Кислый желудочный сок (pH от 1,0 до 2,5) действует одновременно и как антисептик, убивая большинство бактерий и другие чужеродные клетки, и как денатурирующий агент, разворачивая глобулярные белки, делая их внутренние пептидные связи более доступными ферментативному гидролизу. Неактивный предшественник пепсиноген (Мr 40 554), или зимоген (с. 328, т. 1), превращается в активный пепсин (Мr 34 614) путем автокаталитического расщепления (ферментативное действие самого пепсина), которое запускается только при понижении pH. В желудке пепсин гидролизует поглощенные белки по пептидным связям перед остатками ароматических аминокислот Phe, Тrр и Туr (см. табл. 3-7, т. 1), разрывая длинные полипептидные цепочки на смесь более коротких пептидов.
Так как кислое содержимое желудка проходит в тонкий кишечник, низкий pH запускает выделение в кровь гормона секретина слизистой оболочкой тонкого кишечника. Секретин стимулирует выделение поджелудочной железой в тонкий кишечник гидрокарбоната для нейтрализации НСl, что приводит к резкому повышению pH примерно до 7. (Все секреты поджелудочной железы попадают в тонкий кишечник через проток поджелудочной железы.) Теперь белки перевариваются с меньшей интенсивностью. Попадание аминокислот в верхнюю часть кишечника (двенадцатиперстную кишку) вызывает высвобождение в кровь гормона холецистокинина, который стимулирует секрецию нескольких ферментов поджелудочной железы с оптимум pH ~7-8. Трипсиноген, химотрипсиноген и прокарбоксипептидазы А и В, зимогены трипсина, химотрипсина и карбоксипептидаз А и В синтезируются и выделяются экзокринными клетками поджелудочной железы (рис. 18-3, б). Под действием энтеропептидазы — протеолитического фермента, высвобождаемого клетками кишечника, трипсиноген переводится в активную форму — трипсин, который затем катализирует превращение оставшегося трипсиногена в трипсин (см. рис. 6-38, т. 1). Трипсин также активирует химотрипсиноген, прокарбоксипептидазы и проэластазы.
Зачем нужен такой сложный механизм активации пищеварительных ферментов в желудочно-кишечном тракте? Синтез ферментов в виде неактивных предшественников защищает экзокринные клетки от разрушающего действия их протеолитической активности. Далее, поджелудочная железа не допускает самопереваривания, выделяя специфический ингибитор — белок ингибитора трипсина поджелудочной железы (с. 328, т. 1), который эффективно предотвращает преждевременное образование активных протеолитических ферментов в панкреатических клетках.
Трипсин и химотрипсин затем расщепляют пептиды, образованные в желудке под действием пепсина. Эта стадия переваривания белков осуществляется очень эффективно, так как пепсин, трипсин и химотрипсин имеют разную специфичность по аминокислотам (см. табл. 3-7, т. 1). Расщепление коротких пептидов в тонком кишечнике завершается другими пептидазами кишечника, в том числе карбоксипептидазами А и В (цинксодержащие ферменты), которые последовательно отщепляют аминокислотные остатки с С-конца пептида, и аминопептидазами, которые последовательно отщепляют аминокислотные остатки с N-конца пептида. Смесь свободных аминокислот транспортируется в выстилающие тонкий кишечник эпителиальные клетки (рис. 18-3, в), через которые они попадают в кровеносные капилляры ворсинок и переносятся в печень. У человека глобулярные белки животной пищи практически полностью гидролизуются в желудочно-кишечном тракте до аминокислот, но некоторые фибриллярные белки, такие как кератин, перевариваются только частично. Белковое содержимое клеток некоторых растительных продуктов защищено от расщепления неперевариваемой кожицей из целлюлозы.
Рис. 18-3. Участок пищеварительного тракта человека, а — париетальные клетки и главные клетки желез желудка выделяют продукты в ответ на гормон гастрин. В желудке расщепление белков начинает пепсин. б — цитоплазма экзокринных клеток полностью заполнена шероховатым ретикулумом, местом синтеза зимогенов (проферментов) множества пищеварительных ферментов. Зимогены находятся в замкнутых мембранных транспортных везикулах, которые называются зимогеновыми гранулами. При стимуляции экзокринной клетки ее плазматическая мембрана сливается с мембранами зимогеновых гранул, и зимогены в процессе экзоцитоза высвобождаются в просвет собирательных протоков. Собирательные протоки ведут к протоку поджелудочной железы, а оттуда в тонкий кишечник. в — аминокислоты абсорбируются эпителиальными клетками (слизистая кишечника) ворсинок и попадают в капилляры. Напомним, что продукты гидролиза липидов в тонком кишечнике после всасывания слизистой оболочкой кишечника попадают в лимфу (см. рис. 17-1).
При остром панкреатите нарушено нормальное пищеварение, а именно нарушено поступление панкреатического секрета в кишечник. Зимогены протеолитических ферментов превращаются в каталитически активные формы преждевременно, внутри панкреатических клеток, и атакуют саму поджелудочную железу. Это вызывает мучительную боль и разрушение органа, что может иметь фатальные последствия. ■
Пиридоксальфосфат участвует в переносе α-аминогруппы на α-кетоглутарат
Катаболизм большинства L-аминокислот в печени начинается с удаления α-аминогруппы, осуществляемого ферментами аминотрансферами или трансаминазами. В этих реакциях транс- аминирования α-аминогруппа переносится на α-углеродный атом α-кетоглутарата, в итоге получается а-кетокислота, аналог аминокислоты (рис. 18-4). Здесь не происходит чистого дезаминирования (потери аминогруппы), потому что а-кетоглутарат приобретает аминогруппу, а а-аминокислота ее теряет. В результате реакций трансаминирования аминогруппы многие разные аминокислоты собираются в форме L-глутамата. Глутамат затем функционирует в качестве донора аминогрупп для путей биосинтеза или для экскреторных путей, которые ведут к удалению азотсодержащих ненужных продуктов.
Рис. 18-4. Ферментативное трансаминирование. В большинстве аминотрансферазных реакций акцептором аминогрупп выступает α-кетоглутарат. Все аминотрансферазы в качестве кофактора используют пиридоксальфосфат (PLP). Хотя реакция показана здесь в направлении переноса аминогруппы на α-кетоглутарат, она легко обратима.
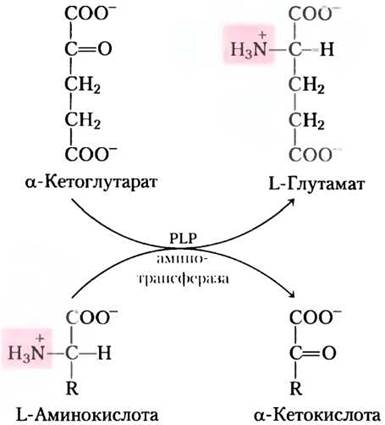
Клетки содержат различные типы аминотрансфераз. Многие из них специфичны по отношению к α-кетоглутарату как акцептору аминогрупп, но различаются по специфичности к α-аминокислотам. Реакции, катализируемые аминотрансферазами легко обратимы; константа равновесия ~ 1,0 (∆G' ≈ 0 кДж/моль).
Все аминотрансферазы несут одну и ту же простетическую группу и у них одинаковый механизм реакции. Простетическая группа — это пиридоксальфосфат (PLP — pyridoxalphosphate) — форма кофермента пиридоксина, или витамина В6. Мы уже говорили о пиридоксальфосфате в гл. 15, где он выступал в качестве кофермента гликогенфосфорилазы, но роль, которую играет PLP в этой реакции, для него не столь характерна. Его главная функция в клетке — участие в метаболизме молекул, где есть аминогруппы.
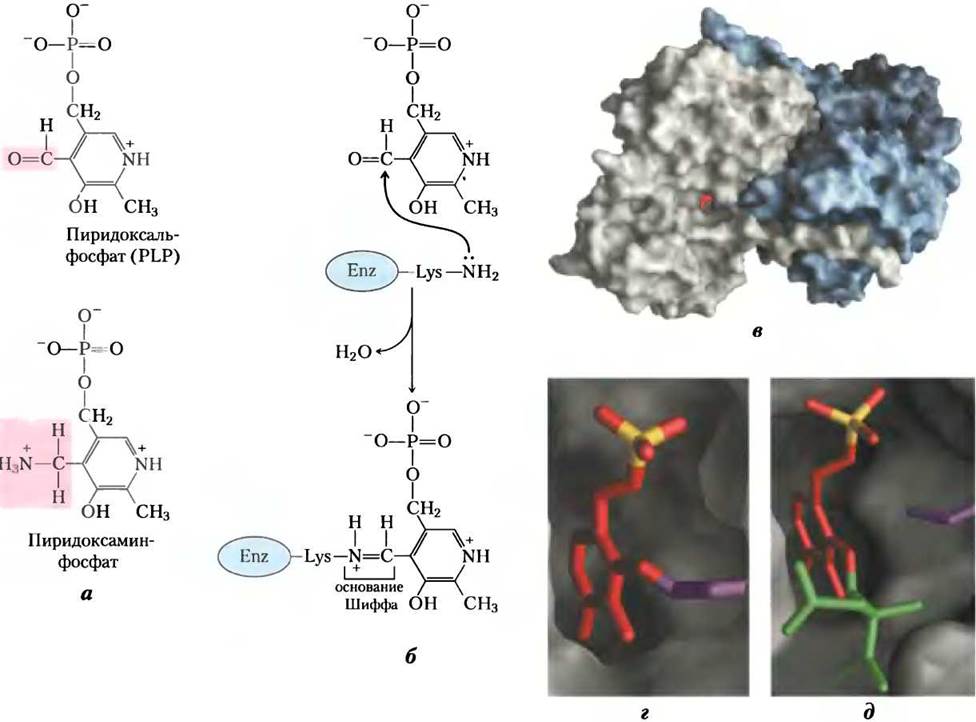
Пиридоксальфосфат работает как промежуточный переносчик аминогрупп в активном центре аминотрансфераз. Он обратимо переходит между альдегидной формой — пиридоксальфосфатом, который может присоединять аминогруппы, и аминированной формой — пиридоксаминфосфатом, который может быть донором аминогрупп для α-кетокислоты (рис. 18-5, а). Пиридоксальфосфат обычно ковалентно связан с активным центром фермента, образуя шиффово основание с ε-аминогруппой остатка Lys (рис. 18-5, б, г).
Рис. 18-5. Пиридоксальфосфат — простетическая группа аминотрансфераз. а — пиридоксальфосфат (PLP) и его аминопроизводное пиридоксаминфосфат — прочно связанные коферменты аминотрансфераз. Функциональные группы выделены розовым. б — пиридоксальфосфат связан с ферментом нековалентными взаимодействиями и образует шиффово основание через остаток Lys в активном центре. Образование основания Шиффа из первичного амина и карбонильной группы детализировано на рис. 14-5. в — молекула PLP (красная) связана с одним из двух активных центров димера фермента аспартатаминотрансферазы, типичной аминотрансферазы; г — изображение активного центра с PLP (показан красным с желтым фосфатом), образующего альдиминную связь с боковой цепью Lys258 (фиолетовый); д — активный центр с PLP, который связан с субстратным аналогом 2-метиласпартатом (зеленый) через шиффово основание (PDB lD lAJS).
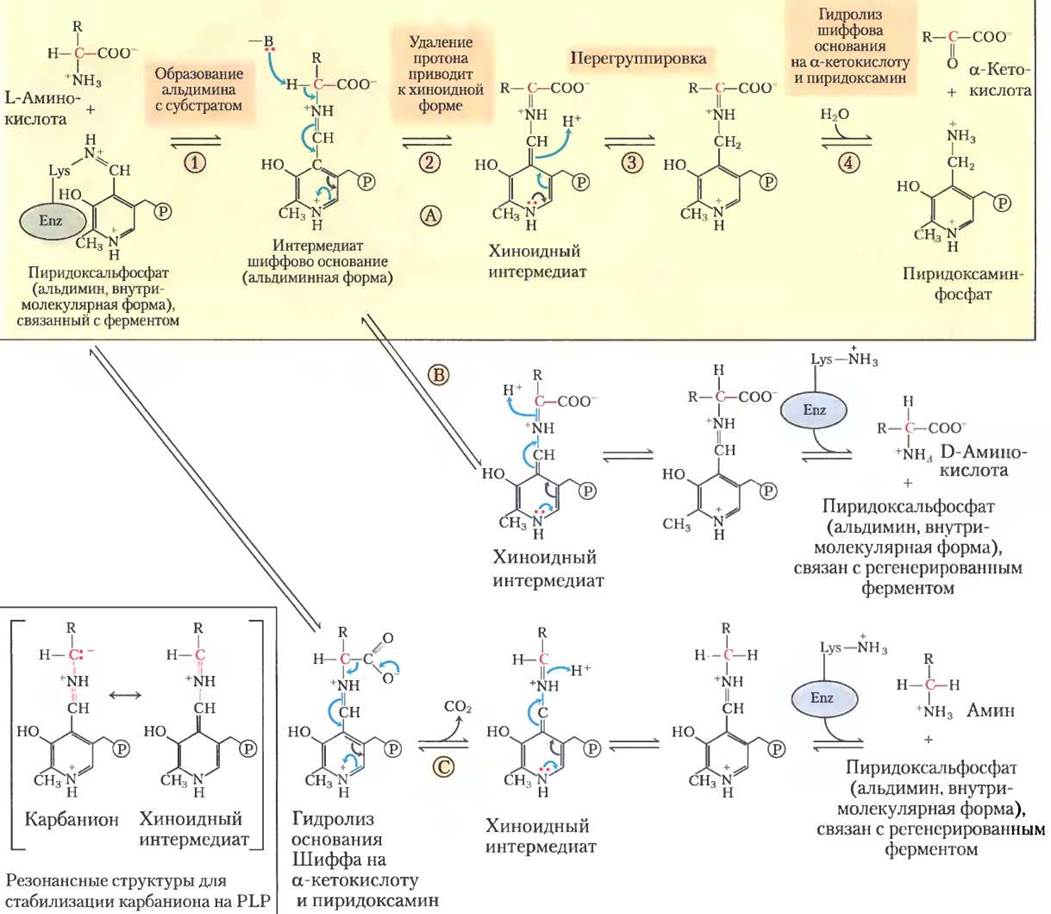
Пиридоксальфосфат участвует в разнообразных реакциях с α-, β- и y-углеродами аминокислот (от С-2 до С-4). Наряду с реакциями трансаминирования α-углерод аминокислот (рис. 18-6) может участвовать в реакциях рацемизации (взаимопревращение L- и D-аминокислот) и декарбоксилирования. Пиридоксальфосфат играет одну и ту же роль в каждой из этих химических реакций. Связь α-углерода субстрата либо с протоном, либо с карбоксильной группой разрывается. Из-за оставшейся пары электронов α-углерод становится очень нестабильным карбанионом, но пиридоксальфосфат резонансно стабилизирует этот интермедиат (рис. 18-6, вставка). Такая сопряженная структура РLР (акцептора электронов) облегчает делокализацию отрицательного заряда.
Рис. 18-6. Механизм реакции. Некоторые превращения при α-углероде аминокислот, в которых участвует пиридоксальфосфат. Пиридоксальфосфат, как правило, связан с ферментом через шиффово основание, которое еще называют внутримолекулярным альдимином. Эта активированная форма PLP немедленно трансаминируется с образованием нового шиффова основания (обычного альдимина) с α-аминогруппой, расщепляемой аминокислоты (см. рис. 18-5,6, г). Показаны три альтернативные судьбы этого шиффова основания: (А) трансаминирование, (В) рацемизация и (С) декарбоксилирование. Шиффово основание, образованное между PLP и аминокислотой, сопряжено с пиридиновым кольцом, который оттягивает на себя электроны, делокализуя электронную плотность, что предотвращает образование нестабильного карбаниона с зарядом на α-углероде (вставка). Хиноидный интермедиат участвует во всех трех реакциях. Реакция трансаминирования (А) особенно важна для пути, описанного в этой главе. Этот путь (слева направо), выделен на цветной плашке: это только некоторые реакции, катализируемые аминотрансферазами. В полном процессе вторая α-кетокислота замещает аминокислоту, которая отщепляется в обратной реакции (справа налево). Пиридоксальфосфат также участвует в реакциях β- и Y-углеродов некоторых аминокислот (не показано). Механизм реакции с пиридоксальфосфатом
Аминотрансферазы (рис. 18-5) — классический пример ферментов, катализирующих бимолекулярные реакции, которые протекают по механизму «пинг-понг» (см. рис. 6-13, б). В таких реакциях первый субстрат покидает активный центр перед тем, как с ним свяжется второй субстрат. Таким образом, приходящая аминокислота связывается с активным центром, отдает аминогруппу на пиридоксальфосфат и отщепляется в виде α-кетокислоты. Затем связывается следующая α-кетокислота, которая также принимает аминогруппу от пиридоксаминфосфата и вновь отщепляется в виде аминокислоты. Как описано в доп. 18-1, измерение уровня аланин- и аспартатаминотрансфераз в сыворотке крови дает важную информацию для диагностики некоторых заболеваний.
Дополнение 18-1. МЕДИЦИНА. Диагностика повреждений различных органов человека
Анализы сыворотки крови на определенные ферментативные активности дают ценную информацию при диагностике ряда заболеваний.
Уровень аланинаминотрансфераза (обычное сокращение — АЛТ или ALT, которую также называют глутамат-пируват-трансаминазой, ГПТ), и уровень аспартатаминотрансфераза (ACT; которую также называют глутамат-оксалоацетат-трансаминаза, ГОТ) — важные показатели при диагностике повреждений клеток сердца и печени, вызванных инфарктом миокарда, токсичностью лекарств или инфекцией. После инфаркта в кровоток из поврежденных клеток сердца попадают различные ферменты, включая эти аминотрансферазы. Измерения концентраций этих двух аминотрансфераз в сыворотке крови (показатели СГПТ и СГОТ; С — от слова сыворотка), а также фермента креатинкиназы (СКК) могут дать информацию о времени, прошедшем после повреждения миокарда. Креатинкиназа операжает другие ферменты, поступающие в кровоток при инфаркте миокарда; но через некоторое время СКК уже не обнаруживается в крови. За СКК в крови появляется ГОТ, а затем ГПТ. Из поврежденных анаэробных клеток сердечной мышцы поступает также лактатдегидрогеназа.
Анализы на СГОТ и СГПТ важны и при медицинских профобследованиях для выявления повреждения печени у людей, работающих с тетрахлоридом углерода, хлороформом или другими растворителями. Отравления этими растворителями сопровождаются «утечкой» различных ферментов из поврежденных гепатоцитов в кровь. У людей, работающих с этими химикатами, контролируют уровень этих аминотрансфераз, а так как в печени эти активности довольно большие, то они обнаруживаются даже при очень малых количествах этих ферментов.
В печени аминогруппа глутамата высвобождается в виде аммиака
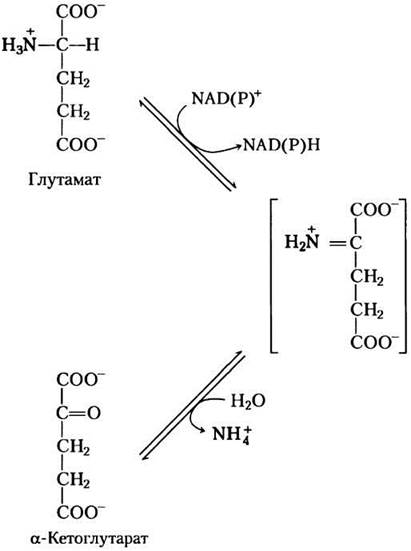
Как мы рассмотрели ранее, аминогруппы большинства аминокислот собираются в печени в виде аминогрупп L-глутамата. Для того чтобы вывести аминогруппы из организма, они должны быть удалены с глутамата. В гепатоцитах глутамат транспортируется из цитозоля в митохондрии, где он подвергается окислительному дезаминированию,катализируемому L-глутаматдегидрогеназой (Мr 330 000). У млекопитающих этот фермент, присутствует в матриксе митохондрий. Это единственный фермент, который может использовать в качестве субстратов для образования восстановительных эквивалентов или NАD+, или NАDР+(рис. 18-7).
Рис. 18-7. Реакция, катализируемая глутаматдегидрогеназой. Глутаматдегидрогеназа печени млекопитающих обладает необычной способностью использовать в качестве кофактора NAD+ или NADP+. Глутаматдегидрогеназы растений или микроорганизмов обычно специализируются на каком-то одном кофакторе. Фермент млекопитающих аллостерически регулируется GTP и АТР.
Комбинированное действие аминотрансферазы и глутаматдегидрогеназы названо трансдезаминированием. Некоторые аминокислоты минуют реакцию трансаминирования и подвергаются только оксислительному дезаминированию. Судьба NH4+, образованного в процессах дезаминирования, подробно обсуждается в разд. 18.2. α-Кетоглутарат, получающийся при дезаминировании глутамата, может быть использован в цикле трикарбоновых кислот или при синтезе глюкозы.
Глутаматдегидрогеназа работает на «перекрестке» путей углеродного и азотного метаболизма. Этот фермент содержит шесть идентичных субъединиц, его активность определяется сложным набором аллостерических модуляторов. Из них наиболее изучены положительный модулятор (активатор) АТР и отрицательный модулятор (ингибитор) GTP. Рациональность такого регулирования метаболизма до конца не ясна. Мутации, изменяющие аллостерический центр связывания GTP или как-либо иначе вызывающие постоянную активацию глутаматдегидрогеназы, приводят к генетической болезни человека — синдрому гиперинсулинизма и гипераммониемии, при которых повышается уровень аммония в крови и развивается гипогликемия.
В кровотоке аммиак транспортируется глутамином
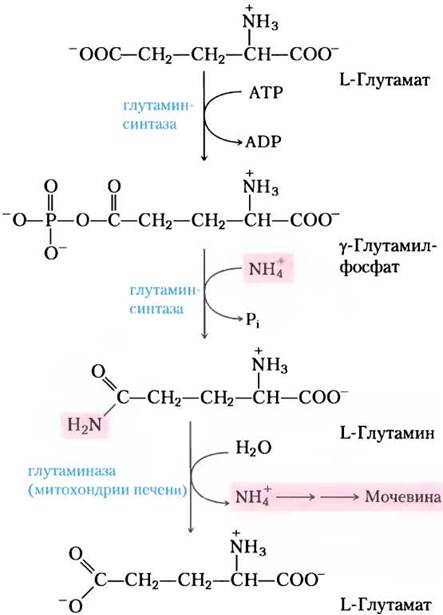
Для тканей животных аммиак довольно токсичен (позже мы обговорим несколько вероятных причин этого), его уровень в крови жестко регулируется. Практически во всех тканях, включая мозг, в результате таких процессов, как распад нуклеотидов, выделяется аммиак. У большинства животных почти весь свободный аммиак превращается в нетоксичное соединение до выведения его из внепеченочных тканей в кровь и дальнейшего транспорта к печени или почкам. Для этой транспортной функции глутамат, который играет ключевую роль во внутриклеточном метаболизме аминогрупп, превращается в L-глутамин. Свободный аммиак, выделяемый тканями, соединяется с глутаматом с образованием глутамина под действием глутаминсинтазы. Эта реакция происходит в две стадии с затратой энергии АТР (рис. 18-8). Сначала глутамат и АТР взаимодействуют с образованием ADP и y-глутамилфосфатного интермедиата, который затем вступает в реакцию с аммиаком, в результате получаются глутамин и неорганический фосфат. Глутамин — нетоксичная транспортная форма аммиака; в норме он присутствует в крови даже в более высокой концентрации, чем другие аминокислоты. Глутамин также служит источником аминогрупп в разнообразных реакциях биосинтеза. Глутаминсинтаза найдена во всех организмах, и она всегда играет центральную роль в метаболизме. У микроорганизмов этот фермент переводит существенную часть фиксированного азота в биологическую форму. (Роль глутамин- и глутаматсинтаз в метаболизме обсуждается в гл. 22.)
Рис. 18-8. Аммоний транспортируется в форме глутамина. Избыток аммония в тканях присоединяется к глутамату с образованием глутамина в реакции, катализируемой глутаминсинтазой. По кровотоку глутамин попадает в печень, где NH+4 высвобождается ферментом глутаминазой.
У большинства наземных животных избыток глутамина, который не нужен для биосинтеза, транспортируется кровотоком к кишечнику, печени и почкам для переработки. Там амидный азот высвобождается в виде иона аммония в митохондриях, где фермент глутаминаза превращает глутамин в глутамат и NH+4 (рис. 18-8). Аммоний из кишечника и почек транспортируется кровотоком в печень. В печени поступивший NH+ участвует в синтезе мочевины. Некоторое количество глутамата, образованного в глутаминазной реакции, в дальнейшем может подвергаться действию глутаматдегидрогеназы в печени с образованием некоторого количества аммония и углеродного скелета для резервных топливных молекул. Однако основные количества глутамата вступают в реакции трансаминирования при биосинтезе аминокислот и в другие реакции (гл. 22). При метаболическом ацидозе (с. 254) происходит увеличение переработки глутамина в почках. В результате не весь избыток существующего NН+4 выделяется в кровь или превращается в мочевину; некоторая часть прямо выделяется в мочу. В почках образует соли с кислотами, поступающими из метаболических циклов, облегчая их удаление с мочой. В плазме крови роль буфера также могут выполнять гидрокарбонаты, образованные при декарбоксилировании α-кетоглутарата в цикле трикарбоновых кислот. В совокупности эти особенности метаболизма глутамина в почках способны противодействовать ацидозу. ■
Аланин переносит аммиак из скелетных мышц в печень
Аланин также играет важную роль при транспортировке аминогрупп в нетоксичной форме в печень по пути, который называется глюкозоаланиновым циклом (рис. 18-9). В мышцах и некоторых других тканях, где происходит расщепление аминокислот с целью получения энергии, аминогруппы в результате трансаминирования собираются в форме глутамата (рис. 18-2, а). Глутамат может превращаться в глутамин для доставки аминогрупп в печень, как было описано выше, а может при действии аланинаминотрансферазыпередать свою α-аминогруппу на пируват, легко доступный благодаря происходящему в мышцах гликолизу (рис. 18-9). Образованный таким образом аланин попадает в кровь и переносится в печень. В цитозоле гепатоцитов аминотрансфераза переносит аминогруппу аланина на α-кетоглутарат с образованием пирувата и глутамата. Глутамат может попасть в митохондрии, где в глутаматдегидрогеназной реакции высвободит NH+4 (рис. 18-7), а может участвовать реакции трансаминирования с оксалоацетатом с образованием аспартата — еще одного донора азота при синтезе мочевины, что мы скоро увидим.
Рис. 18-9. Глюкозо-аланиновый цикл. Аланин служит переносчиком аммония и углеродного скелета пирувата от скелетной мускулатуры к печени. Аммоний выводится, а пируват используется для синтеза глюкозы, которая возвращается в мышечную ткань.
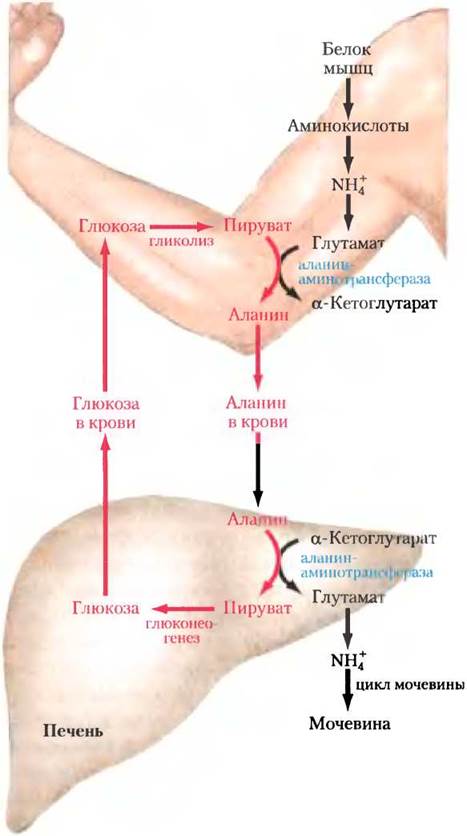
Использование аланина для переноса аммония из скелетной мускулатуры к печени — еще один пример экономии, свойственной живым организмам. Энергично сокращающаяся скелетная мышца получает энергию анаэробно, при гликолизе в ней образуются пируват и лактат, а при расщеплении белков — аммиак. Эти продукты должны попасть в печень, где пируват и лактат превратятся в глюкозу, которая вернется в мышцы, и аммиак превратится в мочевину для выведения. Превращения осуществляются в глюкозо- аланиновом цикле в сочетании с циклом Кори (см. доп. 14-2 и рис. 23-20). Таким образом, энергетические затраты на глюконеогенез в большей степени осуществляются печенью, а не мышцами, и весь доступный мышцам АТР расходуется на их сокращение.
Аммиак токсичен для животных
Образование аммиака в процессах катаболизма представляет собой серьезную биохимическую проблему, потому что аммиак очень токсичен. Молекулярные основы этой токсичности поняты не до конца. У человека конечные стадии интоксикации аммиаком характеризуются развитием коматозного состояния, сопровождаются отеком мозга и увеличением внутричерепного давления, поэтому исследования причины аммиачной токсичности проводятся главным образом на мозговой ткани. По одной из теорий, основной причиной аммиачной токсичности считается сильное истощение клеток мозга по АТР.
Выведение избытка аммиака из цитозоля требует восстановительного аминирования α-кетоглутарата до глутамина под действием глутаматдегидрогеназы (в реакции, обратной описанной ранее, рис. 18-7) или превращения глутамата в глутамин под действием глутамин- синтазы. Оба фермента присутствуют в мозге в высокой концентрации, хотя почти наверняка глутаминсинтазная реакция играет более важную роль при удалении аммиака. Высокий уровень NH+4 ведет к увеличению уровня глутамина (осмолит) в растворе, который осмотически активен в астроцитах мозга, звездчатых клетках нервной системы, обеспечивающих питание, поддержку и изоляцию нейронов. Это влечет за собой поглощение воды астроцитами для поддержания осмотического баланса, что приводит к набуханию клеток и отеку мозга, вызывая коматозное состояние.
Недостаток глутамата в глутаминсинтазной реакции может иметь дополнительное влияние на мозг. Глутамат и его производное y-аминобутират (y-аминомасляная кислота, ГАМК) — важные нейромедиаторы; чувствительность мозга к аммиаку, как и изменения в осмотическом балансе, может отражать нехватку нейромедиаторов. ■
На этом мы заканчиваем наше изложение о метаболизме аминогрупп. Заметьте, что мы описали несколько процессов, в результате которых избыток аммиака попадает в митохондрии гепатоцитов (рис. 18-2). Далее рассмотрим судьбу этого аммиака.
Краткое содержание раздела 18.1 Метаболические пути аминогрупп
■ Человек получает небольшое количество энергии в результате катаболизма аминокислот. Аминокислоты, образующиеся в организме в процессах регулярного расщепления (круговорота) клеточных белков, распада поглощенных белков и деградации белков, используются вместо других источников энергии при голодании или неконтролируемом сахарном диабете.
■ Протеазы расщепляют поглощенные белки в желудке и тонком кишечнике. Большинство протеаз изначально синтезируется в виде неактивных зимогенов.
■ Первый шаг в катаболизме аминокислот — это отщепление аминогруппы от углеродного скелета. В большинстве случаев аминогруппа переносится на α-кетоглуторат с образование глутамата. Для этой реакции трансаминирования необходим пиридоксальфосфат.
■ Глутамат транспортируется в митохондрии печени, где глутаматдегидрогеназа освобождает аминогруппу в виде иона аммония (NH+4). Аммиак, образующийся в других тканях, попадает в печень в виде амида глутамина, а при транспорте из скелетных мышц — в виде аминогруппы аланина.
■ Пируват, образованный при дезаминировании аланина в печени, превращается в глюкозу, которая транспортируется обратно в мышцы как часть глюкозо-аланинового цикла.