ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 2. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ - 2014
ЧАСТЬ II. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ
18. ОКИСЛИТЕЛЬНОЕ РАСЩЕПЛЕНИЕ АМИНОКИСЛОТ И ОБРАЗОВАНИЕ МОЧЕВИНЫ
18.2. Выделение азота и цикл мочевины
Если аминогруппы (рис. 18-10) не нужны для синтеза новых аминокислот или других азотсодержащих продуктов, они превращаются в конечный экскретируемый продукт. Большинство водных организмов, таких как костные рыбы, аммониотелические, т. е. выводят азот аминогруппы в виде аммиака. Токсичный аммиак просто выводится в окружающую воду. Наземным животным для выведения азота необходимы пути, которые минимизируют токсичность и потерю воды. Наземные животные в основном уреотелические, т. е. выделяют азот аминогруппы в виде мочевины; птицы и рептилии урикотелические, они выделяют азот аминогруппы в виде мочевой кислоты. (Путь синтеза мочевой кислоты описан на рис. 22-45.) Растения используют фактически все аминогруппы и выделяют азот только в очень редких случаях.
У уреотелических организмов аммиак, попавший в митохондрии гепатоцитов, превращается в мочевину в цикле мочевины. Этот путь был открыт в 1932 г. Хансом Кребсом (именно он позже открыл и цикл трикарбоновых кислот) и его коллегой студентом-медиком Куртом Хенселейтом. Образование мочевины происходит главным образом только в печени, и большая часть аммиака в конце концов собирается здесь. Мочевина попадает в кровоток, затем в почки и выводится с мочой. Процесс образования мочевины мы и рассмотрим в этом разделе.
Мочевина образуется из аммиака в пяти ферментативных реакциях
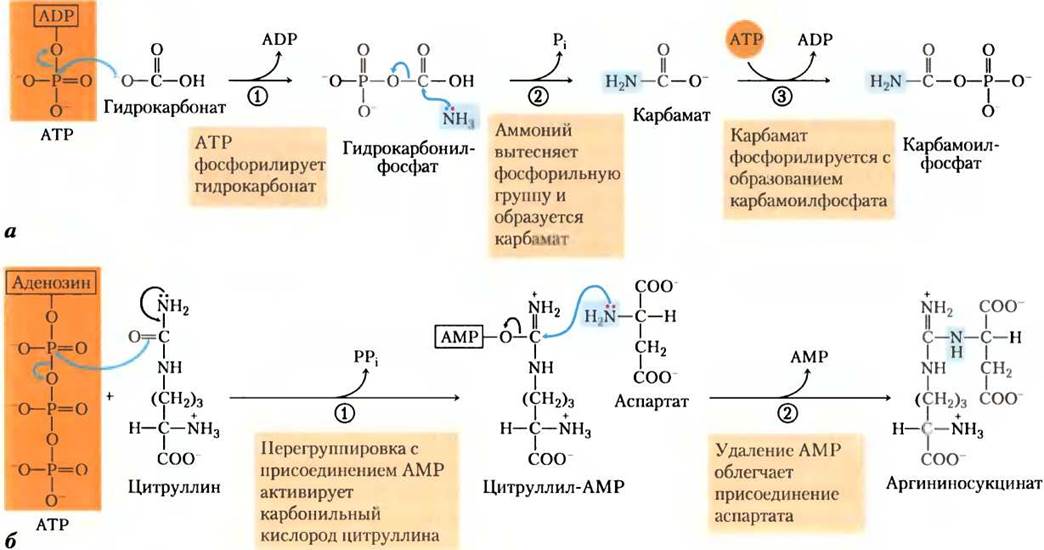
Цикл мочевины начинается в митохондриях печени, но три последующих шага происходят в цитозоле; цикл, таким образом, охватывает два клеточных компартмента (рис. 18-10). Первая аминогруппа, которая попадает в цикл мочевины, образуется в митохондриальном матриксе из аммония, поступающего из путей, описанных ранее. Печень также может получать через воротную вену некоторое количество аммония из кишечника, от окисления аминокислот бактериями. Какой бы ни был у него источник, NH+4, образующийся в митохондриях печени, моментально образует с СO2 (в виде НСО-3), выделяющимся в процессе митохондриального дыхания, карбамоилфосфат в матриксе (рис. 18-11, а; см. также рис. 18-10). Эта ATP-зависимая реакция катализируется регуляторным ферментом карбамоилфосфатсинтазой I (см. ниже). Митохондриальная форма этого фермента отличается от цитозольной формы (II), которая выполняет особую функцию в биосинтезе пиримидинов (гл. 22).
Карбамоилфосфат, который функционирует в качестве активированного донора карбамоил- группы, теперь включается в цикл мочевины. Этот цикл состоит из четырех ферментативных стадий. Сначала карбамоилфосфат переносит карбамоил-группу на орнитин с образованием цитруллина и высвобождением Рi (рис. 18-10, стадия (1)). Роль орнитина похожа на роль оксалоацетата в цикле трикарбоновых кислот и заключается в связывании поступающих молекул при каждом обороте цикла. Реакция катализируется орнитинтранскарбамоилазой, образовавшийся цитруллин выходит из митохондрий в цитозоль.
Рис. 18-10. Цикл мочевины и реакции, которые предшествуют образованию аминогрупп, попадающих в цикл.
Ферменты, катализирующие эти реакции (их названия приведены в тексте), распределены между матриксом митохондрий и цитозолем. Одна аминогруппа попадает в цикл мочевины в виде карбамоилфосфата, образованного в матриксе; другая в виде аспартата, синтезированного в матриксе при трансаминировании оксалоацетата и глутамата, которое катализирует аспартатаминотрансфераза. Цикл мочевины состоит из четырех стадий: (1) Образование цитруллина из орнитина и карбамоилфосфата (поступление в цикл первой аминогруппы); цитруллин затем попадает в цитозоль. (2) Образование аргининосукцината через интермедиат цитруллил-АМР (поступление в цикл второй аминогруппы). (3) Образование аргинина из аргининосукцината; в этой реакции высвобождается фумарат, который участвует в цикле лимонной кислоты. (4) Образование мочевины; в этой реакции также регенерируется орнитин. Пути, по которым попадает в матрикс митохондрий гепатоцитов обсуждаются в разд. 18.1.
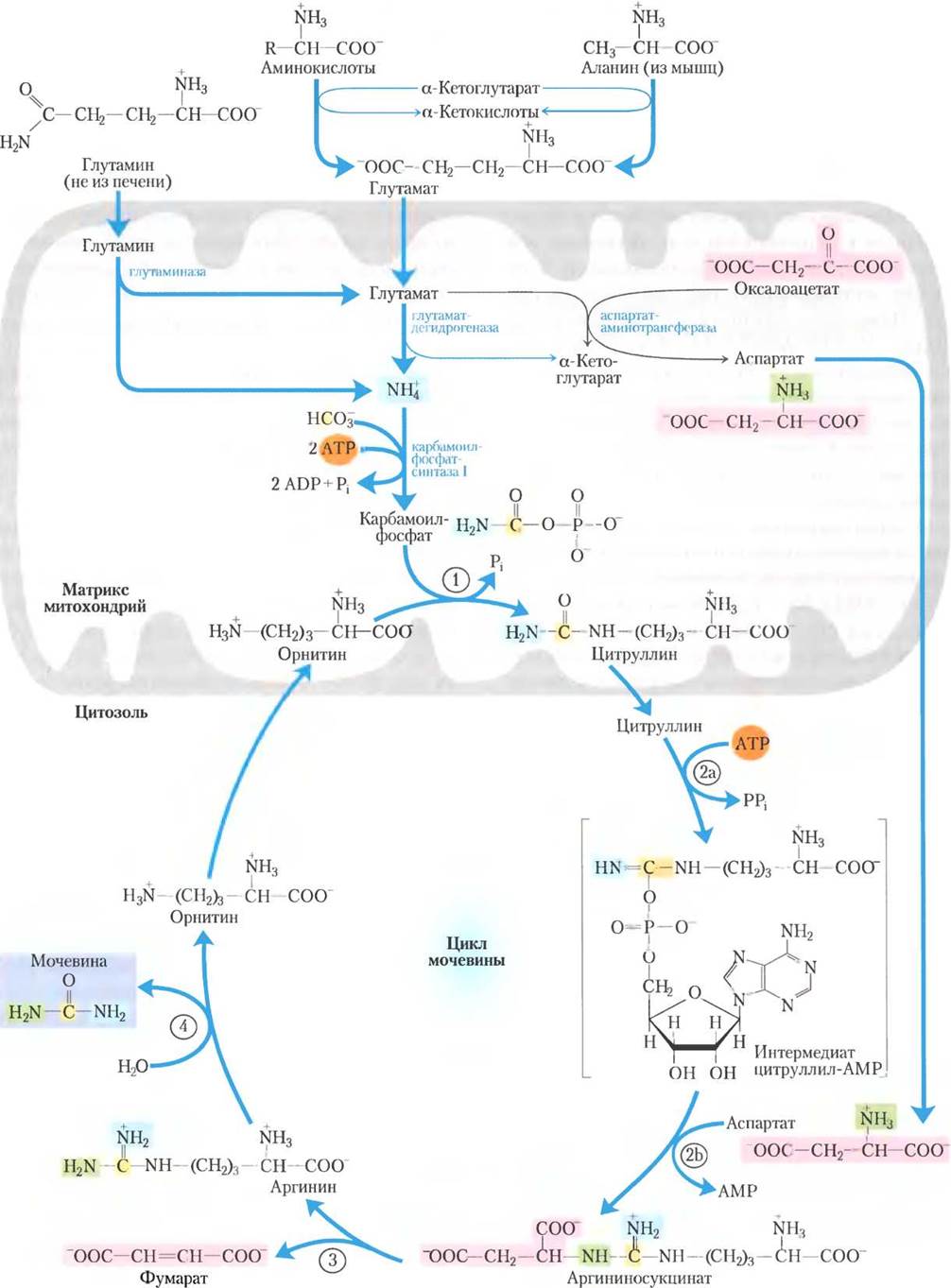
Вторая аминогруппа теперь отщепляется от аспартата (который был образован в митохондриях при трансаминировании и транспортирован в цитозоль); в реакции конденсации между аминогруппой аспартата и уреидогруппой цитруллина образуется аргининосукцинат (стадия (2) на рис. 18-10). В этой цитозольной реакции, катализируемой аргининосукцинатсинтетазой, расходуется АТР; она проходит с образованием интермедиата цитруллил-АМР (рис. 18-11, в). Аргининосукцинат затем расщепляется аргининосукциназой (стадия (3) на рис. 18-10) с образованием свободного аргинина и фумарата, последний направляется в митохондрии и пополняет пул интермедиатов цикла трикарбоновых кислот. Это единственный обратимый шаг в цикле мочевины. В последней реакции цикла мочевины (стадия (4)) цитозольный фермент аргиназа расщепляет аргинин с образованием мочевины и орнитина. Орнитин транспортируется в митохондрии для инициации следующего оборота цикла.
Рис. 18-11. Механизм реакции. Реакции поступления азота при синтезе мочевины. Атомы азота мочевины присоединяются в двух реакциях, каждая требует АТР. а — в реакции, катализируемой карбамоилфосфатсинтазой I, первый атом азота принадлежит аммонию. Терминальные фосфатные группы двух молекул АТР используются для образования одной молекулы карбамоилфосфата. Другими словами, в этой реакции есть две активационные стадии (1) и (3). Механизм работы карбамоилфосфатсинтазы I. б — в реакции, катализируемой аргининосукцинатсинтетазой, второй атом азота поступает от аспартата. Кислород уреидогруппы цитруллина активируется присоединением АМР на стадии (1); это облегчает связывание аспартата на стадии (2). Механизм работы аргининосукцинатсинтетазы
Как мы отмечали в гл. 16, ферменты многих метаболических путей туннелируются (с. 187) для того, чтобы продукт одной ферментативной реакции непосредственно направлялся к следующему ферменту метаболического пути. В цикле мочевины митохондриальные и цитозольные ферменты как раз туннелируются подобным образом. Цитруллин, выходящий из митохондрий, не растворяется в общем пуле метаболитов цитозоля, а попадает строго в активный центр аргининосукцинатсинтетазы. Это туннелирование между ферментами продолжается для аргининосукцината, аргинина и орнитина. Только мочевина высвобождается в общий цитозольный пул метаболитов.
Цикл лимонной кислоты и цикл мочевины могут быть взаимосвязанными
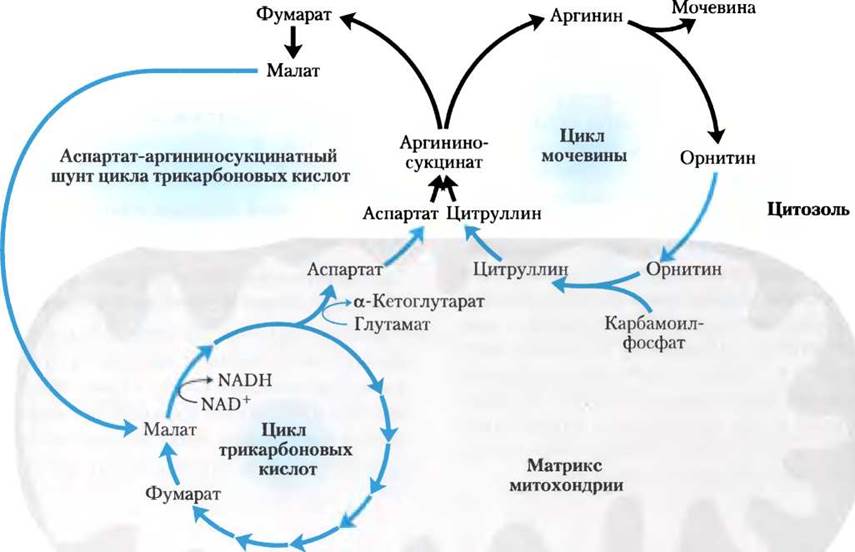
Так как фумарат, образованный в аргининосукциназной реакции, является также интермедиатом в цикле лимонной кислоты, эти циклы связаны между собой в общий процесс, который можно назвать «бициклом Кребса» (рис. 18-12). Однако каждый цикл может работать автономно и взаимодействие между ними зависит от транспорта ключевых интермедиатов между митохондриями и цитозолем. Существуют изозимы нескольких ферментов цикла лимонной кислоты, включая фумаразу (фумаратгидратазу) и малатдегидрогеназу (с. 199), которые присутствуют в цитозоле. Фумарат, образованный при цитозольном синтезе аргинина, может при этом превращаться в малат в цитозоле, и эти интермедиаты в дальнейшем могут метаболизироваться в цитозоле или транспортироваться в митохондрии для использования в цикле лимонной кислоты. Аспартат, образующийся в митохондриях в реакциях трансаминирования между оксалоацетатом и глутаматом, может транспортироваться в цитозоль, где он служит донором азота в реакции цикла мочевины, катализируемой аргининосукцинатсинтетазой. Эти реакции, составляющие аспартат-аргининосукцинатный шунт, обеспечивают метаболические связи между этими путями, в которых утилизируются аминогруппы и углеродный скелет аминокислот.
Рис. 18-12. Взаимосвязь между циклом мочевины и циклом лимонной кислоты. Эти пересекающиеся циклы были названы «бициклом Кребса». Путь, связывающий цикл лимонной кислоты и цикл мочевины, называется аспартат-аргининосукцинатным шунтом; он объединяет пути расщепления аминогрупп и углеродных скелетов аминокислот. Связи между циклами даже более тесные, чем показано стрелками. Например, некоторые ферменты цикла лимонной кислоты, такие как фумараза и малатдегидрогеназа, имеют цитозольный и митохондриальный изозимы. Фумарат, образовавшийся в цитозоле — либо в цикле мочевины, либо при синтезе пуринов, либо в любом другом процессе, может быть превращен в малат, который используется в цитозоле или транспортируется в митохондрии (через малат- аспартатный переносчик; см. рис. 19-29) для участия в цикле лимонной кислоты.
Ферментативные активности в цикле мочевины регулируются на двух уровнях
У животных поток азота через цикл мочевины различается в зависимости от пищи. Когда потребляемая пища богата белками, углеродные скелеты аминокислот используются для получения энергии с образованием большого количества мочевины из остающихся аминогрупп. Образование мочевины также значительно повышается при длительном голодании, когда для поддержания метаболической энергии организма начинается расщепление мышечных белков.
При изменении потребности в ферментативной активности цикла мочевины скорости синтеза четырех ферментов цикла мочевины и карбамоилфосфатсинтетазы I в печени регулируются медленно. У голодающих животных и у животных с высокобелковой диетой все пять ферментов экспрессируются на более высоком уровне, чем у откормленных животных, которые питаются главным образом углеводами и жирами. У животных, потребляющих бедную белками пищу, синтез ферментов цикла мочевины находится на низком уровне. Изменение в уровне экспрессии соответствующих ферментов обеспечивает медленную регуляцию работы цикла мочевины.
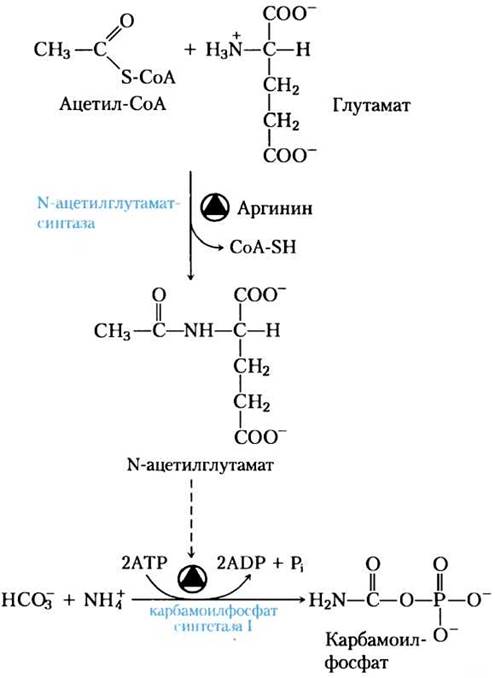
Быстрая аллостерическая регуляция по крайней мере одного ключевого фермента модулирует потоки через цикл мочевины за короткий промежуток времени. Первый фермент этого пути карбамоилфосфатсинтетаза I аллостерически активируется N-ацетилглутаматом, который образуется из ацетил-СоА и глутамата под действием N-ацетилглутаматсинтетазы (рис. 18-13). У растений и микроорганизмов этот фермент катализирует первую стадию синтеза de novo аргинина из глутамата (см. рис. 22-10), но у млекопитающих N-ацетилглутаматсинтетазная активность имеет чисто регуляторную функцию (у млекопитающих нет других необходимых ферментов для превращения глутамата в аргинин). Уровень N-ацетилглутамата определяется концентрациями глутамата и ацетил-СоА (субстраты для N-ацетилглутаматсинтетазы) и аргинина (активатор N-ацетилглутаматсинтазы и, таким образом, цикла мочевины).
Рис. 18-13. Синтез N-ацетилглутамата и активация им карбамоилфосфатсинтетазы I.
Взаимосвязи путей уменьшают энергетическую цену синтеза мочевины
Если мы рассмотрим изолированный цикл мочевины, мы увидим, что на синтез одной молекулы мочевины тратится четыре высокоэнергетические фосфатные группы (рис. 18-10). Для образования карбамоилфосфата необходимы две молекулы АТР, для аргининосукцината — одна АТР, причем последняя молекула АТР подвергается гидролизу до АМР и PPi, который диссоциирует с образованием двух Pi. Полное уравнение цикла мочевины выглядит так:
2NH4++ НСO3- + 3АТР4- +Н2O —> мочевина + 2ADP3-+ 4Pi2- + АМР2- + 2Н+
Однако в цикле мочевины также происходит последовательное превращение оксалоацетата до фумарата (через аспартат), а при регенерации оксалоацетата (рис. 18-12) в малатдегидрогеназной реакции образуется NADH. В процессе митохондриального дыхания за счет каждой молекулы NADH может образовываться до 2,5 молекул АТР (гл. 19), что значительно снижает полную энергетическую цену синтеза мочевины.
Генетические дефекты цикла мочевины могут нести угрозу для жизни
Люди с генетическими дефектами в любом ферменте, вовлеченном в образование мочевины, не могут потреблять богатую белками пищу. Излишек поглощенных аминокислот, превышающий минимальные ежедневные потребности организма для синтеза белков, подвергается дезаминированию в печени с образованием свободного аммиака, который не может превращаться в мочевину и поступает в кровоток, а аммиак, как мы показали, очень токсичен. Отсутствие хотя бы одного фермента цикла мочевины может приводить к гипераммонемии или накоплению одного из интермедиатов цикла мочевины в зависимости от того, какой фермент не функционирует. Зная, что большинство реакций цикла мочевины необратимо, неактивный фермент можно определить по тому, какой интермедиат присутствует в необычно высокой концентрации в крови и/или моче. Хотя для людей с дефектами в цикле мочевины распад аминокислот имеет серьезные последствия, отказ от белковой пищи будет неправильным способом лечения. Люди не способны синтезировать почти половину из 20 протеиногенных аминокислот, и эти незаменимые аминокислоты (табл. 18-1) должны поступать с пищей.
Таблица 18-1. Заменимые и незаменимые аминокислоты для человека и белой крысы
Заменимые |
Условно заменимые* |
Незаменимые |
Алананин |
Аргинин |
Гистидин |
Аспарагин |
Цистеин |
Изолейцин |
Аспартат |
Глутамин |
Лейцин |
Глутамат |
Глицин |
Лизин |
Серин |
Пролин Тирозин |
Метионин Фенилаланин Треонин Триптофан Валин |
* Требуются в небольших количествах в детском возрасте, растущим животным и/или иногда во время болезни.
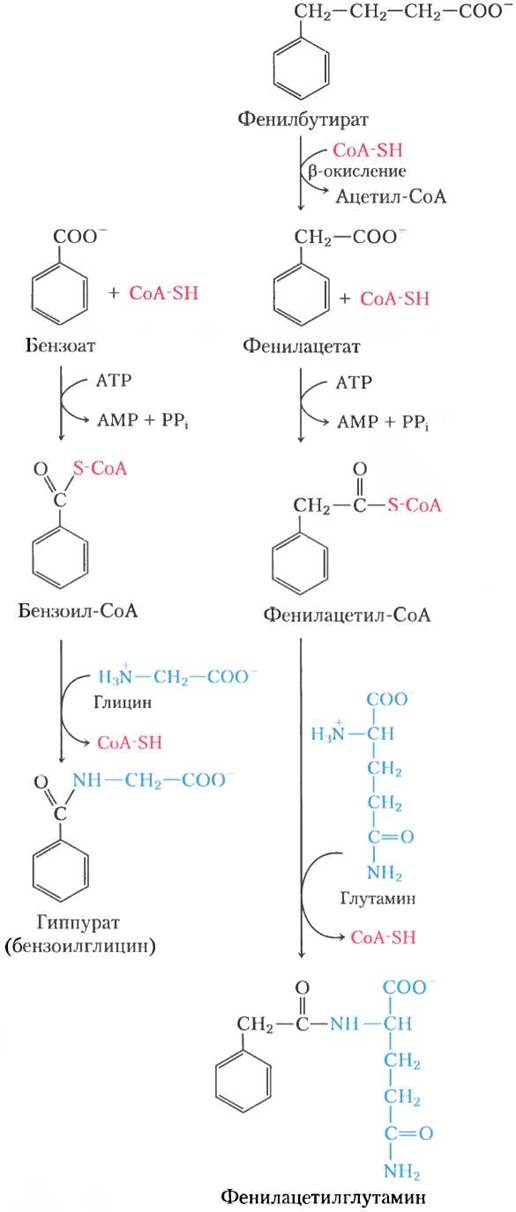
При дефектах в цикле мочевины возможны разные способы лечения. Осторожное применение ароматических кислот — бензоата или фенилбутирата — с пищей может уменьшить уровень аммиака в крови. Бензоат превращается в бензоил-СоА, который соединяется с глицином с образованием гиппурата (рис. 18-14, слева). В этой реакции глицин обязательно восполняется, и аммиак, таким образом, расходуется в глицин- синтетазной реакции. Фенилбутират превращается в фенилацетат при β-окислении. Фенил- ацетат затем превращается в фенилацетил-СоА, который соединяется с глутамином с образованием фенилацетилглутамина (рис. 18-14, справа). В итоге удаление глутамина включает его дальнейший синтез глутаминсинтетазой (см. уравнение 22-1) по реакции, в которой расходуется аммиак. И гиппурат, и фенилацетилглутамин — нетоксичные соединения, которые выводятся с мочой. Пути, показанные на рис. 18-14, составляют второстепенную часть нормального метаболизма, но они активируются при поглощении большого количества ароматических кислот.
Рис. 18-14. Лечение при дефектах ферментов цикла мочевины. Ароматические кислоты бензоат и фенилбутират употребляются вместе с пищей и соединяются с глицином и глутамином соответственно. Продукты этих реакций выводятся с мочой. Последующий синтез глицина и глутамина с целью пополнить пул этих интермедиатов удаляет аммоний из крови.
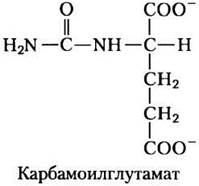
Другие методы лечения более специфичны к недостаточности конкретного фермента. Дефицит N-ацетилглутаматсинтетазы приводит к недостатку природного активатора карбамоилфосфатсинтетазы I (рис. 18-13). Это состояние можно компенсировать, принимая карбамоилглутамат, аналог N-ацетилглутамата, который эффективно активирует карбамоилфосфатсинтетазу I.
Соблюдение диеты с повышенным содержанием аргинина полезно при лечении дефицита орнитинтранскарбамоилазы, аргининсукцинатсинтетазы и аргининосукциназы. Большинство этих методов лечения должно сопровождаться строгим контролем пищевого рациона и незаменимых аминокислот. В редких случаях недостатка аргиназы субстрат этого фермента аргинин должен быть исключен из пищи. ■
Краткое содержание раздела 18.2 Выделение азота и цикл мочевины
■ Аммиак высокотоксичен для тканей животных. В цикле мочевины орнитин соединяется с аммиаком (в виде карбамоилфосфата) и образует цитруллин. Вторая аминогруппа переносится на цитруллин с аспартата, в итоге образуется аргинин — непосредственный предшественник мочевины. Аргиназа катализирует гидролиз аргинина до мочевины и орнитина; таким образом, орнитин возобновляется в каждом обороте цикла.
■ Цикл мочевины осуществляет цепь превращений от оксалоацетата до фумарата: и тот и другой — интермедиаты цикла лимонной кислоты. Таким образом, эти два цикла пересекаются.
■ Ферментативные активности в цикле мочевины регулируются на двух уровнях: на уровне синтеза ферментов и на уровне аллостерической регуляции фермента, который катализирует образование карбамоилфосфата.