ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 2. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ - 2014
ЧАСТЬ II. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ
13. ОСНОВЫ БИОЭНЕРГЕТИКИ. ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ
13.2. Химические основы биохимических реакций
Биологические процессы с передачей энергии, о которых мы говорим здесь, представляют собой определенные химические реакции. В клетке происходят не все типы реакций, с которыми обычно знакомятся в общем курсе органической химии. То, какие реакции протекают в биологических системах, а какие нет, определяется 1) их ролью в конкретной биологической системе и 2) их скоростями. Оба этих фактора имеют важное значение в формировании метаболических путей, о которых мы будем говорить далее. Значимая реакция — это та реакция, которая использует имеющийся в наличии субстрат и превращает его в нужный продукт. Однако даже эти значимые (потенциально) реакции не всегда могут протекать в клетке. Некоторые химические превращения настолько замедленны (т. е. имеют настолько высокие энергии активации), что не могут происходить в живых системах даже в присутствии мощных катализаторов — ферментов. Те реакции, которые действительно протекают в живых клетках, представляют собой возникший в процессе эволюции набор химических «инструментов», позволяющий обходить «невозможные» реакции. Для хорошего понимания биохимии клетки необходимо уметь распознавать те реакции, протекание которых возможно.
Несмотря на все указанные ограничения, количество метаболических превращений в обычной клетке огромно. Большинство клеток обладают способностью осуществлять тысячи специфических ферментативных реакций, например, превращать простое вещество, такое как глюкоза, в аминокислоты, нуклеотиды или липиды, извлекать энергию из веществ, поступающих с пищей, путем их окисления или проводить полимеризацию мономерных молекул с образованием макромолекул.
Чтобы изучить все эти реакции, необходим систематический подход. Химические реакции, происходящие в живых организмах, можно разделить на типы, и тогда не понадобится изучать каждую отдельную реакцию, чтобы понять «логику», заложенную в биохимических процессах. Множество реакций в живых клетках можно классифицировать, выделив пять типов: 1) реакции, идущие с образованием или разрывом связи углерод-углерод; 2) внутримолекулярные перегруппировки, изомеризация и элиминирование; 3) реакции с участием свободных радикалов; 4) реакции с переносом функциональных групп; 5) окислительно-восстановительные реакции. Далее мы подробнее обсудим различные типы реакций на конкретных примерах биохимических превращений. Заметьте, что реакции, относящие к разному типу, не исключают друг друга, например, реакция изомеризации может идти по свободно-радикальному механизму.
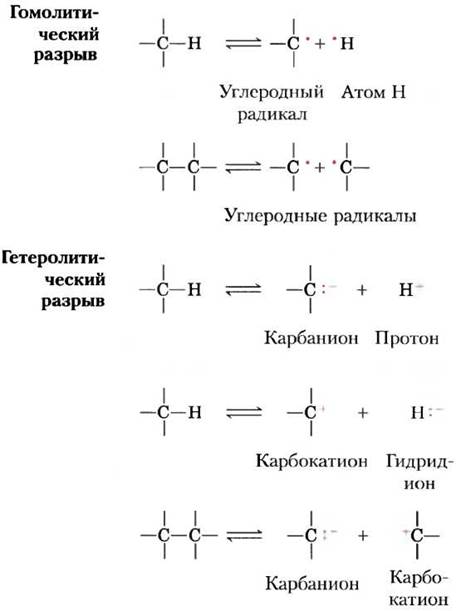
Однако прежде чем продолжить обсуждение типов реакций, нам следует вспомнить два главных химических принципа. Первый принцип заключается в том, что ковалентная химическая связь образуется в результате обобществления пары электронов, а разрыв этой связи может происходить двумя путями (рис. 13-1). При гемолитическом разрывекаждый атом, участвовавший в образовании связи, превращается в свободный радикал, несущий один неспаренный электрон. При гетеролитическом разрыве, который происходит гораздо чаще, оба электрона остаются связанными с одним из двух атомов. На рис. 13-1 изображены частицы, которые наиболее часто образуются при расщеплении связей С—С и С—Н. Карбанионы, карбокатионы и гидрид-ионы очень нестабильны, и, как мы видим далее, это свойство во многом и определяет химические свойства этих ионов.
![]()
Рис. 13-1. Два механизма разрыва связей С—С и С—Н. При гемолитическом разрыве связи каждый атом сохраняет за собой один электрон, что приводит к образованию углеродного радикала (углерод имеет неспаренный электрон) или незаряженного атомарного водорода. При гетеролитическом разрыве связи оба электрона остаются связанными с одним из атомов. При этом образуются карбанионы, карбокатионы, протоны или гидрид-ионы.
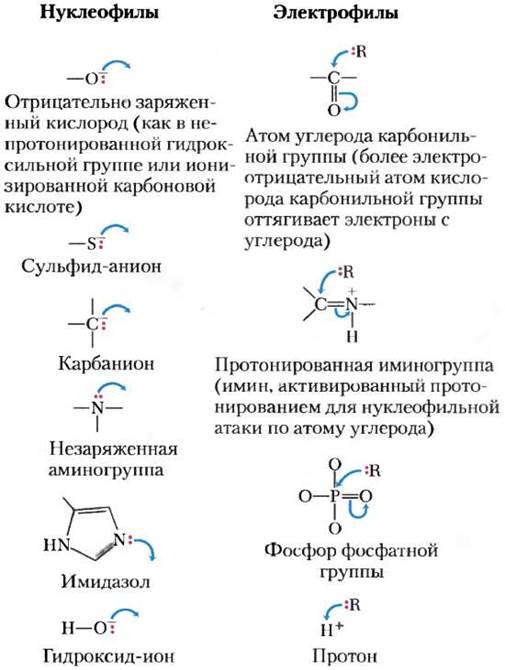
Второй принцип состоит в том, что многие биохимические реакции происходят при взаимодействии нуклеофилов (функциональных групп, которые богаты электронами и способны отдавать их другим атомам и группам атомов) и электрофилов (электронодефицитных групп, способных принимать электроны от других групп). Нуклеофилы, взаимодействуя с электрофилами, отдают им электроны. Часто встречающиеся в биологических системах нуклеофилы и электрофилы представлены на рис. 13-2. Обратите внимание, что атом углерода может выступать как в роли нуклеофила, так и в роли электрофила в зависимости от того, какие химические связи и функциональные группы его окружают.
Рис. 13-2. Наиболее распространенные нуклеофилы и электрофилы в биохимических реакциях. В схемах механизмов химических реакций, при которых происходит образование или разрыв ковалентных связей, электроны изображают точками, а изогнутые стрелки показывают направление перемещения электрона или пары электронов. Ковалентная связь образуется в результате обобществления пары электронов. Не участвующие в образовании химической связи электроны, если они важны для понимания механизма реакции, изображают парой точек (:). Изогнутые стрелки![]() показывают направление смещения пары электронов. Перемещение одного электрона (как в свободнорадикальных реакциях) изображают стрелкой, похожей на рыболовный крючок
показывают направление смещения пары электронов. Перемещение одного электрона (как в свободнорадикальных реакциях) изображают стрелкой, похожей на рыболовный крючок ![]() . Во многих процессах участвует неподеленная пара электронов.
. Во многих процессах участвует неподеленная пара электронов.
Реакции, протекающие с образованием или разрывом связи углерод-углерод. Гетеролитический разрыв связи С—С приводит к образованию карбаниона и карбокатиона (рис. 13-1). Образование же связи С—С происходит в результате соединения нуклеофильного карбаниона и электрофильного карбокатиона. Карбанионы и карбокатионы обычно настолько нестабильны, что их образование в качестве промежуточных продуктов химической реакции, даже при участии ферментов, энергетически очень невыгодно. В условиях клетки эти реакции просто не могут протекать, если только на «помощь» не приходит какая-либо функциональная группа, содержащая электроотрицательные атомы (О или N), способные изменить электронное состояние соседних атомов углерода и стабилизировать его таким образом, чтобы облегчить образование карбанионов и карбокатионов.
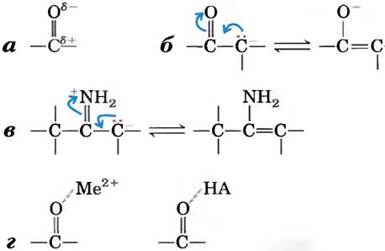
Карбонильные группы играют очень важную роль в химических реакциях, задействованных в различных метаболических путях. Атом углерода карбонильной группы несет частичный положительный заряд, что связано с электроноакцепторными свойствами кислорода карбонильной группы, поэтому такой атом углерода выступает в роли электрофила (рис. 13-3, а). Таким образом, карбонильная группа может облегчать образование карбаниона на соседнем атоме углерода путем делокализации отрицательного заряда (рис. 13-3, б). Иминогруппа С = +NН2 может выполнять аналогичную функцию (рис. 13-3, в). Способность карбонильных и иминогрупп делокализовать электроны может быть дополнительно усилена общим кислотным катализатором или ионом металла, таким как Mg2+ (рис. 13-3, г; см. также рис. 6-21 и 6-23).
Рис. 13-3. Химические свойства карбонильной группы. а — атом углерода карбонильной группы обладает электрофильными свойствами, что связано со способностью электроноакцепторного атома кислорода оттягивать на себя электроны. В результате возникает гибридная резонансная структура, в которой атом углерода несет частичный положительный заряд. б — делокализация электронов на карбонильной группе способствует стабилизации карбаниона на соседнем атоме углерода и облегчает его образование, в — имины выполняют ту же функцию, что и карбонильная группа, облегчая делокализацию электронов. г — карбонильная группа не всегда действует в одиночку; ее способность оттягивать на себя электроны часто увеличивается благодаря присутствию иона металла (Ме2+, например, Мg2+) или кислоты (НА).
Карбонильные группы играют особенно важную роль в реакциях трех основных типов, происходящих с образованием или разрывом связей С—С (рис. 13-4), а именно при альдольной конденсации, конденсации Кляйзена и в реакциях декарбоксилирования. В этих реакциях образующийся карбанион стабилизирован карбонильной группой, причем достаточно часто другой карбонил выступает в роли электрофила, с которым реагирует нуклеофил — карбанион,
Рис. 13-4. Примеры реакций с разрывом или образованием связи С—С в биологических системах. В альдольной конденсации и конденсации Кляйзена карбанион выполняет функцию нуклеофила, а углерод карбонильной группы выступает в роли электрофила. В обоих случаях карбанион стабилизирован другой карбонильной группой при соседнем атоме углерода. В реакции декарбоксилирования в результате отщепления СO2 (этот атом углерода выделен синим) образуется карбанион. Эта реакция не могла бы происходить со сколько- нибудь заметной скоростью без стабилизирующего эффекта карбонильной группы, расположенной рядом с карбанионом. Каждый раз, когда изображают карбанион, подразумеваются стабилизирующие резонансные структуры с участием соседней карбонильной группы, как показано на рис. 13-3, б. В стабилизации карбаниона вместо карбонильной группы может принимать участие иминогруппа (рис. 13-3, б) или другая электроноакцепторная группа, включая некоторые кофакторы ферментов, например пиридоксаль.
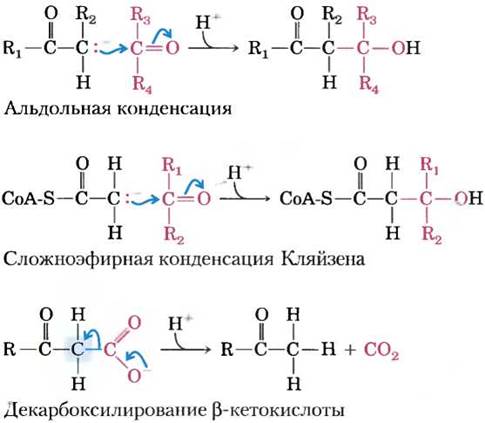
Альдольная конденсация достаточно часто используется для образования связи С—С; при гликолизе альдолаза катализирует обратную реакцию превращения шестиуглеродного соединения в два трехуглеродных соединения (см. рис. 14-5). При конденсации Кляйзена карбанион стабилизируется карбонильной группой соседнего тиоэфира; пример — синтез цитрата в цикле лимонной кислоты (см. рис. 16-9). При декарбоксилировании также достаточно часто образуется карбанион, стабилизированный карбонильной группой; пример — катализируемая ацетоацетатдекарбоксилазой реакция образования кетоновых тел при катаболизме жирных кислот (см. рис. 17-18). С введением карбонильных групп в специфическое окружение, позволяющее осуществлять образование или разрыв связей углерод-углерод, могут быть связаны целые метаболические пути. В некоторых случаях электроноакцепторную функцию карбонильной группы выполняет иминогруппа или специализированный кофактор, например, пиридоксальфосфат.
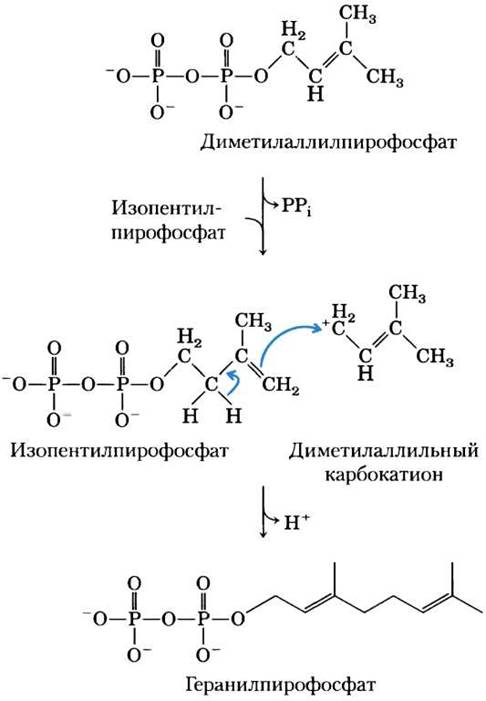
Карбокатион как промежуточное соединение в некоторых реакциях образования или разрыва связи углерод-углерод возникает в результате удаления хорошей уходящей группы, такой как пирофосфат (см. ниже раздел, посвященный реакциям переноса групп). В качестве примера можно привести реакцию, катализируемую пренилтрансферазой (рис. 13-5), происходящую на начальных стадиях биосинтеза холестерина.
Рис. 13-5. Возникновение карбокатиона при образовании связи углерод-углерод. На одной из ранних стадий биосинтеза холестерина фермент пренилтрансфераза катализирует конденсацию изопентенилпирофосфата с диметилаллилпирофосфатом с образованием геранилпирофосфата (см. рис. 21-36). Реакция начинается с отщепления пирофосфатной группы из диметилаллилпиро-фосфата, в результате чего возникает карбокатион, стабилизируемый за счет резонанса с соседней связью С=С.
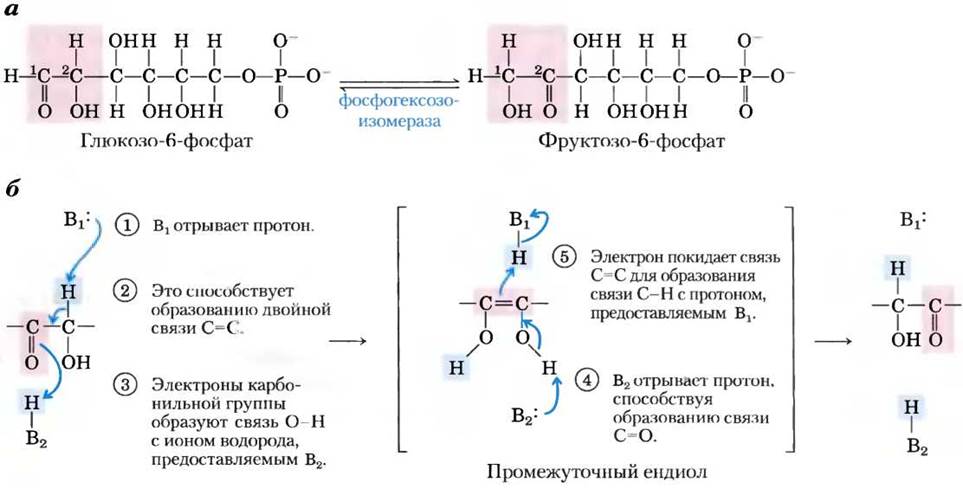
Внутримолекулярные перегруппировки, изомеризация и элиминирование. Другой распространенный тип клеточных реакций — внутримолекулярные перегруппировки, при которых перераспределение электронов приводит к структурным изменениям, не затрагивая общего окислительного состояния. Например, различные функциональные группы могут претерпевать окислительно-восстановительные превращения, но вся молекула в целом не меняет свое окислительное состояние. Группы, находящиеся при атомах углерода, соединенных двойной связью, могут претерпевать цис-транс-переходы, что может сопровождаться переносом самой двойной связи. Пример изомеризации в результате окислительно-восстановительной реакции — образование фруктозо-6-фосфата из глюкозо-6- фосфата при гликолизе (рис. 13-6; эта реакция подробно обсуждается в гл. 14): С-1 восстанавливается (альдегид превращается в спирт), а С-2 окисляется (спирт превращается в кетон). На рис. 13-6, 6 показан перенос электронов при этой изомеризации. Цис-транс-превращения проиллюстрированы на примере реакции, катализируемой пролил-цис-транс-изомеразой, участвующей в фолдинге некоторых белков (см. рис. 4-7, б). Простой перенос связи С=С происходит при метаболизме олеиновой кислоты, весьма распространенной жирной кислоты (см. рис. 17-9). Интересные примеры реакций с переносом двойной связи можно наблюдать при биосинтезе холестерина (см. рис. 21-33).
Рис. 13-6. Реакции изомеризации и элиминирования, а — превращение глюкозо-6- фосфата в фруктозо-6-фосфат, катализируемое фосфогексозоизомеразой. б — реакция протекает через образование ендиола. Изогнутыми синими стрелками показано перемещение связывающих электронных пар. Розовым цветом указан ход окисления слева направо. В1 и В2 — ионизируемые группы фермента, они в ходе реакции способны принимать и отдавать протоны (т. е. выступают в роли кислот или оснований). Розовым цветом выделены нуклеофильные группы, синим — электрофильные.
Пример реакции элиминирования, происходящей без изменения общего окислительного состояния молекулы, — отщепление воды от спирта с образованием двойной связи С=С.
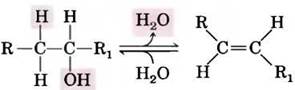
Похожие реакции элиминирования происходят в аминах.
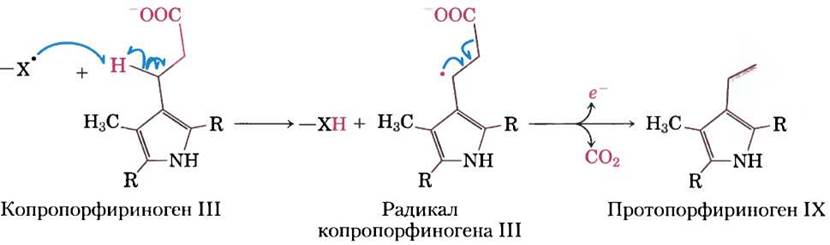
Реакции с участием свободных радикалов. Ранее считалось, что гемолитический разрыв ковалентной связи с образованием свободных радикалов происходит достаточно редко, однако это было обнаружено в очень разных биохимических процессах. Среди них — изомеризация с участием аденозилкобаламина (витамина В12) или S-аденозилметионина, инициируемая 5'- дезоксиаденозильным радикалом (см. реакцию, катализируемую метилмалонил-СоА-мутазой, в доп. 17-2), некоторые инициируемые радикалами реакции декарбоксилирования (рис! 13-7), некоторые реакции редуктаз, например, реакция, катализируемая рибонуклеотидредуктазой (см. рис. 22-41), а также некоторые перегруппировки, например, реакция, катализируемая ДНК- фотолиазой (см. рис. 25-27).
Рис. 13-7. Реакции декарбоксилирования, инициируемые свободными радикалами. Биосинтез гема (см. рис. 22-24) в клетках Escherichia coli включает стадию декарбоксилирования, при которой пропионильные боковые группы копропорфириногена III превращаются в винильные группы протопорфириногена IX. При росте бактерии в анаэробных условиях фермент кислород-независимая копропорфириноген-III-оксидаза, называемая также белком HemN, стимулирует декарбоксилирование по изображенному здесь свободнорадикальному механизму. Акцептор высвобождающихся электронов неизвестен. Для простоты показаны только важные для описания механизма реакции участки молекул, а полностью структуры представлены на рис. 22-24. При росте Е. coli в присутствии кислорода эта реакция заменяется окислительным декарбоксилированием, катализируемым другим ферментом.
Реакции с переносом функциональных групп.
В живых организмах часто происходят реакции с переносом ацильной, гликозильной или фосфорильной группы от одного нуклеофила к другому. Перенос ацильной группы обычно сопровождается присоединением нуклеофила к карбонильному углероду ацильной группы с образованием промежуточного тетраэдрического интермедиата:
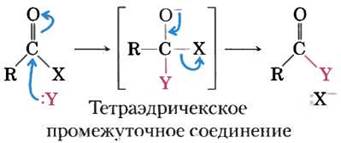
Примером может служить реакция, катализируемая химотрипсином (см. рис. 6-21). В принципе, замещение может происходить как по механизму SN1, так и по механизму SN2, как показано на рис. 6-25 для лизоцима.
Особую роль в метаболизме играют рекакации с переносом фосфорильной группы; эти реакции рассматриваются в разд. 13.3. Важную роль при метаболизме играют реакции присоединения хороших уходящих групп к промежуточным продуктам метаболизма, что служит для их «активации» в дальнейших превращениях. К хорошим уходящим группам в реакциях нуклеофильного замещения относятся неорганический ортофосфат (анионы фосфорной кислоты Н3РO4 — смесь Н2РO4- и НРO2-4, которую обычно сокращенно обозначают как Pi) и неорганический пирофосфат (Р2О74-, сокращенно обозначаемый как PPi); эфиры и ангидриды фосфорной кислоты достаточно активированы для дальнейшей реакции. Кроме того, нуклеофильному замещению способствует присоединение фосфорильной группы к такой плохой уходящей группе, как гидроксильная группа. Нуклеофильное замещение, при котором фосфорильная группа РО32- выступает в качестве уходящей группы, происходит в сотнях метаболических реакций.
Фосфор может образовывать пять ковалентных связей. Неорганический ортофосфат Рi (рис. 13-8, а) обычно изображают с тремя простыми (одинарными) связями Р—О и одной двойной связью Р=O; это удобно, но далеко не точно. На самом деле в ортофосфате Pi все четыре связи фосфор-кислород эквивалентны и имеют в какой-то степени характер двойной связи, так что структура этого аниона тетраэдрическая (рис. 13-8, б). Поскольку у кислорода более выражены электроноакцепторные свойства, чем у фосфора, электронная пара не в равной степени принадлежит обоим атомам: расположенный в центре структуры атом фосфора несет частичный положительный заряд и поэтому может выступать в качестве электрофила. Во множестве реакций метаболизма фосфорильная группа РО32- переносится от молекулы АТР на молекулу спирта, в результате чего образуется фосфат (эфир) (рис. 13-8, в), или на карбоновую кислоту с образованием смешанного ангидрида. При атаке нуклеофила на электрофильный атом фосфора молекула АТР превращается в достаточно стабильный промежуточный продукт, в котором фосфор пятивалентен (рис. 13-8, г). Перенос фосфорильной группы завершается отщеплением уходящей группы (ADP). Большое семейство ферментов, катализирующих перенос фосфорильной группы от молекулы АТР, называют киназами (от греч. kinein — двигать). Например, гексокиназа «передвигает» фосфорильную группу от АТР на молекулу глюкозы.
Рис. 13-8. Альтернативные варианты изображения структуры неорганического ортофосфата, а — три атома кислорода связаны с атомом фосфора одинарными связями, а четвертый присоединен двойной связью; можно построить четыре различные резонансные структуры. б — более точные резонансные структуры, если все четыре связи кислород-фосфор имеют природу отчасти двойной связи; при этом гибридные орбитали образуют тетраэдр с атомом фосфора в центре, в, г — при атаке нуклеофила Z (здесь ОН-группа при С-6 в глюкозе) на АТР происходит замещение с образованием ADP (здесь W). В этой SN2-реакции образуется промежуточное соединение с пятивалентным фосфором Р.
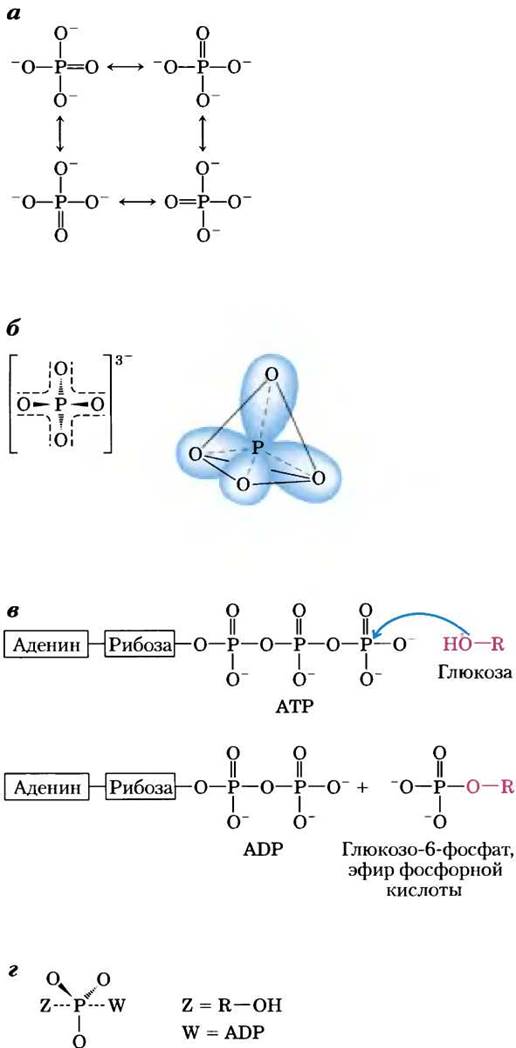
Однако не только фосфорильные группы активируют молекулы для последующей реакции. Тиоспирты (тиолы), в которых атом кислорода спиртовой группы заменен на серу, также являются хорошими уходящими группами. Тиолы активируют карбоновые кислоты путем образования тиоэфиров. В последующих главах мы рассмотрим несколько реакций, включая реакции синтеза липидов, катализируемые синтетазами жирных кислот (см. рис. 21-2), при которых нуклеофильное замещение по карбонильному углероду тиоэфира приводит к переносу ацильной группы на другой остаток.
Окислительно-восстановительные реакции.
В биомолекулах углерод может существовать в пяти окислительных состояниях в зависимости от тех элементов, с которыми он делит электроны (рис. 13-9), а переходы между этими состояниями играют важнейшую роль в метаболизме (окислительно-восстановительным реакциям посвящен разд. 13.4). Во многих окислительных процессах в биологии соединения теряют два электрона и два иона водорода (упрощая, будем говорить два водорода). Такие реакции обычно называют реакциями дегидрирования, а катализирующие их ферменты — дегидрогеназами (рис. 13-10). В некоторых, хотя и не во всех, биохимических реакциях окисления атом углерода связывается с атомом кислорода ковалентной связью. Ферменты, катализирующие такие процессы, называют оксидазами, а если при этом атом кислорода берется непосредственно из молекулярного кислорода (O2), то такие ферменты называют оксигеназами.
Рис. 13-9. Окислительные состояния углерода в биомолекулах. Ряд органических соединений, каждое из которых можно получить путем окисления атома углерода (выделен красным цветом) в предшествующем соединении. Диоксид углерода — наиболее окисленная форма углерода, встречающаяся в живых системах.
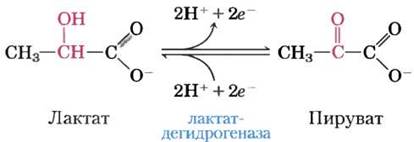
Рис. 13-10. Окислительно-восстановительная реакция. Представлена реакция окисления лактата до пирувата. Происходит дегидрирование — удаление двух электронов и двух ионов водорода (что эквивалентно удалению двух атомов водорода) от атома С-2 лактата с образованием пирувата (кетона). В клетках эту реакцию катализирует лактатдегидрогеназа, а электроны переносятся на кофактор никотинамидадениндинуклеотид (NAD). Реакция обратима; пируват может восстанавливаться электронами от кофактора.
Любой процесс окисления обязательно сопровождается восстановлением, при котором акцептор электронов принимает электроны, удаленные при окислении. Реакции окисления обычно происходят с выделением энергии (вспомните костер: вещества, из которых состоит древесина, окисляются молекулярным кислородом из воздуха). Большинство живых клеток получают необходимую им энергию путем окисления «топливных» молекул, таких как углеводы или жиры (фотосинтезирующие организмы используют солнечную энергию, поглощая свет). Описанные в гл. 14-19 катаболические процессы (т. е. процессы, сопровождаемые выделением энергии) представляют собой последовательности окислительных реакций, где перенос электронов от топливных молекул к кислороду осуществляется с помощью переносчиков электронов. Высокое сродство молекулярного кислорода к электронам делает весь процесс переноса электронов экзергоническим и обеспечивает необходимую энергию для синтеза АТР, что является основной задачей реакций катаболизма.
Многие реакции всех пяти рассмотренных здесь типов происходят в присутствии кофакторов в форме коферментов или ионов металлов (примеры — витамин В12, S-аденозилметионин, фолат, никотинамид, железо). Кофакторы связываются с ферментами (обратимо или же практически необратимо), благодаря чему и осуществляется катализ определенных химических превращений (см. разд. 6.1, т. 1). Большинство кофакторов участвуют в определенной достаточно узкой группе родственных реакций. В последующих главах мы обсудим наиболее важные кофакторы. Если положить в основу кофакторы, изучение биохимических процессов можно организовать совсем по-другому, поскольку все реакции с участием конкретного кофактора взаимосвязаны.
Биохимические и химические уравнения вовсе не одно и то же
Биохимики записывают реакции метаболизма с помощью упрощенных схем, что особенно заметно, например, в случае реакций с участием АТР. Фосфорилированные соединения могут находиться в нескольких состояниях ионизации и, как мы обсуждали выше, связывать при этом ионы магния. Например, при pH 7,0 и концентрации Mg2+ 2 мМ АТР существует в виде АТР4-, НАТР3-, Н2АТР2-, MgHATP- и Mg2ATP. Однако рассуждая о биологической роли АТР, мы далеко не всегда интересуемся подобными деталями и при этом не рассматриваем АТР как некую сумму веществ. И поэтому реакцию гидролиза АТР биохимик записывает в виде следующей схемы:
АТР + Н2O —> ADP + Pi
где на самом деле АТР, ADP и Pi — некоторая сумма (смесь) веществ. В то же время константа равновесия K'eq= [ADP] [Рi]/[АТР] зависит от pH и от концентрации свободных ионов Mg2+. Обратите внимание, что в биохимическом уравнении (в приведенной схеме) не фигурируют ионы водорода и Mg2+, поскольку их концентрации постоянны (не меняются при протекании биохимической реакции). Таким образом, в биохимическом уравнении нет необходимости уравнивать число атомов Н и Mg, а также заряды, а вот в химическом уравнении обязательно надо уравнивать число всех элементов, участвующих в реакции (в данном примере С, N, О и Р).
Для сравнения мы может записать химическое уравнение, в котором уравниваются все элементы и заряды. Например, в отсутствие магния гидролиз АТР при pH >8,5 можно записать следующим образом:
АТР4- + Н2О —> ADP3- + HPO2-4 + Н+
Соответствующая константа равновесия (К'eq - [ADP3-] [НРO2-4][Н+]/[АТР4-]) зависит только от температуры, давления и ионной силы раствора.
В биохимии используются оба способа записи уравнений реакций метаболизма. Химическая форма записи необходима в тех случаях, когда мы хотим учесть все атомы и все заряды, что бывает нужно при описании механизма химической реакции. Биохимическая форма записи используется для определения направления самопроизвольного протекания реакции при заданных значениях pH и [Mg2+], а также для расчета константы равновесия.
В данной книге мы в основном используем биохимическую форму записи реакций, за исключением тех случаев, когда речь идет о механизме реакции; значения ∆G'° и К'eqсоответствуют pH 7 и концентрации ионов Mg2+ 1 мМ.
Краткое содержание раздела 13.2 Химические основы биохимических реакций
■ Множество химических реакций, которые происходят в живых организмах, можно разделить на пять основных типов.
■ Карбонильная группа играет важную роль в реакциях образования и разрыва связи С—С. Часто в качестве промежуточного соединения образуется карбанион, стабилизированный соседними карбонильными группами или (реже) иминогруппами или кофакторами.
■ Перераспределение электронов может приводить к внутримолекулярным перегруппировкам, изомеризации и элиминированию (отщеплению) функциональных групп. К таким реакциям относятся внутримолекулярные окислительно-восстановительные реакции, цис-транс-перегруппировки при двойной связи и перенос двойной связи.
■ Гомолитический разрыв ковалентной связи с образованием свободных радикалов происходит в некоторых реакциях метаболизма, таких как изомеризация, декарбоксилирование и реакции, катализируемые редуктазами.
■ Особенно важную роль в клетке играют реакции с переносом фосфорильной группы; это способ активации молекул, которые без подобной активации не могли бы претерпевать дальнейших химических превращений.
■ Окислительно-восстановительные реакции сопровождаются потерей и приобретением электронов: одно вещество получает электроны и восстанавливается, а другое вещество отдает электроны и при этом окисляется. Реакции окисления обычно протекают с высвобождением энергии и играют важную роль в процессах катаболизма.