ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 2. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ - 2014
ЧАСТЬ II. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ
19. ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ И ФОТОФОСФОРИЛИРОВАНИЕ
19.2. Синтез АТР
Важно рассмотреть два аспекта механизма использования энергии градиента Н+, который возникает из-за переноса электронов при синтезе АТР в митохондриях. Во-первых, это энергетический баланс процесса окислительного фосфорилирования в митохондриях. Как показано в примере 13-2, для образования 1 моль АТР требуется 50 кДж (с. 31); энергия же, высвобождаемая при переносе электронов в дыхательной цепи и запасаемая как трансмембранный электрохимический потенциал, составляет - 200 кДж на 1 моль перенесенных электронов — и вот эта энергия может быть направлена на синтез АТР. Следовательно, энергетика процесса митохондриального окислительного фосфорилирования не укладывается в законы термодинамики. Во-вторых, интересен молекулярный механизм сопряжения транспорта протонов с синтезом АТР в митохондриях — наиболее обоснованный ответ дает хемиосмотическая теория Митчелла.
Питер Митчелл, 1920-1992

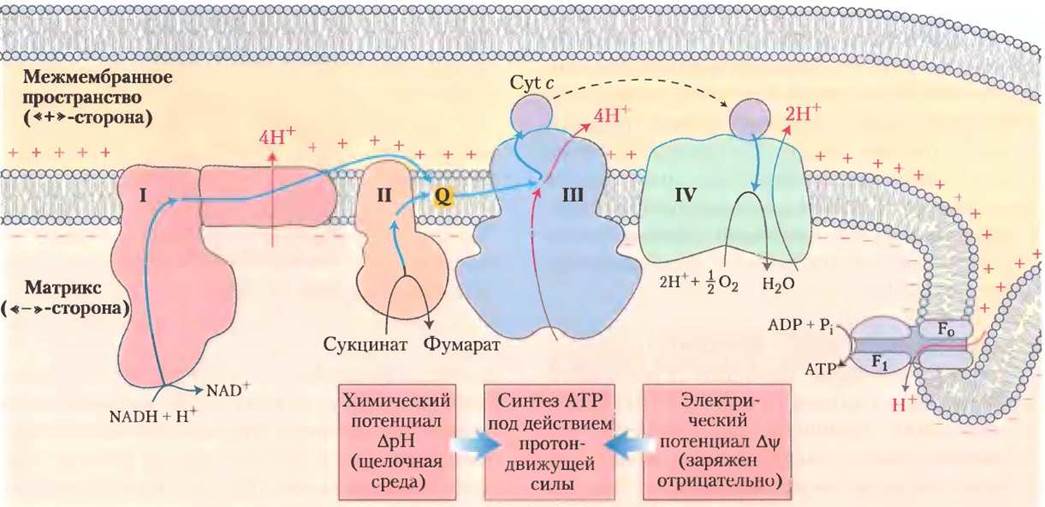
Согласно хемиосмотической теории Митчелла (рис. 19-19), за счет энергии переноса электронов между двумя сторонами внутренней митохондриальной мембраны создается разность концентраций ионов Н+ и трансмембранный электрический потенциал. Именно такой электрохимический градиент, так называемая протон- движущая сила, служит источником энергии для синтеза АТР, когда ионы Н+ спонтанно возвращаются по градиенту концентрации из цитозоля в матрикс, проходя через специальные поры для ионов Н+в ATP-синтазе. Чтобы подчеркнуть важную роль протон-движущей силы, уравнение синтеза АТР в митохондриях иногда записывается в следующем виде:
ADP + Рi + nH+«+» —> АТР + Н2O + nH+«-» (19-10)
Рис. 19-19. Хемиосмотическая теория. Согласно хемиосмотичекой теории, электроны от NADH и других окисляемых субстратов проходят через цепь переносчиков электронов, асимметрично расположенных во внутренней мембране митохондрий. Перенос электронов сопровождается переносом (откачиванием) через мембрану протонов из матрикса в межмембранное пространство, что приводит к возникновению химического градиента (∆рН) и электрического градиента (∆Ψ). Внутренняя мембрана непроницаема для протонов. Протоны могут вернуться в матрикс только через специальные каналы в белковом комплексе F0. Переход ионов Н+ из зоны с более высокой концентрацией в зону с более низкой концентрацией сопровождается высвобождением свободной энергии, за счет которой происходит синтез АТР, катализируемый связанными между собой белковыми комплексами F0 и F1.
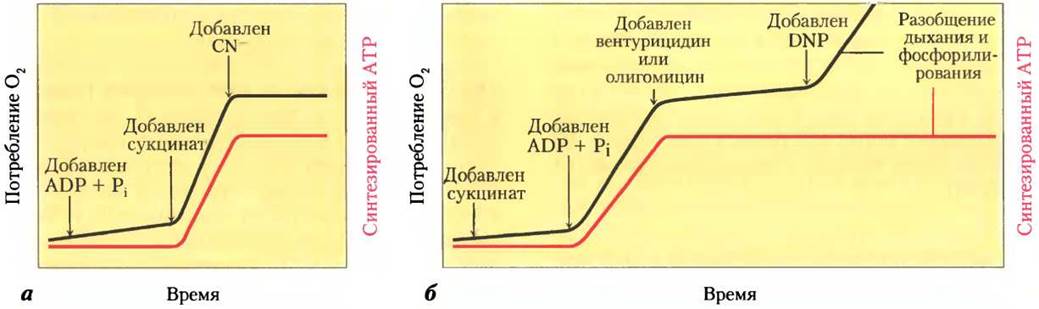
Ферментативные реакции, в которых одновременно протекают химические превращения и транспорт частиц, Митчелл назвал хемиосмосом. Схема экспериментального изучения сопряжения дыхания и фосфорилирования, т. е. «хемиосмоса», представлена на рис. 19-20. При добавлении суспензии митохондрий в буферном растворе к смеси ADP, Рi и окисляемого субстрата, например, сукцината, наблюдается (1) окисление сукцината до фумарата, (2) поглощение кислорода и (3) синтез АТР. Поглощение кислорода и синтез АТР зависят от наличия окисляемого субстрата (в данном случае, сукцината), а также от ADP и Pi.
Поскольку энергия, высвобождаемая при окислении субстрата, направляется на синтез АТР, то, как и следовало ожидать, ингибиторы переноса электронов к O2, такие как цианид-ион, монооксид углерода и антимицин А, должны блокировать синтез АТР (рис. 19-20, а). Совсем неожиданно то, что в интактных митохондриях при ингибировании синтеза АТР останавливается и перенос электронов. Такая взаимосвязь наблюдается, если к смеси изолированных митохондрий и окисляемых субстратов, не содержащих АТР, добавляют кислород (рис. 19-20, б). В этом случае не происходит ни синтеза АТР, ни переноса электронов к молекулярному кислороду. Сопряжение процессов окисления и фосфорилирования можно продемонстрировать на смесях, к которым добавлен олигомицин или вентурицидин — токсичные вещества (антибиотики), присоединяющиеся к активному центру ATP-синтазы в митохондриях. Эти два антибиотика — мощные ингибиторы как синтеза АТР, так и переноса электронов по цепи переносчиков к молекулярному кислороду (рис. 19-18, б). Олигомицин непосредственно не взаимодействует с переносчиками электронов, он присоединяется к ATP-синтазе. То, что при этом блокируются процессы окисления и фосфорилирования, подтверждает взаимосвязь этих процессов — они не могут протекать изолированно друг от друга.
Рис. 19-20. Изучение сопряжения переноса электронов и синтеза АТР в митохондриях. Экспериментальное определение точек сопряжения дыхания и синтеза АТР проводится в суспензии митохондрий в буферном растворе. Поглощение кислорода (черная линия) контролируется кислородным электродом. Через определенные интервалы времени берутся пробы раствора для определения содержания АТР (красная линия), а — если к раствору суспензии митохондрий добавляют только ADP и неорганический фосфат, дыхание не усиливается и АТР практически не синтезируется. При добавлении сукцината резко интенсифицируются процессы дыхания и синтеза АТР. Добавление цианида (CN-), ингибирующего перенос электронов между цитохромоксидазой и О2, блокирует процесс дыхания и синтеза АТР. б — в смеси митохондрий и сукцината дыхание и синтез АТР возникают только при добавлении ADP и Рi. При добавлении к такой смеси вентурицидина или олигомицина, ингибирующих ATP-синтазу, процессы дыхания и синтеза АТР прекращаются. В присутствии разобщающего агента 2,4-динитрофенола (DNP) митохондриальное дыхание продолжается, а синтез АТР прекращается.
Хемиосмотическая теория успешно объясняет зависимость переноса электронов от синтеза АТР в митохондриях. Если блокируется, например, олигомицином перенос электронов в митохондриальный матрикс через протонные каналы ATP-синтазы, т. е. закрывается путь для возвращения протонов в матрикс, то продолжающееся за счет энергии переноса электронов «выталкивание» протонов значительно увеличивает градиент концентрации протонов на двух сторонах внутренней мембраны. При этом протон-движущая сила будет возрастать до тех пор, пока свободная энергия, необходимая для выкачивания протонов из матрикса против градиента концентрации, не станет равной или больше энергии, высвобождающейся при переносе электронов от NADH к О2. В этот момент перенос электронов прекращается, свободная энергия всего процесса переноса электронов, сопряженного с откачиванием протонов, становится равной нулю — система приходит в состояние равновесия.
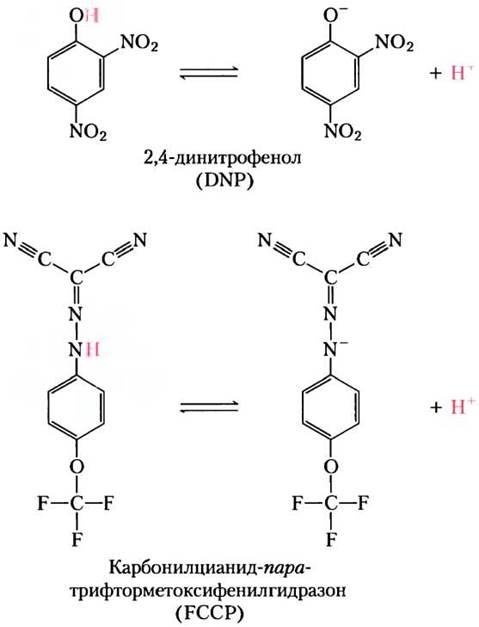
При определенных условиях или воздействии некоторых веществ может произойти разобщение переноса электронов и синтеза АТР. Например, если целостность интактных митохондрий нарушается в результате обработки детергентом или физического воздействия, в оставшихся фрагментах мембраны хотя и продолжается перенос электронов от сукцината или NADH к кислороду, но способность к синтезу АТР теряется, т. е. необходимые взаимосвязи между двумя этими процессами нарушаются. Некоторые химические соединения разобщают процессы дыхания и фосфорилирования, не нарушая целостности митохондрий. Разобщающими химическими агентами являются, например, 2,4-динитрофенол (DNP) и карбонилцианид- пара-трифторметоксифенилгидразон (FCCP) (см. табл. 9-4 и рис. 19-21). Эти соединения представляют собой слабые кислоты с гидрофобными свойствами. В протонированной форме они легко проходят через внутреннюю мембрану в матрикс, перенося туда протон, в результате чего протонный градиент уменьшается и прекращается синтез АТР. Ионофоры, например, валиомицин (см. рис. 11-45), способны связывать неорганические ионы и переносить их в матрикс, минуя протонные каналы ATP-синтазы, в результате чего исчезает электрическая составляющая электрохимического потенциала, и синтез АТР прекращается.
Рис. 19-21. Два химических разобщителя процесса окислительного фосфорилирования. DNP и FCCP легко теряют протон, переходя в ионизированную форму, и обладают выраженными гидрофобными свойствами. В протонированной форме они свободно диффундируют через внутреннюю мембрану в матрикс, перенося туда протон, в результате чего исчезает протонный градиент и прекращается синтез АТР. Аналогичным образом DNP и FCCP разобщают процессы фотофосфорилирования (см. рис. 19-63).
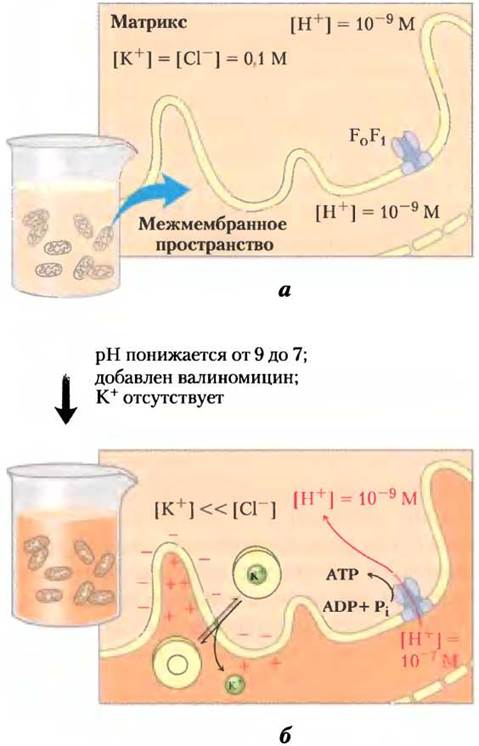
Согласно хемиосмотической теории, в митохондриях при синтезе АТР перенос электронов выполняет очень простую функцию, обеспечивая откачивание ионов Н+ из матрикса в межмембранное пространство с тем, чтобы на сторонах внутренней мембраны возникал электрический потенциал — «протон-движущая сила». В свете этой теории логично предположить, что искусственно созданный протонный градиент может выполнять функцию переносимых по дыхательной цепи электронов. Это предположение получило подтверждение в следующем эксперименте (рис. 19-22). В митохондриях, обработанных так, что по обе стороны внутренней мембраны была создана разность концентраций протонов, т. е. разность электрических зарядов, происходил синтез АТР даже в отсутствие окисляемого субстрата, т. е. только за счет искусственно созданной протон-движущей силы.
Рис. 19-22. Доказательство роли протонного градиента в синтезе АТР. Искусственно созданный электрохимический градиент в митохондриях в отсутствие окисляемого субстрата может поставлять энергию для синтеза АТР. а — Изолированные митохондрии выдерживают в буферном растворе (pH 9), содержащем 0,1 М КСl. В результате медленного просачивания в митохондрии буферного раствора и КСl в митохондриальном матриксе устанавливается равновесие с окружающей средой. Должны отсутствовать вещества, способные окисляться. б — митохондрии отделяют от буферного раствора с pH 9 и помещают в буферный раствор с pH 7, содержащем вместо КСl валиномицин. Замена буферного раствора позволяет создать на сторонах внутренней митохондриальной мембраны градиент pH. Валиномицин переносит ионы К+ через мембрану по градиенту концентрации, создавая электрический заряд на внутренней митохондриальной мембране (матрикс заряжается отрицательно). В результате сумма химического потенциала, создаваемого градиентом pH, и электрического потенциала, возникшего из-за разности зарядов на сторонах внутренней мембраны, дает протон-движущую силу, достаточную для поддержания синтеза АТР в отсутствие окисляемого субстрата.
Фермент ATP-синтаза состоит из двух главных компонентов — F1 и F0
Митохондриальная ATP-синтаза (комплекс V) является АТРазой F-типа (см. рис. 11-39, т. 1). Строение и механизм действия АТР-синтазы в митохондриях такие же, как в хлоропластах и аэробных бактериях. Этот большой внутримембранный ферментный комплекс катализирует синтез АТР из ADP и фосфата (Рi) в ходе перемещения протонов через мембрану с ее положительно заряженной стороны на отрицательно заряженную (см. уравнение 19-10). АТР-синтаза состоит из двух главных компонентов — F1 и F0. F1— периферический мембранный белок, F0— интегральный белок, пронизывающий митохондриальную мембрану насквозь (индекс «о» указывает на способность комплекса связывать антибиотик олигомицин). Белковый комплекс F1— исключительно важный фактор окислительного фосфорилирования. Он был впервые выделен в очищенном виде группой ученых во главе с Эфраимом Рэкером в начале 1960-х гг., что положило начало плодотворному изучению структуры и функций мембран.
Эфраим Рэкер, 1913-1991

Из внутренней митохондриальной мембраны удалось выделить маленькие мембранные пузырьки, способные осуществлять перенос электронов и синтез АТР. Если затем из этих мембранных пузырьков осторожно экстрагировать комплекс F1, то оказывается, что дыхательные цепи в этих пузырьках ненарушены, так как в них содержится F0-компонент АТР-синтазы, благодаря которому сохраняется способность к переносу электронов от NADH на молекулярный кислород. Однако пузырьки, лишенные F1-компонента, не способны синтезировать АТР, ведь в компартментах митохондрии, разделенных внутренней мембраной, не создается протонного градиента. Происходит это потому, что в отсутствие компонента F1 ионы Н+ свободно переходят через протонный канал F0 в матрикс со скоростью, равной скорости откачивания их из матрикса. Если к лишенным F1-компонента пузырькам добавить изолированный комплекс F1, то молекулы F1снова соединятся с F0-компонентом и закроют его протонный канал. В «починенных» митохондриальных пузырьках восстанавливается энергетическое сопряжение между переносом электронов и синтезом АТР. В изолированном виде компонент F1 не способен катализировать синтез АТР, но может расщеплять АТР на ADP и фосфат — именно поэтому F1 называют F1-ATPaзой.
Молекулы АТР связаны с поверхностью ферментного комплекса прочнее, чем молекулы ADP
Изучение механизма каталитического действия очищенного фермента F1 методом изотопного обмена показало, что протекающая на его поверхности реакция синтеза АТР из ADP и фосфата ADP +Pi ⇄ АТР + Н2O обратима, т. е. изменение свободной энергии в этом процессе близко к нулю. Гидролиз АТР, катализируемый ферментом F1, проводился invitro в присутствии воды, меченной изотопом 18O. Метка была обнаружена в образовавшемся фосфате. Более тщательные измерения показали, что образовавшийся фосфат содержал не один, а три или четыре атома 18O (рис. 19-23). Это позволило сделать вывод, что концевая пирофосфатная связь в молекуле АТР претерпевает непрерывное обновление в ходе реакции, т. е. многократно разрывается и вновь образуется, пока с поверхности фермента F1 не произойдет отщепления конечного продукта Рi. На любой стадии гидролиза фосфат, находящийся в активном центре фермента F1, может включать метку 18O случайным образом в одно из четырех возможных положений. Такая реакция обмена протекает без изменения протонного градиента. Изолированный фермент F1 также осуществляет гидролиз АТР без энергетических затрат.
Рис. 19-23. Механизм каталитического действия фермента F1. а — изучение методом изотопного обмена. Выделенный из митохондриальных мембран фермент выдерживают вместе с АТР в воде, меченной изотопом 18O. После этого через короткие промежутки времени отбирают пробы и определяют содержание 18O в образовавшемся фосфате. Очень быстро в фосфате обнаруживаются три или четыре атома 180, что свидетельствует о многократном повторении процессов синтеза и гидролиза АТР. б — наиболее вероятная структура фермента F1 в переходном состоянии обратимой реакции гидролиза — синтеза АТР. α-Субъединица изображена в виде зеленой спирали, β-субъединица — в виде серой спирали. Положительно заряженные остатки β-Arg182 и α-Агд376 соединены координационными связями с двумя атомами кислорода в пятивалентном фосфате. β-Lys155 связан с третьим атомом кислорода, а ион Мg2+ (зеленый шарик) образует с ферментом комплексное соединение. Голубым шариком обозначена оставшаяся в комплексе молекула Н2O. Взаимодействия в активных центрах фермента F1 обеспечивают баланс между АТР и (ADP + Pi).
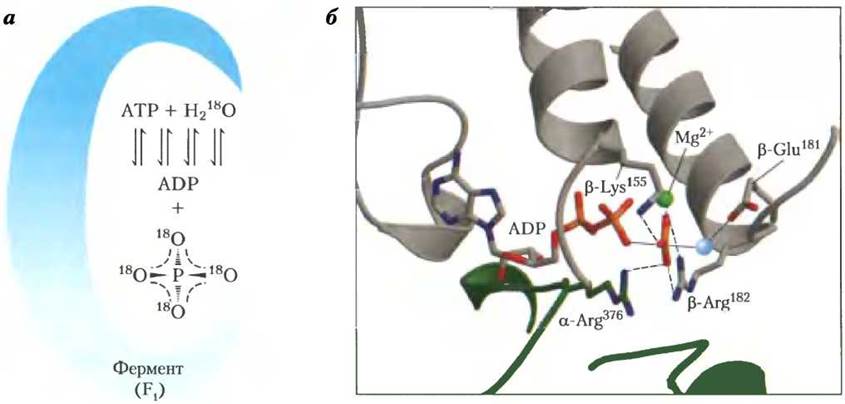
Кинетические исследования реакций синтеза и гидролиза АТР на поверхности фермента F1 показали, что изменение стандартной свободной энергии ∆G′° реакции синтеза АТР близко к нулю. Если константа скорости гидролиза АТР на поверхности комплекса r1 = 10 с-1, а константа реакции синтеза r-1 = 24c-1, то константу равновесия обратимой реакции с участием фермент-субстратных комплексов можно рассчитать по следующему уравнению:
Фермент-ATP фермент-(АDР + Pi)
K′равн. = r-1 / r1 = 24 с-1 / 10 с-1 = 2,4
Кажущееся значение ∆G'°, вычисленное с учетом этой величины К'равн., близко к нулю. Однако для реакции гидролиза свободного АТР в растворе в отсутствие фермента K′paвн. ≈ 105, тогда ∆G'° = -30,5 кДж/моль.
Причина такой существенной разницы в значениях констант скорости и изменения свободной энергии обеих реакций объясняется тем, что на поверхности ATP-синтазы молекулы АТР более стабильны, чем (ADP + Pi). Ферментный комплекс ATP-синтаза образует с молекулами АТР прочные связи, высвобождая при этом энергию, достаточную для образования АТР. Тщательное измерение констант связывания показало, что сродство фермента F0F1 больше к АТР (Kd ≤ 10-12 М), чем к ADP (Kd≤ 105 М). Разница в Кd в энергетическом выражении составляет примерно 40 кДж/моль и служит движущей силой, которая смещает равновесие в сторону образования АТР.
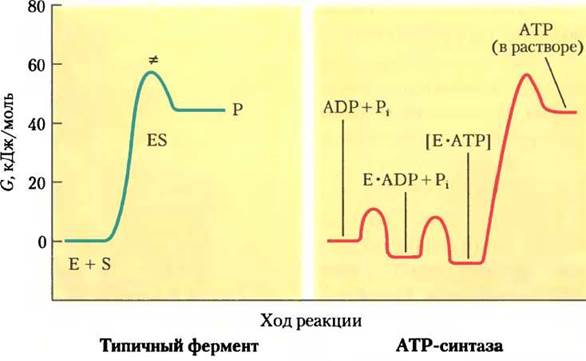
Рис. 19-24. Энергетическая схема каталитического действия ATP-синтазы и другого типичного фермента. В большинстве ферментативных реакций (слева) вершине активационного барьера соответствует переходное состояние (≠) реакции взаимодействия субстрата и продукта реакции. В реакции, катализируемой ATP-синтазой (справа), максимальному активационному барьеру соответствует отщепление (высвобождение, а не синтез!) АТР с поверхности фермента. Изменение свободной энергии в ходе реакции образования АТР из ADP и Pi в водном растворе — большая положительная величина. Если эта реакция катализируется ферментом ATP-синтазой, АТР образует прочную связь с поверхностью фермента, высвобождая энергию, достаточную для расщепления АТР до ADP и Pi, в результате чего реакция становится обратимой (константа равновесия равна 1). Освобождение АТР с поверхности фермента, т. е. регенерация фермента, происходит за счет энергии протон-движущей силы.
Протонный градиент выступает движущей силой для высвобождения АТР с поверхности фермента
Для поддержания определенного соотношения концентраций АТР и (ADP + Рi) на поверхности фермента ATP-синтазы не используется энергия протонного градиента. Однако освобождение синтезированного АТР с поверхности этого фермента происходит только за счет энергии протонного градиента. На рис. 19-24 представлены энергетические диаграммы процессов синтеза АТР под действием ATP-синтазы и других эндергонических реакций.
Фермент ATP-синтаза в процессе непрерывного синтеза АТР должен претерпевать циклические конформационные изменения, переходя из формы, способной прочно связывать АТР, в форму, обеспечивающую освобождение АТР. Как показали химические и кристаллографические исследования, структурные особенности АТР- синтазы позволяют совершать эти альтернативные превращения.
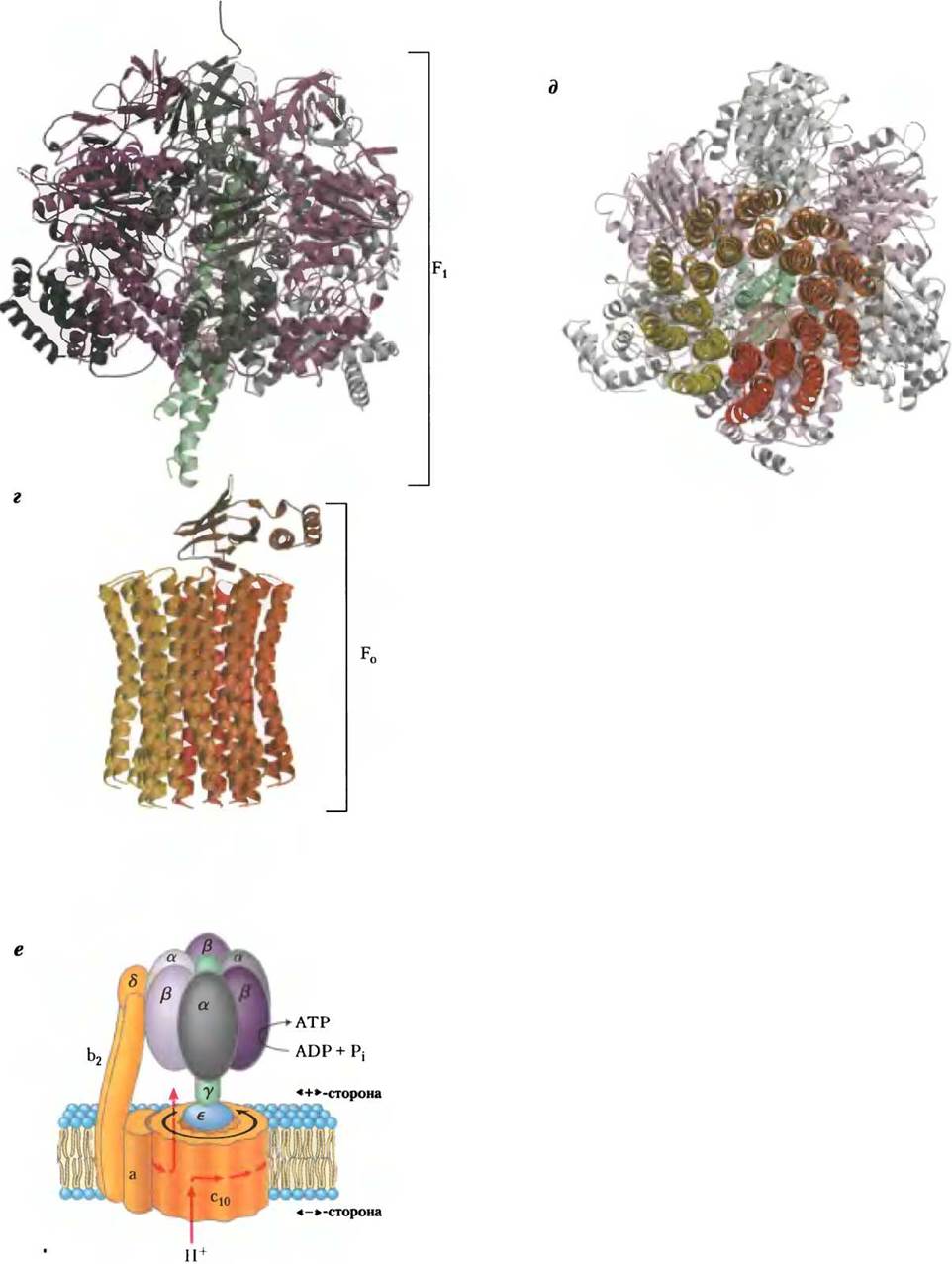
Каждая β-субъединица АТР-синтазы может существовать в трех различных конформациях
Молекулы митохондриального белкового комплекса F1состоят из девяти субъединиц пяти различных типов (3α, 3β, y, δ, ε). Каждая β-субъединица содержит один каталитический центр, в котором происходит синтез АТР. Кристаллографические данные, полученные группой исследователей под руководством Джона Уокера, позволили выявить структурные особенности АТР-синтазы, объясняющие механизм ее каталитического действия. Грибовидная часть комплекса F1 («головка») представляет собой уплощенную сферу высотой 8 нм и диаметром 10 нм. Субъединицы α и β уложены в ней попарно наподобие долек апельсина (рис. 19-25, a-в). Полипептидные цепи y-субъединицы, образующей «ножку» гриба кристаллической структуры F1, расположены асимметрично. Один из доменов y-субъединицы образует стержень, пронизывающий «головку» комплекса. Другой домен y-субъединицы связан главным образом с одной из трех β-субъединиц, имеющей β-пустую конформацию (рис. 19-25, в).
Джон Э. Уокер

Конформации β-субъединиц в комплексе различны, хотя их аминокислотные последовательности одинаковы. Одна из причин различия конформаций у этих β-субъединиц состоит в том, что в определенный момент y-субъединица образует связь только с одной из трех β-субъединиц. Кристаллографическое изучение структуры δ- и ε-субъединиц не проводилось.
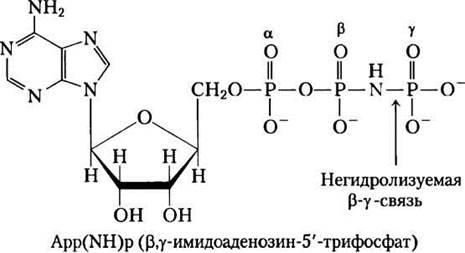
Из-за конформационных различий β-субъединиц в комплексе F1 различаются по строению и их центры связывания АТР и ADP, что было показано в следующем эксперименте. Белок F1 выделили в кристаллическом виде из смеси, содержащей ADP и App(NH)p — структурный аналог АТР, не гидролизующийся под действием изолированного комплекса F1. Оказалось, что одна из β-субъединиц присоединяет App(NH)p, другая — молекулы ADP, третья β-субъединица не присоединяет ни один из этих лигандов — ее активный центр остался пустым. В соответствии со свойствами активных центров этих трех β-субъединиц, их конформации обозначены как β-АТР, β-ADP и β-пустая (рис. 19-25, в). Различная способность β-субъединиц к присоединению нуклеотидов играет важную роль в механизме каталитического действия комплекса F1.
В состав белкового комплекса F0 входят три субъединицы (а, b и с) в стехиометрическом соотношении аb2с10-12, они образуют канал, предназначенный для переноса протонов. Субъединица с — небольшой очень гидрофобный полипептид (Мr 8000), состоящий из двух спиралей, пронизывающих мембрану насквозь, и небольшой петли, почти полностью выступающей в митохондриальный матрикс. Как было установлено в 1999 г., в кристаллической структуре комплекса F0F1, выделенного из дрожжей, две спирали каждой из 10 субъединиц с пронизывают митохондриальную мембрану насквозь почти перпендикулярно ее поверхности. Места пересечения этих спиралей с поверхностью мембраны располагаются по двум концентрическим окружностям (рис. 19-25, г, д). Внутренняя окружность соответствует местам пересечения с мембраной N-концевых спиралей, внешняя (диаметр -55 Â) — пересечению С-концевых спиралей. Субъединицы ε и y в компоненте F1 образуют систему в виде буквы Г, выступающую одним концом в митохондриальный матрикс, а другим концом опирающуюся на состоящее из концентрически расположенных с-субъединиц основание, погруженное в митохондриальную мембрану. Расположение субъединиц комплекса F0F1 представлено на рис. 19-25, е; схема основана на данных, полученных для фермента F1, выделенного из митохондрий быка, и комплекса F0F1 из дрожжей.
Рис. 19-25. Строение митохондриальной АТР-синтазы. а — модель структуры комплекса F1 по результатам кристаллографических и биохимических исследований. Три - α- и три β-субъединицы (серого и фиолетового цвета соответственно) попарно располагаются наподобие долек апельсина вокруг центрального стержня, образованного y-субъединицей (зеленый цвет), б — кристаллическая структура комплекса F1, выделенного из митохондрий быка (PDB ID 1 BMF), вид сбоку. Центральный стержень состоит из y-субъединицы (зеленая спираль). На β-субъединицах участки связывания АТР изображены красными шариками, ADP — желтыми шариками. Чтобы не закрывать эти структурные элементы, не изображены две α- и одна β-субъединицы, а также δ- и ε-субъединицы, в — строение комплекса F1, вид сверху, со стороны отрицательно заряженной поверхности митохондриальной мембраны. Три α- и три β-субъединицы располагаются вокруг центрального стержня, образованного y-субъединицей (зеленая спираль). Между соседними α- и β-субъединицами располагаются центры связывания нуклеотидов, играющие важную роль в каталитической активности фермента. Единственная y-субъединица связана в основном только с одной из трех пар αβ-субъединиц, что служит причиной конформационных различий трех β-субъединиц и их активных центров. Одна из β-субъединиц, конформация которой названа β-ADP, несет в своем активном центре молекулу ADP (желтый шарик). Другая β-субъединица, конформация которой обозначена как β-ATP, связывает в своем активном центре молекулы АТР (красные шарики). Конформация третьей β-субъединицы, не образующей связей с нуклеотидами, названа β-пустой.
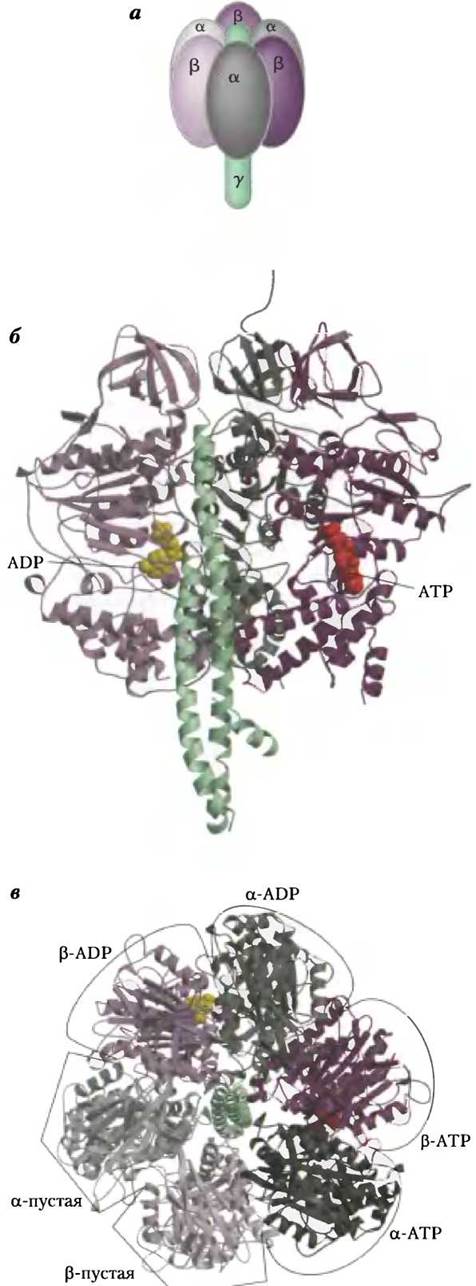
Рис. 19-25. Продолжение, г — строение комплекса F0F1, вид сбоку. Модель основана на кристаллографических данных о структуре компонента выделенного из митохондрий быка, и F0-компонента, полученного из митохондрий дрожжей (РDВ ID 1Q01). В представленной на схеме части комплекса F0F1 субъединицы а, b, δ и ε не показаны. д — Строение комплекса F0F1, поперечный разрез, вид сверху, в направлении от положительно заряженной поверхности митохондриальной мембраны к ее отрицательно заряженной поверхности. На срезе отчетливо видны расположенные по концентрическим окружностям места пересечения двух спиралей каждой из 10 субъединиц, пронизывающих мембрану насквозь. е — модель комплекса F0F1 на основе биохимических и кристаллографических данных. Две b-субъединицы компонента F0 прочно связаны с α- и β-субъединицами компонента F1 в результате чего «головка» компонента F1 находится в фиксированном положении относительно митохондриальной мембраны. Погруженный в мембрану цилиндр, состоящий из с-субъединиц, связан со стержнем, образованным y- и ε-субъединицами, составляющими систему в виде буквы Г в комплексе F1. При прохождении протонов через мембрану по каналам компонента F0 в направлении от положительно заряженной стороны мембраны к отрицательно заряженной происходит вращение цилиндра и стержня. При этом в F1-компоненте y-субъединица поочередно образует связи с одной из β-субъединиц, вследствие чего конформации остальных β-субъединиц изменяются.
Механизм вращательного катализа — ключ к пониманию изменений селективности связывающих центров
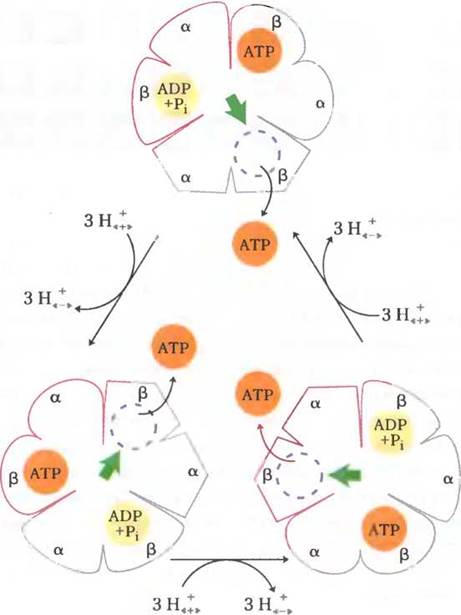
На основе детального изучения кинетики и условий связывания лигандов в активных центрах в ходе реакций, катализируемых ферментом F0F1, Поль Бойер предложил механизм вращательного катализа, согласно которому каталитический цикл синтеза АТР протекает поочередно в трех активных центрах компонента F1 (рис. 19-26). На первой стадии цикла происходит связывание ADP и фосфата, поступивших из внешней среды, в активном центре одной из β-субъединиц, имеющей благоприятную для этого конформацию (β-ADP). На второй стадии в результате взаимодействий в активном центре этой β-субъединицы ее конформация изменяется на β-АТР, благоприятную для образования прочных связей с молекулой АТР. Удерживание молекулы АТР в активном центре приводит систему ADP + Pi и АТР на поверхности фермента в состояние равновесия. На третьей стадии в результате событий в активном центре эта же β-субъединица принимает пустую β-конформацию, для которой характерна низкая степень сродства к АТР, в результате чего молекула АТР высвобождается с поверхности фермента. Следующий цикл катализа начинается с того момента, когда эта же субъединица вновь принимает конформацию р-ADP и связывает в своем активном центре ADP и фосфат.
Поль Бойер

Рис. 19-26. Схема каталитического действия АТР-синтазы согласно вращательному механизму изменения селективности активных центров. Компонент F1 АТР- синтазы имеет три неэквивалентных адениннуклеотидных центра связывания, расположенных между парами α- и β-субъединиц. В какой-то момент времени один из этих центров находится в β-АТР-конформации, т. е. способен прочно связывать АТР, другой — в β-ADP- конформации, образующей с лигандом слабые связи, третий центр имеет пустую p-конформацию, благоприятную для разрыва связей и высвобождения продукта. В результате поворотов вокруг центрального стержня под действием протон-движущей силы н-субъединица поочередно касается каждой пары α, β-субъединиц в компоненте F1б что вызывает одновременное изменение конформаций трех активных центров. Центр с β-АТР- конформацией переходит в пустую β-конформацию, благодаря чему происходит диссоциация АТР. Центр с p-ADP-конформацией переходит в β-АТР, что приводит к образованию АТР из ADP и фосфата. Центр с пустой β-конформацией преобразуется в центр с ADP- β-конформацией, где происходит связывание ADP и фосфата, поступивших из раствора. Согласно предложенному механизму, получившему экспериментальное подтверждение, по меньшей мере в двух из трех каталитических центров должны протекать разные процессы. А именно, молекула АТР не может освободиться из одного центра, пока в другой не поступят ADP и фосфат.
Гипотеза циклического изменения конформации β-субъединиц в компоненте F1 лежит в основе теории вращательного катализа при биосинтезе АТР. Биосинтез АТР происходит за счет энергии, высвобождающейся при прохождении протонов из межмембранного пространства в матрикс через канал комплекса F0. При каждом проходе протонов через протонный канал происходит поворот цилиндра, состоящего из с-субъединиц, и связанного с ним стержня, образованного y-субъединицей, вокруг оси, перпендикулярной плоскости митохондриальной мембраны. Стержень, образованный y-субъединицей, поворачивается внутри неподвижной (благодаря связям с b2- и δ-субъединицами) «головки» F1-компонента, составленной из трех пар α, β-субъединиц (рис. 19-25, д). При каждом повороте на 120° y-субъединица вступает в контакт с разными β-субъединицами. Это изменяет конформацию β-субъединицы до пустой p-конформации, благоприятной для высвобождения АТР.
Изменение конформации β-субъединиц происходит в строгом порядке. Если какая-то β-субъединица переходит в пустую β-конформацию, одна из ее соседних β-субъединиц обязательно принимает β-ADP-конформации, а другая β-АТР. Таким образом, при повороте y-субъединицы на 360° происходит цикл конформационных изменений каждой β-субъединицы от пустой до β-АТР, в результате чего синтезируются и высвобождаются три молекулы АТР.
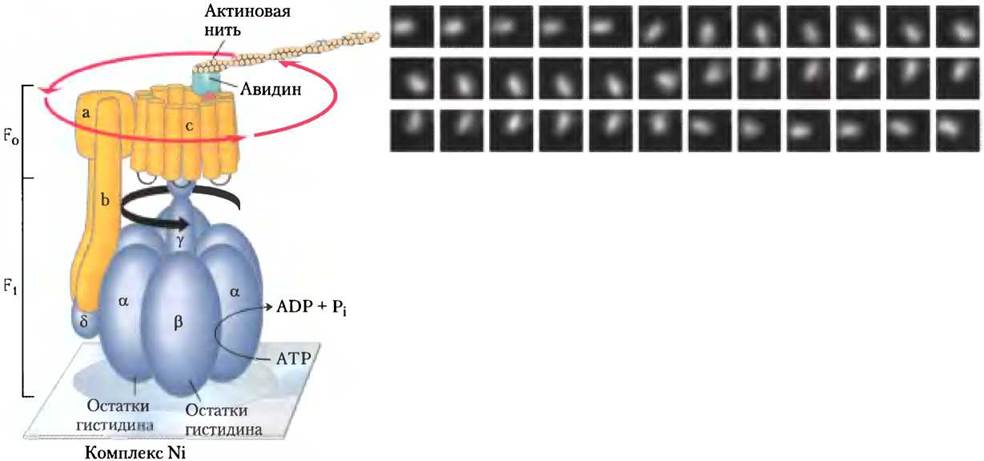
В соответствии с предложенным механизмом действия ATP-синтазы следовало бы ожидать, что при одном направлении вращения y-субъединицы фермент F0F1 должен синтезировать АТР, при другом — гидролизовать АТР. Это теоретическое предсказание получило экспериментальное подтверждение в работах Масасукэ Ешида и Казухико Киношита-мл., которые присоединили длинноцепочечный полимер актин, содержащий флуоресцентную метку, к y-субъединице и с помощью микроскопа наблюдали вращение y-субъединицы в компоненте F1. В аналогичном эксперименте с полноценным ферментом F0F1 удалось наблюдать совместно вращение y-субъединицы и всего цилиндра, состоящего из с-субъединиц (рис. 19-27). Стержень, состоящий из одной y-субъединицы, совершал полный поворот на 360° в предсказанном направлении не плавно, а ступенчато в три стадии, поворачиваясь каждый раз на 120°. Эффективность преобразования химической энергии в движение в этой системе, которую Бойер называл «великолепной молекулярной машиной», была рассчитана на основе данных о скорости гидролиза АТР под действием компонента F1 и торможения длинного актинового полимера, и она оказалась близкой к 100%.
Рис. 19-27. Эксперимент, позволяющий наблюдать вращение компонента F0 и y-субъединицы. Компонент F1 модифицированный с помощью генной инженерии и содержащий остатки гистидина, прочно прикреплен к предметному стеклу микроскопа, покрытому комплексным соединением никеля. Биотин присоединен к с-субъединице ферментного компонента F0. Белок авидин, прочно связанный с биотином, ковалентно присоединяется к длинной актиновой нити с флуоресцентной меткой. Актиновые нити соединены с с-субъединицей через биотин-авидиновую связь. В процессе гидролиза АТР под действием комплекса F1 наблюдается непрерывное вращение флуоресцирующей актиновой нити, свидетельствующее о вращении цилиндра, составленного из с-субъединиц компонента F0. Если флуоресцирующая актиновая нить присоединена непосредственно к у-субъединице, на микрофотографиях, сделанных через каждые 133 мс, видно, что актиновая нить при вращении резко меняет положение в пространстве через каждые 11 кадров. Предполагается, что цилиндр из с-субъединиц и стержень, образованный y-субъединицей, поворачиваются как единое целое.
Хемиосмотическая теория допускает дробные значения для соотношения между количеством поглощенного O2 и количеством образованного АТР
Согласно гипотезе, окислительного фосфорилирования, принятой до хемиосмотической теории, суммарное уравнение реакции окисления NADH в дыхательной цепи митохондрий, сопровождающееся образованием АТР, следовало записывать следующим образом:
х ADP + х Pi + 1/2 O2 + Н+ + NADH —> x ATP + H2O + NAD+ (19-11)
где х (коэффициент P/О или коэффициент Р/2е-) должен принимать целочисленные значения. Количество АТР, синтезированного в смеси интактных митохондрий и окисляемого субстрата, например, сукцината или NADH, в присутствии кислорода оценивалось экспериментально по убыли кислорода. Однако измерить коэффициент P/О было трудно, поскольку интактные митохондрии используют АТР в различных биохимических процессах, а кислород расходуется не только на окислительное фосфорилирование. Поэтому в большинстве таких экспериментов для P/О (или АТР / 1/2 O2) получали дробные числа, например, в случае NADH значения этих коэффициентов были в интервале между 2 и 3, в случае сукцината — между 1 и 2. Тем не менее в течение многих лет для величины P/О были приняты целочисленные значения, равные 3 и 2 для NADH и сукцината соответственно.
Хемиосмотическая теория, объясняющая механизм сопряжения переноса электронов в дыхательной цепи митохондрий с синтезом АТР в митохондриях, не постулирует целочисленность коэффициента P/О, а подходит к вопросу о стехиометрии процесса окислительного фосфорилирования с иной позиции. Согласно хемиосмотической теории, для оценки стехиометрии процесса окислительного фосфорилирования, т. е. величины P/О, необходимо учитывать не только число протонов, выкачиваемых из матрикса через внутреннюю мембрану митохондрии за счет энергии, высвобождающейся при переносе электронов от одной молекулы NADH к кислороду, но и число протонов, вернувшихся в матрикс через протонный канал в комплексе F0F1, в результате чего появляется движущая сила для синтеза АТР. Измерить число протонов, проходящих через митохондриальную мембрану, сложно. Необходимо учитывать буферную емкость митохондрий, непродуктивную утечку протонов через внутреннюю мембрану, т. е. помимо протонного канала комплекса F0F1, а также оценивать, какая часть свободной энергии переноса электронов используется не для синтеза АТР, а для других видов клеточной активности, например для транспорта субстратов через митохондриальную мембрану. Общепринято считать, что число протонов, откачиваемых из матрикса при переносе пары электронов от NADH к O2, равно 10, а от сукцината на O2 — 6. Чаще всего при интерпретации результатов экспериментов число протонов, при откачке которых из матрикса возникает протон-движущая сила, достаточная для синтеза одной молекулы АТР, принимают равным 4. Протон-движущая сила, возникающая при откачивании одного протона из этих четырех, используется для переноса через митохондриальную мембрану фосфата, молекул АТР и ADP, что подробно обсуждается в других разделах. Если принять, что из 10 протонов, откачанных из матрикса при окислении одной молекулы NADH, четыре возвращаются в матрикс по градиенту концентрации с выделением свободной энергии, достаточной для синтеза одной молекулы АТР, то Р/О = 2,5. Когда донором электронов является сукцинат, то при тех же допущениях Р/О = 1,5 (6/4). Авторы этой книги используют значения Р/О, равные 2,5 и 1,5. Однако значения 2 и 3 также приняты в биохимической литературе. Окончательный ответ на вопрос о стехиометрии реакций окислительного фосфорилирования, по-видимому, будет получен только после детального изучения механизма действия комплекса F0F1.
Протон-движущая сила используется для активного транспорта веществ через мембрану
Хотя протон-движущая сила, возникающая из-за наличия градиента концентрации протонов по обе стороны митохондриальной мембраны, используется главным образом для синтеза АТР, часть ее расходуется на перенос через митохондриальную мембрану необходимых для окислительного фосфорилирования веществ. Внутренняя мембрана митохондрий обычно непроницаема для заряженных частиц, но в ней имеются две специфические транспортные системы, которые делают возможным перенос ADP и фосфата в матрикс и вывод АТР в цитозоль (рис. 19-28).
Рис. 19-28. Адениннуклеотидтранслоказа и фосфаттранслоказа — транспортные системы внутренней мембраны митохондрий. Адениннуклеотидтранслоказа — специфический белок, ATP/ADP-антипортер. Он переносит внутрь митохондрий ион ADP3- в обмен на выводимый из матрикса ион АТР4-. В результате такого обмена происходит перенос через мембрану одного отрицательного заряда, чему содействует наличие положительного заряда на внешней стороне внутренней мембраны. Фосфаттранслоказа избирательно переносит из цитозоля в матрикс ион Н2РO4-, хотя в условиях клетки при pH = 7 фосфат существует в виде двух заряженных частиц НРO4- и Н2РO4-. Переносу Н2РO4-сопутствует переход в матрикс иона Н+. В результате такого перемещения ионов не происходит переноса заряда через мембрану, но относительно низкая концентрация протонов в матриксе содействует переносу туда иона Н+. Источником энергии для функционирования ATP-синтазы и двух транспортных систем, осуществляющих перенос субстратов (ADP и Рi) в митохондриальный матрикс и вывод вновь синтезированного АТР из митохондрий в цитозоль, является протон-движущая сила. ATP-синтаза и две транспортные системы выделяются из митохондрий в виде единого комплекса — АТР-синтасомы.
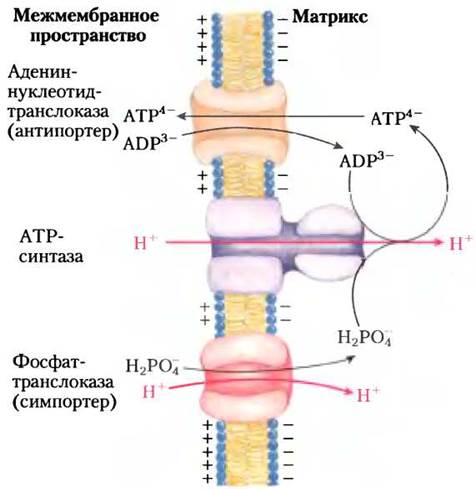
Адениннуклеотидтранслоказа — это интегральный белок, пронизывающий толщу внутренней мембраны, связывает молекулу ADP3- в межмембранном пространстве и переносит ее внутрь митохондрии в обмен на одновременно выходящую из матрикса молекулу АТР4-. Ионные формы АТР и ADP изображены на рис. 13-11. Поскольку ATP/ADP-антипортер вводит в матрикс три отрицательных заряда взамен выведенных четырех отрицательных зарядов, то в результате в матрикс поступает отрицательный заряд, что способствует сохранению трансмембранного электрохимического потенциала. На обмен ATP/ADP расходуется энергия протон-движущей силы. Действие адениннуклеотидтранслоказы может быть заблокировано атрактилозидом — токсичным гликозидом, образующимся в одном из видов чертополоха. Под действием атрактилозида прекращается поступление ADP в митохондрии и вывод АТР из них, в результате чего образование АТР и ADP оказывается невозможным.
Фосфаттранслоказа — вторая транспортная система митохондриальной мембраны, участвующая в окислительном фосфорилировании, она переносит из цитозоля в матрикс ион Н2РО4-. Перенос фосфата обязательно сопровождается транспортом одного протона с положительно заряженной стороны внутренней мембраны на ее отрицательно заряженную сторону, на что затрачивается высвобождаемая при переносе электронов энергия. Для переноса фосфата и для обмена АТР/АDР источником энергии служит мембранный протонный градиент (рис. 19-28).
АТР-синтаза и белковые комплексы обеих транслоказ связаны между собой и при разрушении митохондрий мягким детергентом могут быть выделены в виде АТР-синтасомы.
В окислении внемитохондриального NADН участвуют челночные системы
Комплекс NАDН-дегидрогеназа внутренней митохондриальной мембраны может присоединять электроны только от NАDН, находящегося в матриксе. Внутренняя мембрана митохондрии непроницаема для молекул NАDН, которые находятся в цитозоле. Каким же образом NАDН, образующийся в процессе гликолиза, протекающего, как известно, вне митохондрий, может вновь окисляться до NАD+ молекулярным кислородом, поступающим через дыхательную цепь? Оказывается, существуют особые челночные системы, переносящие восстановительные эквиваленты от цитозольного NАDН в митохондрии непрямым путем.
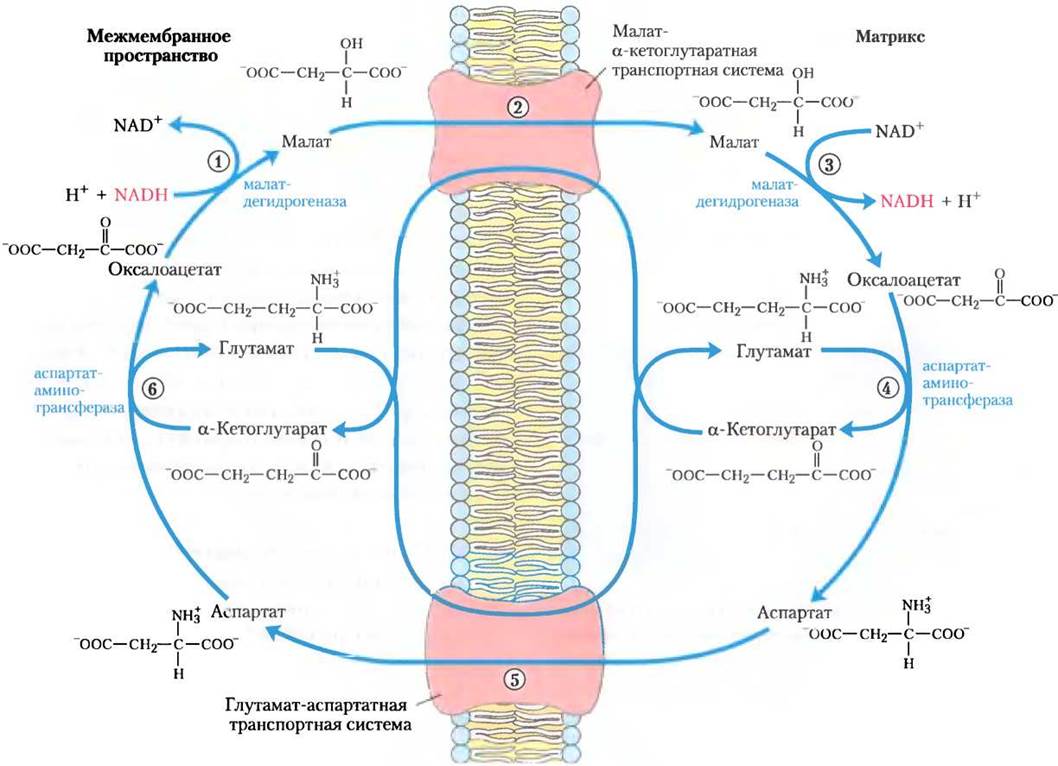
Самая активная из этих челночных систем — малат-аспартатная челночная система, действующая в митохондриях печени, почек и сердца. Обратимся к рис. 19-29, чтобы понять принцип работы этой системы. От цитозольного NАDН восстановительные эквиваленты сначала переносятся цитозольной малатдегидрогеназой на цитозольный оксалоацетат, что приводит к образованию малата. Малат, несущий восстановительные эквиваленты, полученные от цитозольного NАDН, проходит через внутреннюю мембрану митохондрий в матрикс с помощью малат-α-кетоглутаратной транспортной системы. Внутри митохондрии малат отдает эти восстановительные эквиваленты матриксному NАD+в реакции, катализируемой матриксной малат дегидрогеназой. При этом NАD+ восстанавливается до NADH, который может теперь передаватьсвоиэлектроны прямовдыхательную цепь внутренней митохондриальной мембраны. В малат-аспартатной системе при передаче на кислород каждой пары электронов синтезируется 2,5 молекулы АТР. Цитозольный оксалоацетат регенерируется под действием трансаминазы, и начинается новый оборот челночного цикла.
Рис. 19-29. Малат-аспартатная челночная система. Эта система осуществляет перенос восстановительных эквивалентов от цитозольного NADH в митохондриальный матрикс и действует в митохондриях печени, почек и сердца. (1) Цитозольный NADH передает два восстановительных эквивалента на цитозольный оксалоацетат, что приводит к образованию малата. (2) Несущий восстановительные эквиваленты малат переносится через внутреннюю мембрану при помощи малат-α-кетоглутаратной транспортной системы. (3) В матриксе малат передает два восстановительных эквивалента на матриксный NAD+. Образовавшийся в матриксе NADH окисляется электронами митохондриальной дыхательной цепи. Продукт малатдегидрогеназной реакции оксалоацетат не способен пройти через мембрану, чтобы вернуться в цитозоль. (4) Под действием трансаминазы оксалоацетат превращается в аспартат. (5) Аспартат может быть перенесен через мембрану глутамат-аспартатной транспортной системой. (6) В цитозоле оксалоацетат регенерируется и начинается новый оборот челночного цикла.
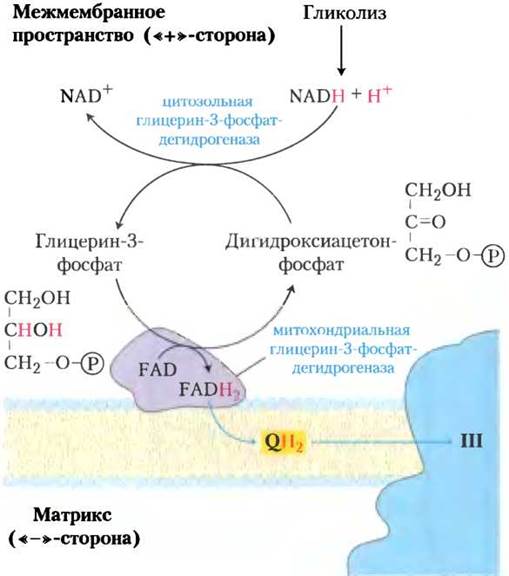
В скелетных мышцах и в мозге перенос восстановительных эквивалентов от NADH осуществляется челночной системой другого типа. Это так называемая глицерин-3-фосфатная челночная система (рис. 19-30). Она отличается от малат-аспартатной системы тем, что восстановительные эквиваленты передаются ею от NADH в дыхательную цепь и на убихинон, т. е. в комплекс III, а не в комплекс I. В глицерин-3- фосфатной челночной системе при окислении NADH образуется 1,5 молекулы АТР на каждую пару перенесенных электронов.
Рис. 19-30. Глицерин-3-фосфатная челночная система. Эта челночная система осуществляет перенос восстановительных эквивалентов от цитозольного NADН в митохондриальный матрикс. Система действует в скелетных мышцах и в мозге. От цитозольного NADН два восстановительных эквивалента сначала переносятся цитозольной глицерин-3-фосфатдегидрогеназой на дигидроксиацетонфосфат. Два восстановительных эквивалента от цитозольного глицерин-3-фосфата передаются затем на убихинон изоферментом глицерин-3-фосфатдегидрогеназой, расположенной на внешней стороне внутренней мембраны. Глицерин-3-фосфатная транспортная система не связана с мембранными транспортными системами.
В митохондриях растений существует так называемая «внешняя» NADH-дегидрогеназа, которая передает электроны от цитозольного NADH в митохондриальную дыхательную систему прямо через убихинон, минуя NADH-дегидрогеназу в комплексе I и связанную с этим комплексом откачку протонов. Окисление цитозольного NADH дает меньший выход АТР, чем окисление NADH матрикса, (см. доп. 19-1).
Краткое содержание раздела 19.2 Синтез АТР
■ Перенос электронов через ферментативные комплексы I, III и IV сопровождается выкачиванием протонов из матрикса через внутреннюю митохондриальную мембрану в межмембранное пространство, в результате чего матрикс становится более щелочным, а межмембранное пространство более кислым. Между двумя сторонами внутренней митохондриальной мембраны создается градиент концентрации ионов Н+. Именно этот градиент служит движущей силой синтеза АТР из ADP и неорганического фосфата под действием фермента АТР-синтазы (комплекса F0F1) во внутренней митохондриальной мембране.
■ ATP-синтаза катализирует синтез АТР в митохондриях по вращательному механизму. Суть механизма вращательного катализа состоит в том, что при каждом переносе протонов из цитозоля в матрикс через канал F0-компонента происходит циклическое изменение конформации каждого из трех центров связывания нуклеотидов в компоненте F1. Эти центры поочередно принимают конформацию, благоприятную для связывания (ADP + Pi), для связывания АТР и, наконец, пустую конформацию, обеспечивающую освобождение продукта с поверхности фермента.
■ Для образования АТР на поверхности фермента требуется небольшое количество энергии. Энергия протон-движущей силы при ферментативном синтезе АТР в митохондриях расходуется в основном на высвобождение АТР из центра связывания на поверхности АТР-синтазы.
■ Если электроны поступают в дыхательную цепь митохондрии через комплекс I, то коэффициент P/О (отношение количества, синтезированного АТР к восстановленным до Н2Oатомам кислорода) равен примерно 2,5. Когда электроны по дыхательной цепи поступают сразу на кофермент Q, Р/О = 1,5.
■ Энергия, запасенная в виде градиента концентрации протонов, может использоваться для переноса растворенных веществ через митохондриальную мембрану.
■ Внутренняя митохондриальная мембрана непроницаема для NADH и NAD+, находящихся в цитозоле. Восстановительные эквиваленты от цитозольного NADH переносятся в матрикс с помощью одной из двух челночных систем. Малат-аспартатная система переносит восстановительные эквиваленты от цитозольного NADH в дыхательную митохондриальную цепь через комплекс I. Коэффициент окислительного фосфорилирования при этом равен 2,5. Глицерин-3-фосфатная челночная система передает восстановительные эквиваленты от цитозольного NADH в дыхательную митохондриальную цепь через кофермент Q. При этом Р/О = 1,5.