Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Фибриллярные белки
В нативных а-кератинах а-спиральные полипептидные цепи скручены наподобие каната
Если волосы или шерсть исследовать с помощью электронного микроскопа, то можно увидеть (особенно в местах разрыва, где волос расщепляется на отдельные нити), что каждый волос состоит из множества фибрилл и что каждая фибрилла в свою очередь состоит из многих еще более тонких нитей, навитых друг на друга наподобие каната. Более детальные данные, полученные при помощи рентгеноструктурного анализа, позволили сделать вывод, что в волосе три а-спиральные полипептидные цепи скручены одна вокруг другой и образуют суперспирализованную структуру, напоминающую трехжильный кабель (рис. 7-9), в котором каждая жила представляет собой а-спираль. В структурах такого типа все составляющие их а-спиральные полипептиды расположены в одном направлении, так что все N-концевые остатки оказываются на одном и том же конце. В а-кератине волос полипептидные цепи прочно соединены друг с другом ковалентными поперечными связями между остатками цистина, принадлежащими соседним полипептидным цепям. а-Кератины из разных источников различаются по содержанию цистина. Самые прочные и жесткие а-кератины, например а-кератины в панцыре черепахи, содержат до 18% цистина.
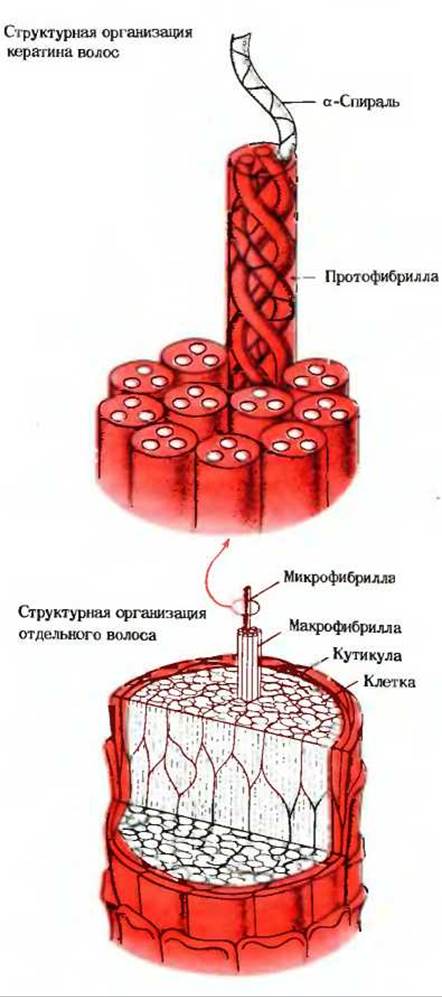
Рнс. 7-9. Структура волоса и входящего в его состав а-кератина. Основным элементом структуры служит полипептидная цепь а-кератина в нативной а-спиральной конформации. Три а-спиральные цепи образуют скрученный (суперспирализованный) трехжильный «канат»; 11 таких канатов составляют микрофибриллу волоса.