Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Фибриллярные белки
В а-кератинах содержится много аминокислот, способствующих образованию а-спиральной структуры
Остов полипептидной цепи автоматически принимает ту пространственную конформацию, которая хорошо соответствует целому ряду ограничений, налагаемых аминокислотным составом цепи и последовательностью аминокислотных остатков. В полипептидных цепях нативных а-кератинов аминокислотный состав и последовательность аминокислот благоприятствуют самопроизвольному образованию а-спирали со множеством стабилизирующих ее внутрицепочечных водородных связей. а-Кератины богаты аминокислотами, обеспечивающими образование а-спирали, и содержат очень мало аминокислот (например, пролина), не совместимых с существованием а-спиральной конформации. а-Кератины особенно богаты остатками цистина (рис. 7-8), способными, как мы уже знаем (разд. 5-7), образовывать поперечные дисульфидные (—S—S—) связи между соседними полипептидными цепями. Эти связи ковалентны и потому обладают большой прочностью. Такие ковалентные поперечные связи, в образовании которых участвует много остатков цистина, связывают воедино соседние а- спирали и наделяют волокна а-кератина способностью к прочному слипанию друг с другом.
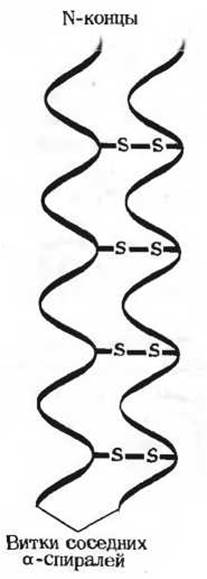
Рис. 7-8. Поперечные связи между соседними а-спиральными витками а-кератина обусловлены присутствием в них остатков цистина. В «твердых» кератинах, например в кератине панцыря черепахи, цистиновые поперечные связи весьма многочисленны.