Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Фибриллярные белки
Некоторые аминокислотные остатки препятствуют образованию а-спирали
Хотя в а-кератинах полипептидная цепь имеет а-спиральную конформацию, не все полипептиды способны образовывать устойчивую а-спираль. Например, если в полипептидной цепи подряд расположено много остатков глутаминовой кислоты, то при pH 7,0 такой участок не примет а-спиральной конформации. Причина состоит в том, что сильное взаимное отталкивание отрицательно заряженных карбоксильных групп соседних остатков глутаминовой кислоты значительно превосходит стабилизирующее влияние водородных связей в а-спирали. По той же причине при pH 7,0 не будут иметь а-спиральной конформации участки цепи, содержащие большое число близко расположенных друг к другу остатков лизина или аргинина, R-группы которых несут при этом значении pH положительный заряд; взаимное отталкивание этих остатков будет препятствовать образованию а-спирали. Некоторые другие аминокислоты, например аспарагин, серин, треонин и лейцин, также мешают образованию а-спирали, если они расположены в цепи близко одна к другой; в этом случае причиной служат большие размеры и форма их R-гpyпп.
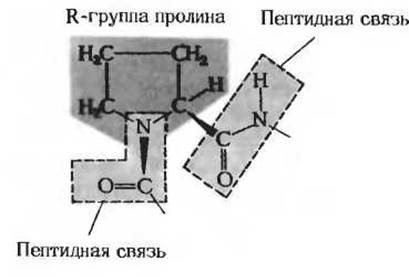
Рис. 7-7. Наличие остатка пролина в полипептидной цепи вызывает ее изгиб. Серым цветом выделены жесткие пептидные группы. Жесткая R-группа пролина показана на красном фоне.
Еще одним препятствием, мешающим образованию а-спирали, является присутствие в полипептидной цепи одного или большего числа остатков пролина. В пролине атом азота входит в состав жесткого кольца, что исключает возможность какого бы то ни было вращения вокруг N—С-связи (рис. 7-7). Кроме того, при атоме азота в остатке пролина, образующем пептидную связь с другой аминокислотой, нет атома водорода. Поэтому остаток пролина, входящий в состав полипептидной цепи, не способен образовать внутрицепочечную водородную связь. Вследствие этого везде, где в полипептидной цепи встречаются остатки пролина, а-спиральная структура нарушается и возникает петля или изгиб.
Итак, мы имеем четыре типа различных ограничений, налагаемых на пространственную конформацию полипептидной цепи: 1) жесткость и транс-конфигурация пептидных связей, 2) электростатическое отталкивание (или притяжение) аминокислотных остатков, содержащих заряженные R-группы; 3) близкое расположение в цепи громоздких R-групп и 4) присутствие в полипептидной цепи остатков пролила.
Теперь мы введем новый важный термин. Мы уже упоминали, что ковалентные пептидные связи и аминокислотную последовательность полипептидных цепей называют первичной структурой. Под термином вторичная структура мы будем понимать пространственное расположение, т.е. конформацию, соседних аминокислотных остатков в полипептидной цепи. В случае а-кератина вторичная структура полипептидной цепи представляет собой а-спираль.