Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Фибриллярные белки
В а-кератине полипептидные цепи имеют форму а-спирали
Используя специально изготовленные точные модели, Полинг и Кори изучили возможные способы скручивания или свертывания полипептидной цепи с учетом ограничений, налагаемых присутствием жестких связей в плоских пептидных группах. Особый интерес они проявили к конформациям, которые могли бы объяснить существование в а-кератине волос периодически повторяющихся единиц длиной около 0,54 нм. Простейшая форма полипептидной цепи, содержащей жесткие пептидные связи (при том, что вокруг всех остальных одинарных связей свобода вращения сохраняется), - это показанная на рис. 7-6 спиральная структура, которую Полинг и Кори назвали а-спиралью. В этой структуре полипептидный остов образует плотные витки вокруг длинной оси молекулы тогда как R-группы аминокислотных остатков выступают из спирального остова наружу. Периодически повторяющаяся единица соответствует одному витку спирали, шаг которой составляет приблизительно 0,54 нм, что хорошо согласуется с периодичностью, наблюдающейся при рентгеноструктурном исследовании кератина волос.
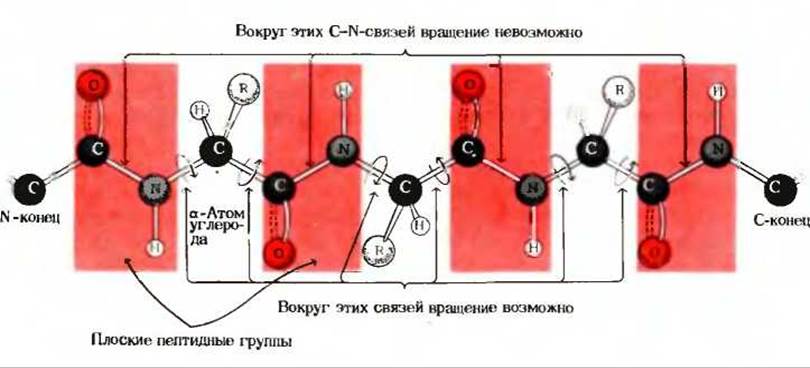
Рис. 7-5. Ограничения, налагаемые на вращение вокруг одинарных связей полипептидной цепи.
С—N-связи, входящие в состав плоских пептидных групп (показанных на красном фоне) и составляющие третью часть всех связей остова, не допускают свободного вращения Вращение вокруг других одинарных связей остова также в той или иной мере ограничено в зависимости от размеров и заряда R-гpyпп.
В связи с этим возникает вопрос: за счет каких сил стабилизируется конформация а-спирали? Почему из всех возможных конформаций реализуется именно такая спиральная форма? Ответ заключается в следующем: а-спираль - это устойчивая предпочтительная конформация полипептидной цепи в а-кератине потому, что она допускает образование водородных связей между каждым атомом водорода, соединенным с электроотрицательным атомом азота пептидной связи, и электроотрицательным атомом кислорода карбонильной группы четвертого (считая вдоль цепи назад) аминокислотного остатка (рис. 7-6). В образовании подобных водородных связей участвует каждая пептидная группа. Таким образом, каждый последующий виток а-спирали связан с предшествующим несколькими водородными связями, что придает всей структуре значительную устойчивость. Итак, мы видим, что а-спираль является устойчивой конформацией полипептидной цепи благодаря существованию двух типов ограничений, не допускающих свободного вращения вокруг одинарных связей: 1) наличию плоских пептидных групп с жесткими связями, вокруг которых вращение невозможно, и 2) образованию большого числа внутрицепочечных водородных связей. В настоящее время имеется множество данных, убедительно свидетельствующих о том, что полипептидные цепи а-кератинов действительно имеют а-спиральную конформацию.
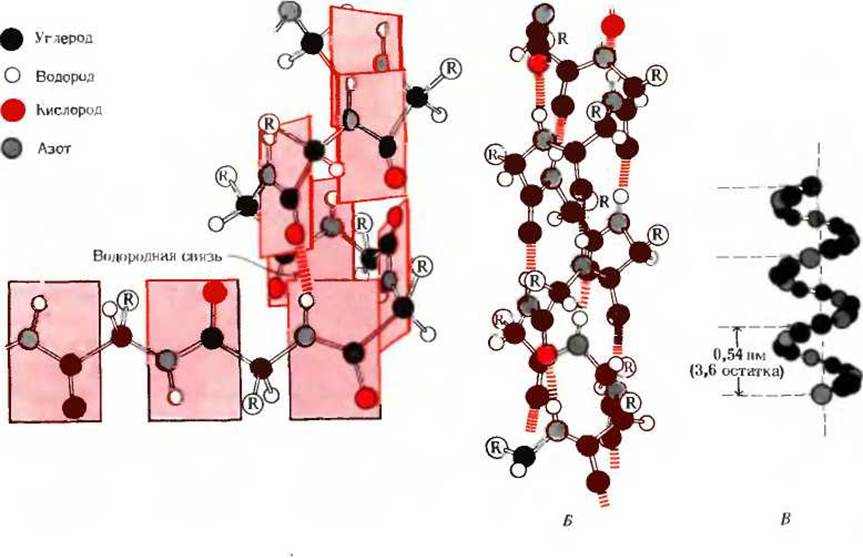
Рис. 7-6. Три модели а-спирали, показывающие различные особенности ее структуры.
A. Формирование правой а-спирали. Плоскости жестких пептидных групп параллельны длинной оси спирали. Одна из водородных связей выделена красным цветом. Б. Модель а-спирали из стержней и шариков, на которой показаны внутрицепочечные водородные связи. B. Шаг спирали cooi ветствует периоду 0.54 нм (3,6 аминокислотных остатков).
В ходе дальнейшей работы с использованием моделей было показано, что а-спираль может быть построена либо из L-, либо из D-аминокислот, но все аминокислоты должны представлять собой стереоизомеры одного и того же типа, так как пептидная цепь, состоящая из смеси остатков L- и D-аминокислот, не способна образовать спираль. Далее, если использовать только природные L-аминокислоты, то можно построить как правую, так и левую спираль; для большинства фибриллярных белков характерны правые спирали.