Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Фибриллярные белки
Другие типы фибриллярных или нитевидных белков, встречающихся в клетках
Скелетные мышцы, равно как и многие немышечные клетки, содержат два белка - миозин и актин, образующие характерные фибриллярные или нитевидные структуры. По своей биологической функции они представляют собой не столько структурные белки, сколько белки, участвующие в зависимых от энергии процессах сокращения.
Миозин - это очень длинная палочковидная молекула с хвостом, состоящим из двух навитых друг на друга а-спиральных полипептидов; она имеет также сложную по своему строению «головку», обладающую ферментативной активностью (рис. 7-18). Общая молекулярная масса миозина составляет 450000, молекула имеет в длину около 160 нм и содержит шесть полипептидных цепей. Длинный хвост состоит из двух цепей, каждая с молекулярной массой 200 000; это тяжелые цепи, в которых находятся гибкие шарнирные участки. Головка имеет глобулярную форму и содержит концы тяжелых цепей, а также четыре легкие цепи, свернутые в виде глобул, каждая с молекулярной массой около 18 000. Головка молекулы миозина обладает ферментативной активностью; она катализирует гидролитическое расщепление АТР на ADP и фосфат. Многочисленные молекулы миозина, регулярно уложенные в виде пучка, образуют толстые нити скелетной мышцы. Миозин встречается и в немышечных клетках (см. рис. 2-15 и разд. 2.13).
С толстыми нитями в скелетной мышце тесно взаимодействуют тонкие нити, состоящие из белка актина. Актин существует в двух формах: в виде глобулярного актина (G-актин) и фибриллярного актина (F-актин). Фибриллярный актин представляет собой длинную цепочку из молекул G-актина (мол. масса 46000), связанных друг с другом в одну нить. Две нити F-актина навиваются одна на другую и образуют двухнитевую скрученную структуру (рис. 7-18).
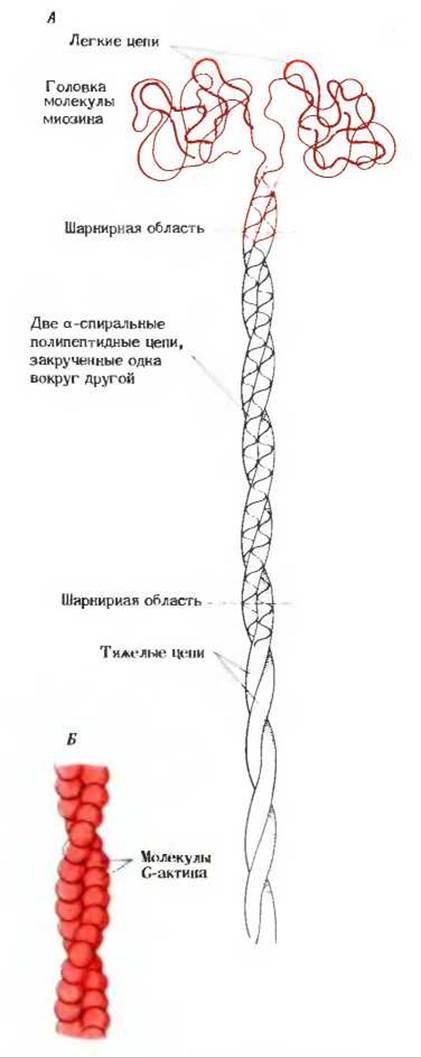
Рис. 7-18. Миозин и актин - два нитевидных белка сократительной системы. А Молекула миозина имеет длинный хвост, состоящий из двух суперспирализованных а-спиральных полипептидных цепей (тяжелые цепи). Головка молекулы, содержащая четыре легкие цепи, обладает ферментативной активностью: она способна отщеплять от АТР фосфатную группу. Б. Схема строения F-актина, состоящего из двух обвитых одна вокруг другой цепей G-актина.
В сократительной системе мышцы толстые нити (состоящие из молекул миозина) и тонкие нити (состоящие из G-актина) уложены параллельными рядами. Как мы увидим ниже (гл. 14 и 25), сокращение скелетной мышцы происходит благодаря скольжению тонких нитей вдоль толстых, причем это скольжение индуцируется в присутствии некоторых других мышечных белков и ионов Са2+. Скольжение нитей, обусловливающее укорочение скелетной мышцы в процессе сокращения, осуществляется только при наличии в системе АТР.
Еще одна система длинных нитевидных белков имеется в микротрубочках, о которых речь шла выше (разд. 2.14 и 2.15). Микротрубочки-это длинные полые трубки, каждая из которых построена из 13 белковых нитей, уложенных параллельно друг другу вокруг центральной полости. Каждая нить состоит из чередующихся молекул двух глобулярных белков - а-тубулина и ß-тубулина. Микротрубочки входят в состав ресничек и жгутиков эукариот; их взаимное скольжение или скручивание относительно друг друга сообщает ресничкам и жгутикам характерное винтообразное, вращательное или волнообразное движение, обеспечивающее перемещение клеток. Микротрубочки участвуют во многих других видах клеточной активности, например в делении клеток; некоторым клеткам они придают ту или иную форму. Движение микротрубочек в жгутиках тоже зависит от гидролиза АТР.