Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Глобулярные белки: структура и функция гемоглобина
Полипептидные цепи глобулярных белков свернуты в плотную компактную структуру
В глобулярных белках полипептидная цепь свернута в компактную глобулу. Белки этого класса, значительно более сложные по конформации, чем фибриллярные белки, способны выполнять самые разнообразные биологические функции, причем их активность носит не статический, а динамический характер. К глобулярным белкам относятся почти все из 2000 или даже большего числа известных ферментов. Некоторые глобулярные белки выполняют транспортные функции: вместе с током крови они переносят кислород, питательные вещества и неорганические ионы; к этому же классу белков принадлежат антитела, гормоны, а также компоненты мембран и рибосом.
Из этой главы мы узнаем, как свертываются в пространстве полипептидные цепи некоторых глобулярных белков и каким образом аминокислотная последовательность определяет их трехмерную структуру. Мы увидим также, что нативная свернутая конформация глобулярных белков служит необходимой предпосылкой их биологической активности. Далее мы рассмотрим химические и биологические свойства содержащегося в эритроцитах белка гемоглобина, который играет роль переносчика кислорода, и в связи с этим коснемся некоторых медицинских вопросов. На примере гемоглобина мы проиллюстрируем, каким образом трехмерная структура глобулярных белков приспособлена к выполнению их важных биологических функций.
Существуют две группы данных, которые с очевидностью свидетельствуют о том, что полипептидные цепи глобулярных белков плотно свернуты и что такая конформация важна для выполнения этими белками их биологических функций. Первая группа данных касается денатурации нативных глобулярных белков. происходящей при их нагревании, воздействии экстремальными значениями pH или при обработке их мочевиной (разд. 6.12). В процессе денатурации структура ковалентного остова глобулярного белка остается неповрежденной, но полипептидная цепь развертывается и принимает беспорядочную, нерегулярную и подверженную изменениям пространственную конформацию. Денатурированный глобулярный белок, как правило, становится нерастворимым в водных системах при pH около 7 и обычно утрачивает свою биологическую активность.
Вторым доказательством свернутой конформации глобулярных белков служит сравнение длины их полипептидных цепей с реальными размерами, их молекул. рассчитанными по результатам физико-химических измерений. Например, сывороточный альбумин (мол. масса 64 500) имеет одну полипептидную цепь, состоящую из 584 аминокислотных - остатков. Если бы эта цепь находилась в полностью вытянутой ß-конформации, ее длина составляла бы почти 200 нм, а толщина - около 0,5 нм. Если бы она была свернута в сплошную а-спираль, она имела бы длину примерно 90 нм и толщину 1,1 нм (рис. 8-1). Однако физико-химические измерения показывают, что максимальный размер молекулы нативного сывороточного альбумина составляет около 13 нм, а диаметр - примерно 3 нм (рис. 8-1). Отсюда ясно, что полипептидная цепь сывороточного альбумина должна быть очень плотно свернута, иначе молекула этого белка не могла бы иметь указанные выше размеры. В настоящее время твердо установлено, что все глобулярные белки компактно свернуты специфическим образом, благодаря чему и возникает их биологическая активность. Способ свертывания полипептидных цепей глобулярных белков в компактную сферическую глобулу мы будем называть третичной структурой.
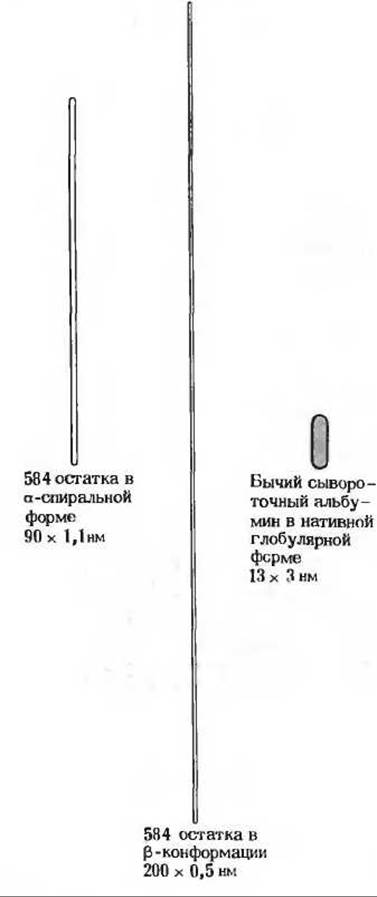
Рис. 8-1. Размеры молекулы бычьего сывороточного альбумина в его нативной глобулярной конформации. Сывороточный альбумин содержит 584 остатка в своей единственной полипептидной цепи. Слева показаны приблизительные размеры, которые имела бы эта полипептидная цепь, если бы она представляла собой сплошную а-спираль или целиком находилась в вытянутой ß-конформации. Действительные размеры молекулы нативного сывороточного альбумина показаны справа.
Возникает ряд очевидных вопросов. Как можно установить способ свертывания цепей в глобулярных белках? Одинакова ли укладка полипептидных цепей во всех глобулярных белках? Какие силы удерживают цепь в свернутой конформации?