Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Глобулярные белки: структура и функция гемоглобина
Рентгеноструктурный анализ миоглобина - выдающееся достижение в исследовании белков
Ответ на поставленные выше вопросы дал один из самых эффективных методов - метод рентгеноструктурного анализа, при помощи которого, как мы уже видели, удалось установить структуру ряда фибриллярных белков. Однако рентгеноструктурный анализ глобулярных белков представляет значительно более трудную задачу, чем рентгеноструктурный анализ фибриллярных белков, вытянутых вдоль одной оси и, как правило, имеющих периодическую структуру. Чтобы установить трехмерную структуру глобулярных белков по их рентгенограммам, необходимо сделать множество расчетов с привлечением мощной вычислительной техники.
Первый значительный успех в изучении трехмерной структуры глобулярных белков был достигнут в результате рентгеноструктурного исследования миоглобина, проведенного в 50-х годах в Англии Джоном Кендрью и его коллегами. Миоглобин - относительно небольшой кислород-связывающий белок (мол. масса 16 700), присутствующий в мышечных клетках. Его функция состоит в том, что он запасает связанный кислород и способствует его переносу в митохондрии, которые потребляют кислород в процессе окисления поступающих в клетку питательных веществ. В молекуле миоглобина имеется одна полипептидная цепь, состоящая из 153 аминокислотных остатков с установленной последовательностью, и одна гемогруппа, или гем, - комплекс протопорфирина с железом (рис. 8-2), содержащийся также в гемоглобине - кислород-связывающем белке эритроцитов. Присутствием гемогруппы объясняется густой красно-коричневый цвет, характерный для миоглобина и гемоглобина. Миоглобина особенно много в мышцах морских млекопитающих - кита, тюленя и дельфина: высокое содержание миоглобина придает их мышцам коричневый цвет. Миоглобин позволяет этим животным запасать в мышцах необходимое количество кислорода при погружении на длительное время в воду.
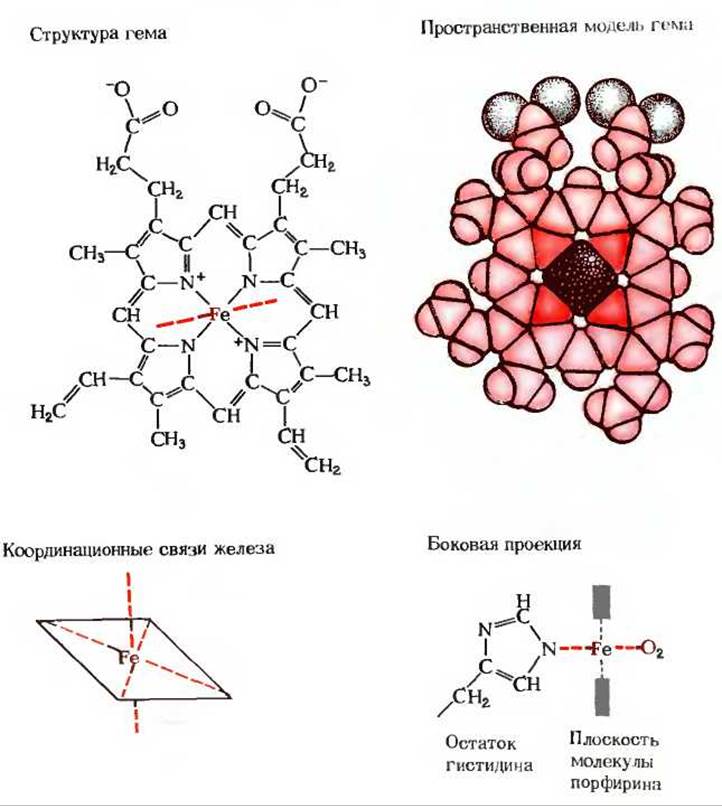
Рис. 8-2. Гемогруппа, присутствующая в миоглобине, гемоглобине и многих других гемопротеинах. Она представляет собой сложную полициклическую структуру, называемую протопорфирином, с которой связан атом железа в [Fe (II)] - форме (ферроформа). Атом железа имеет шесть координационных связей, четыре из которых участвуют в образовании комплекса железа с плоской молекулой порфирина, а две другие направлены перпендикулярно порфириновому кольцу. В миоглобине и гемоглобине одна из этих двух связей занята атомом азота, принадлежащим остатку гистидина. Другая связь свободна и служит для связывания молекулы кислорода, как это показано в боковой проекции внизу справа. В миоглобине и гемоглобине за эту свободную связь помимо молекулы О2 может конкурировать молекула окиси углерода (СО), которая образует с атомом железа в 200 раз более прочную связь, чем О2. При отравлении угарным газом (окисью углерода) значительная часть гемоглобина переходит в форму карбоксигемоглобина, что препятствует переносу О2 из легких в ткани.
Рентгенограммы, которые Кендрью использовал для исследования структуры миоглобина из мышц кашалота (рис. 8.3), носили очень сложный характер и содержали почти 25 000 рефлексов. Расчеты, связанные с анализом интенсивностей всех этих дифрагированных рентгеновских лучей, проводили последовательными этапами. На первом этапе, завершенном в 1957 г., трехмерная структура миоглобина была рассчитана с разрешением 0,6 нм. При такой степени разрешения, еще не достаточной для определения точных положений индивидуальных атомов, удалось выяснить, как свернута полипептидная цепь в молекуле миоглобина. Оказалось, что она уложена довольно причудливым и нерегулярным образом, так что очертания третичной структуры миоглобина напоминают свернутую колбасу (рис. 8-4). Поскольку R-групп на рисунке нет, структура молекулы выглядит намного более рыхлой, чем она есть на самом деле. На рисунке изображена также плоская гемогруппа, плотно прилегающая к полипептидной цепи, хотя и не связанная с ней ковалентно. На втором этапе рентгеноструктурный анализ миоглобина был выполнен при разрешении 0,2 нм, достаточно высоком, чтобы идентифицировать большинство R-групп. На третьем этапе была проведена идентификация всех аминокислотных остатков при разрешении 0,14 нм. Полученная аминокислотная последовательность довольно хорошо соответствовала данным химического анализа.
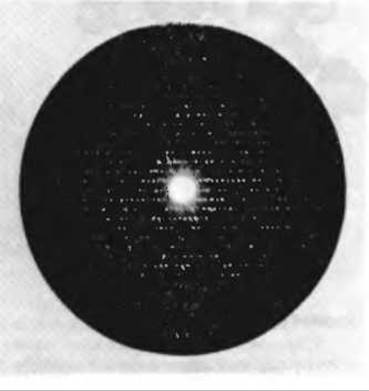
Рис. 8-3. Фотоотпечаток рентгенограммы кристаллического миоглобина кашалота. По расположению и интенсивности дифракционных пятен, возникающих в результате взаимодействия рентгеновского пучка с атомами миоглобина в кристалле, была рассчитана точная трехмерная структура миоглобина.
На рис. 8-4 показана детальная, с учетом каждого остатка, вторичная структура полипептидного остова миоглобина, изображенного внутри общего контура молекулы, свернутой наподобие колбасы, а также его третичная структура, т. е. укладка всей цепи в трех измерениях. Остов молекулы миоглобина построен из восьми относительно прямолинейных сегментов, чередующихся с изогнутыми участками полипептидной цепи. Каждый прямолинейный сегмент - это отрезок а-спирали, причем самый длинный из них содержит 23 аминокислотных остатка, а самый короткий-всего лишь 7. Оказалось, что все а-спиральные сегменты представляют собой правую а-спираль. На долю а-спиральных участков в молекуле миоглобина приходится почти 80% всех аминокислотных остатков. Рентгеноструктурный анализ позволил также установить точное расположение каждой из R-групп, выступающих из изображенных на рисунке контуров и занимающих практически все свободное пространство между изогнутыми петлями молекулы.
Исходя из точных моделей молекулы миоглобина, построенных в соответствии с рентгеноструктурными данными, было сделано еще несколько важных выводов.
1. Молекула миоглобина настолько компактна, что внутри нее может уместиться всего четыре молекулы воды.
2. Все полярные R-группы, за исключением двух, расположены на внешней поверхности молекулы, причем все они находятся в гидратированном состоянии.
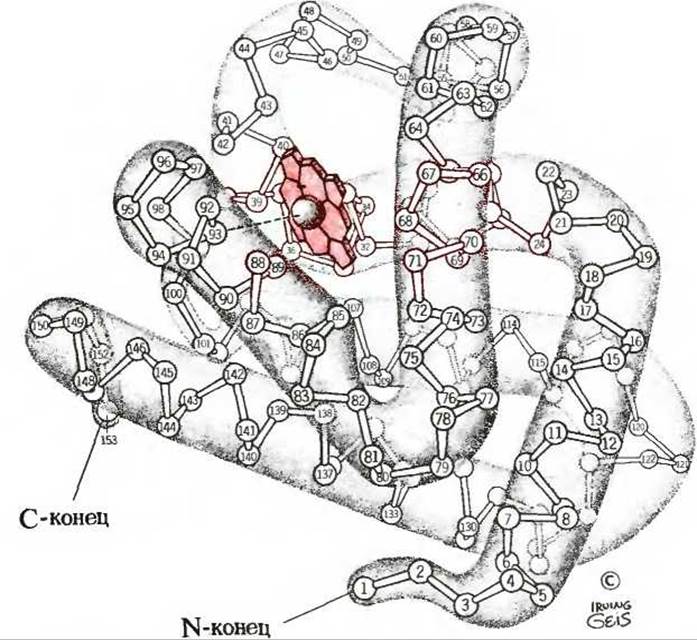
Рис 8-4. Третичная структура миоглобина кашалота, установленная методом рентгеноструктурного анализа. Показана структура остова молекулы, полученная при разрешении 0,2 нм. Полипептидная цепь, в которой изображен только а-углеродный остов, по своему контуру напоминает колбасу. Пространство между петлями цепи не свободно, а заполнено R-группами (на рисунке не показаны). Молекула миоглобина содержит восемь а-спиральных сегментов. Порфириновое кольцо гемогруппы выделено красным цветом.
3. Большая часть гидрофобных R-групп расположена внутри молекулы миоглобина и таким образом защищена от соприкосновения с водой (см. табл. 8-1, в которой перечислены аминокислоты с наиболее гидрофобными и наиболее гидрофильными R-группами, а также аминокислоты с R-гpyппами, занимающими по своим свойствам промежуточное положение).
4. Каждый из четырех остатков пролина в молекуле миоглобина находится в месте изгиба полипептидной цепи (напомним, что жесткие R-группы Пронина не могут быть уложены в а-спираль; разд. 7.7). В других местах изгиба или поворота цепи расположены остатки серина, треонина и аспарагина, т. е. такие аминокислотные остатки, которые не допускают образования а-спиральной структуры, если находятся рядом друг с другом (разд. 7.7).
Таблица 8-1. Классификация аминокислот в соответствии с их полярностью и расположением в молекулах глобулярных белков
|
Высокогидрофильные аминокислоты, почти всегда расположенные на внешней поверхности молекул глобулярных белков |
|
|
Аспарагиновая кислота |
Лизин |
|
Глутаминовая кислота |
Аргинин |
|
Аспарагин |
Гистидин |
|
Глутамин |
|
|
Высокогидрофобные аминокислоты, расположенные в основном внутри молекул глобулярных белков |
|
|
Фенилаланин |
Метионин |
|
Лейцин |
Валин |
|
Изолейцин |
Триптофан |
|
Аминокислоты, занимающие по степени полярности промежуточное положение; они могут находиться как внутри, так и на поверхности глобулярных белков |
|
|
Пролин |
Аланин |
|
Треонин |
Глицин |
|
Серин |
Тирозин |
|
Цистеин |
|
5. Все пептидные группы имеют плоскую транс-конфигурацию (разд. 7.5).
6. Плоская гемогруппа лежит в полости (кармане) вблизи поверхности молекулы. Атом железа, находящийся в центре гемогруппы, имеет две координационные связи, направленные перпендикулярно плоскости гема. Одна из них связана с R-группой остатка гистидина 93, а другая служит для связывания молекулы О2.