Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Глобулярные белки: структура и функция гемоглобина
Была установлена четвертичная структура и некоторых других олигомерных белков
Рентгеноструктурные исследования были проведены также для нескольких других олигомерных белков. В качестве примера можно привести фермент гексокиназу дрожжей, катализирующий реакцию
АТР + D-глюкоза → ADP + D-глюкозо-6-фосфат.
Эта важная реакция протекает практически во всех организмах, так как является необходимой стадией метаболизма глюкозы. Гексокиназа дрожжей имеет молекулярную массу около 102000 и содержит две полипептидные цепи. С помощью рентгеноструктурного анализа была установлена как третичная структура этих двух полипептидных цепей, так и четвертичная структура гексокиназы, образующаяся в результате соединения двух цепей в единую плотно упакованную глобулу (рис. 8-13). Особый интерес представляет строение каталитического центра этого фермента, т.е. участка молекулы. к которому одновременно присоединяются АТР и глюкоза, вовлекаемые в каталитический процесс. Как мы увидим в гл. 9, в ходе каталитического цикла конформация молекулы гексокиназы изменяет свою геометрию.
Другой олигомерный белок, структуру которого также удалось определить - это фермент лактатдегидрогеназа из скелетной мышцы, катализирующий последнюю стадию метаболического превращения глюкозы в лактат. Лактатдегидрогеназа имеет молекулярную массу 140000 и содержит четыре полипептидные цепи. По третичной структуре эти цепи очень сильно отличаются от цепей гемоглобина.
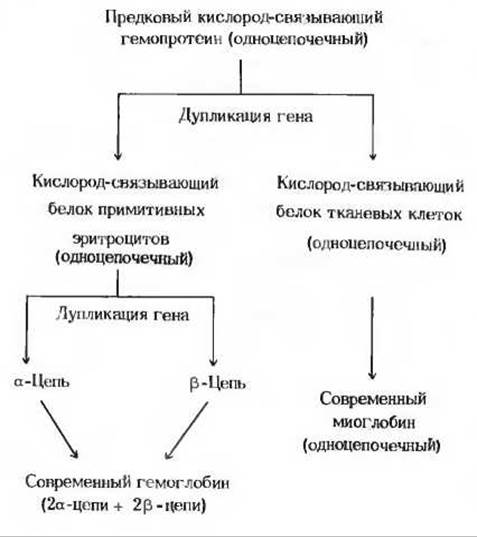
Рис. 8-12. Эволюция миоглобина и гемоглобина, возникших из предкового кислород-связывающего гемопротеина. Во всех миоглобинах, а также в а- и ß-цепях всех современных гемоглобинов (исследовано в общей сложности 145 последовательностей) имеются шесть инвариантных остатков и большое число близких по свойствам аминокислот, занимающих в этих белках одинаковые положения. Можно предположить, что ген, кодировавший предковый одноцепочечный гемопротеин, подвергся дупликации. Одна из образовавшихся копий дала начало миоглобиновому гену, а другая первоначальному гемоглобиновому гену. Оба этих гена в дальнейшем подвергались независимым мутациям. Гемоглобиновый ген мог в какой-то момент еще раз подвергнуться дупликации, в результате чего образовались современные гены а- и ß-цепей.
Кроме генов, кодирующих а- и ß-цепи нормального гемоглобина, присутствующего в крови взрослого человека, существует ген, кодирующий у-цепь, которая входит в состав гемоглобина плода. Этот гемоглобин, имеющий состав а2у2, обладает более высоким сродством к кислороду, чем гемоглобин взрослого человека. В эритроцитах взрослого организма содержится также очень небольшое количество гемоглобина с δ-цепями, имеющего состав а2δ2.
Еще один белок с установленной четвертичной структурой представляет собой фермент глутаминсинтетазу из Е. coli, катализирующий образование глутамина из глутамата и аммиака за счет энергии АТР (гл. 19). По сравнению с гемоглобином или гексокиназой это намного более сложный олигомерный белок. На рис. 8-14 показано взаимное расположение 12 субъединиц глутамин-синтетазы.
Эти три олигомерных белка - три фермента - имеют с гемоглобином одно общее свойство. Все они участвуют в биологической регуляции того или иного типа, и в этом состоит неотъемлемая часть их функции. Гексокиназа, лактатдегидрогеназа и глутаминсинтетаза из Е. coli - представители особого класса ферментов, носящих название регуляторных ферментов. Как мы увидим в следующей главе, они не только катализируют специфические реакции, но и помогают регулировать скорость того метаболического пути, в котором принимают участие как катализаторы. Гемоглобин тоже играет регуляторную роль. Он не только переносит кислород из легких к периферическим тканям, но и регулирует связывание кислорода в легких и высвобождение его в тканях в ответ на определенные сигналы, в частности на изменение величины pH и концентрации СО2. Такая регуляторная функция свойственна, по-видимому, многим олигомерным ферментам.
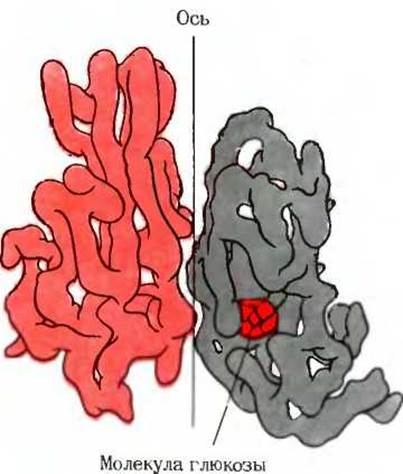
Рис. 8-13. Структура олигомерного белка гексокиназы. выделенного из дрожжей. Две субъединицы белка связаны винтовой осью симметрии. Если повернуть молекулу на 180 вокруг вертикальной оси и одновременно поднять ее вверх, то нижняя субъединица совместится с контуром верхней субъединицы. Гексокиназа регуляторный фермент, контролирующий скорость вовлечения глюкозы в процессы клеточного метаболизма. Правая субъединица содержит молекулу глюкозы, связанную с каталитическим центром фермента. Другое изображение гексокиназы представлено на рис. 12 к дополнению 9-4 в гл. 9.
Теперь мы рассмотрим гемоглобин более подробно и попытаемся выяснить, чем определяется его способность переносить кислород из легких в ткани, а ионы Н+ и молекулы СО2 - из тканей в легкие. Мы увидим, каким образом четвертичная структура гемоглобина помогает регулировать выполнение этих важных транспортных функций. Гемоглобин представляет собой прототип или модель многих других регуляторных олигомерных белков.
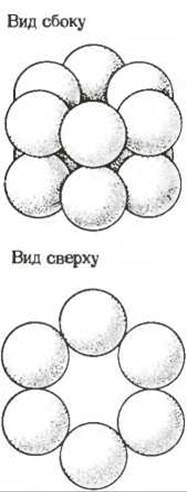
Рис. 8-14. Субъединичная структура глутаминсинтетазы Е. coli. Этот регуляторный фермент состоит из 12 субъединиц, взаимное расположение которых показано на рисунке.