Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Глобулярные белки: структура и функция гемоглобина
Гемоглобин служит также переносчиком СО2 и ионов Н+
Кроме переноса кислорода от легких к тканям гемоглобин осуществляет перенос двух конечных продуктов тканевого дыхания, Н+ и СО2, доставляемых из тканей к легким и почкам-двум органам, обеспечивающим выделение этих продуктов. В клетках периферических тканей органическое топливо окисляется в митохондриях с использованием кислорода, доставляемого гемоглобином из легких; при этом в качестве продуктов образуются углекислый газ, вода и другие соединения. Образование СО2 приводит к повышению в тканях концентрации ионов Н+ (т. е. к понижению pH), поскольку при гидратации СО2 образуется Н2СО3-слабая кислота, диссоциирующая на ионы Н+ и бикарбонат-ионы
Н2СО3⇄ Н+ + НСО-3.
Гемоглобин переносит значительную долю (около 20%) общего количества СО2 и ионов Н+, образующихся в тканях и поступающих в легкие и почки.
Много лет назад было обнаружено, что на связывание кислорода гемоглобином очень сильное влияние оказывает pH и концентрация СО2: связывание СО2 и ионов Н+ снижает способность гемоглобина связывать О2. В периферических тканях с относительно низким значением pH и высокой концентрацией СО2 сродство гемоглобина к кислороду падает по мере связывания СО2 и ионов Н+. И наоборот, в легочных капиллярах выделение СО2 и сопутствующее ему повышение pH крови приводит к увеличению сродства гемоглобина к кислороду. Это влияние величины pH и концентрации СО2 на связывание и освобождение кислорода гемоглобином называют эффектом Бора в честь датского физиолога Христиана Бора, впервые открывшего этот эффект.
Эффект Бора обусловлен реакцией, в которой помимо кислорода участвуют еще два лиганда, способные связываться с гемоглобином, а именно ионы Н+ и СО2. Реакция связывания кислорода гемоглобином в том виде, в каком мы ее до сих пор записывали:
Нb + O2⇄ HbO2,
в действительности отражает неполную картину. Чтобы объяснить влияние концентрации ионов Н+ на связывание кислорода гемоглобином, мы должны записать эту реакцию в иной форме:
ННb+ + O2 ⇄ HbO2 + Н+,
где ННb+ - протонированная форма гемоглобина. Из этого уравнения следует, что кривая насыщения гемоглобина кислородом зависит от концентрации ионов Н+ (рис. 8-17). Гемоглобин связывает и кислород, и ионы Н+, но между этими двумя процессами существует обратная зависимость. Если парциальное давление кислорода велико, что наблюдается, например, в легких, то гемоглобин связывает его, освобождая при этом ионы Н+. При низком парциальном давлении кислорода, что имеет место в тканях, связываться с гемоглобином будут ионы Н+. Однако ионы Н+ и кислород связываются с разными участками молекулы гемоглобина. Кислород связывается с атомами железа в гемах, а ионы Н+ -с R-группами остатков гистидина-146 в ß-цепях и с двумя другими остатками в ot- цепях. Таким образом, четыре полипептидные цепи гемоглобина передают друг другу информацию не только о связывании кислорода гемогруппами, но и о связывании ионов Н+ специфическими аминокислотными остатками.
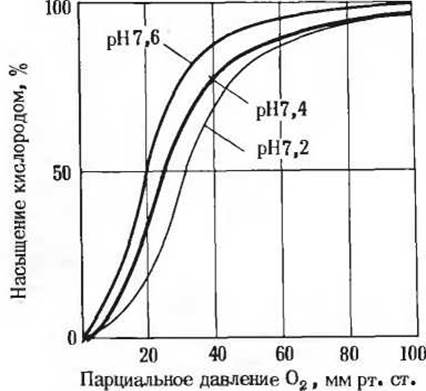
Рис. 8-17. Влияние pH на кривую насыщения гемоглобина кислородом. При низком значении pH, характерном для тканей (pH 7,2), кислород освобождается легче, чем при более высоком значении (pH 7,6), характерном для легких, где кислород легче связывается.
Но это еще не все, так как гемоглобин связывает, кроме того, и углекислый газ, причем опять-таки этот процесс находится в обратной зависимости от связывания кислорода. СO2 присоединяется к концевой а-аминогруппе каждой из четырех полипептидных цепей, в результате чего образуется карбаминогемоглобин
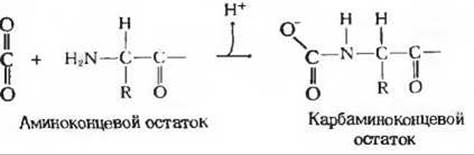
При высоких концентрациях СO2. наблюдающихся в тканях, часть СO2 связывается с гемоглобином и его сродство к O2 снижается, что приводит к освобождению О2. И наоборот, когда в легких с гемоглобином связывается O2, уменьшается сродство гемоглобина к СO2. Из сказанного следует, что кривая насыщения гемоглобина кислородом зависит как от pH, так и от концентрации СO2. Такая обратная зависимость между связыванием O2, с одной стороны, и связыванием СO2 и ионов Н+ с другой, дает организму большие преимущества. В тканях при низких pH и высоких концентрациях СO2 кислород обычно освобождается из гемоглобина, тогда как в легких высокая концентрация кислорода способствует выделению СO2 и ионов Н+. Таким образом, благодаря способности молекулы гемоглобина передавать информацию о связывании лигандов от одной полипептидной субъединицы к другой па молекула оказывается великолепно приспособленной к осуществлению совместного переноса эритроцитами O2, СO2 и ионов Н+.
Но теперь снова возникает ряд вопросов. В чем состоит особенность структуры гемоглобина, обеспечивающая эти выгодные для организма изменения сродства гемоглобина к кислороду, находящиеся в обратной зависимости от его сродства к СO2 и ионам Н+? Как информация о связывании лиганда передается от одной полипептидной субъединицы гемоглобина к другой? Почему гемоглобин обладает такими свойствами, а миоглобин нет?