Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Ферменты
Ферменты можно ингибировать определенными химическими соединениями
Действие большинства ферментов можно подавить, или ингибировать, определенными химическими реагентами. Изучение ингибиторов ферментов позволяет получать ценные сведения о субстратной специфичности ферментов, природе функциональных групп активного центра и механизмах каталитической активности ферментов. Ингибиторы ферментов служат также очень полезными инструментами при исследовании метаболических путей в клетках. Более того, механизм действия некоторых лекарственных препаратов состоит именно в том, что они ингибируют определенные ферменты в клетках с нарушенными функциями.
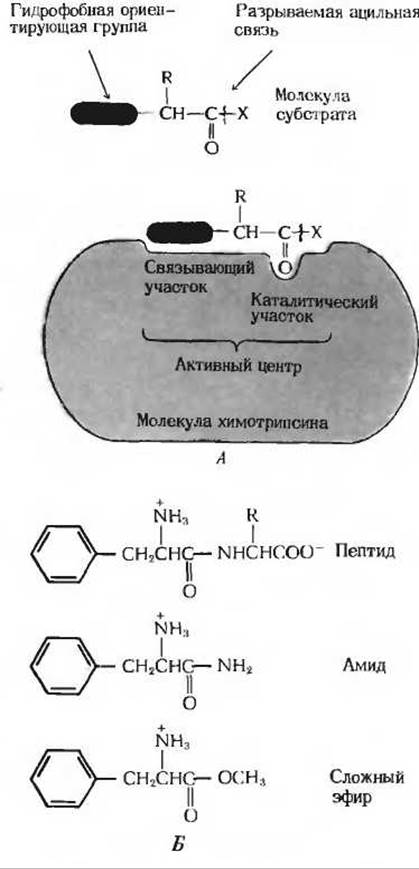
Рис. 9-9. Субстратная специфичность химотрипсина. А. Хотя в биологических системах химотрипсин действует как пептидаза, он способен гидролизовать также амиды, сложные эфиры и некоторые синтетические соединения небиологического происхождения, если у них есть чувствительная к действию фермента связь и ориентирующая гидрофобная группа. Б. Некоторые синтетические соединения, гидролизуемые химотрипсином. У каждого из них есть гидрофобная ориентирующая группа и подверженная расщеплению ацильная связь (обе показаны красным цветом).
Существуют ингибиторы двух основных типов: необратимые и обратимые. Необратимые ингибиторы связывают или разрушают функциональную группу молекулы фермента, необходимую для проявления его каталитической активности. Примером необратимого ингибитора может служить соединение биизопропилфторфосфат (ДФФ), которое ингибирует фермент ацетилхолиностеразу, играющий важную роль в передаче нервных импульсов. Ацетилхолиностераза катализирует гидролиз ацетилхолина (рис. 9-10), функционирующего в качестве нейтромедиатора в определенных отделах нервной системы. Ацетилхолин выделяется стимулированной нервной клеткой (нейроном) в синапс, т.е. место соединения одного нейрона с другим. В синапсе ацетилхолин связывается с рецепторами следующего нейрона, вынуждая его проводить нервный импульс. Однако, прежде чем второй импульс будет передан через синапс следующему нейрону, ацетилхолин, выделившийся после первого импульса, должен быть гидролизован ацетилхолинэстеразой в месте соединения нервных клеток. Продукты его распада - ацетат и холин - не способны действовать как нейромедиаторы (рис. 9-10). Необратимый ингибитор ДФФ, обладающий высокой реакционной способностью, присоединяется к гидроксильной группе остатка серина в активном центре ацетилхолинэстеразы, что приводит к образованию каталитически неактивного производного. В результате фермент перестает функционировать. ДФФ, одно из первых отравляющих веществ нервно-паралитического действия. в опытах на животных вызывает нарушение некоторых функций вследствие того, что пораженные нейроны утрачивают способность проводить нервные импульсы. Однако ДФФ обладает и полезными свойствами. На его основе был создан ряд относительно нетоксичных для людей и животных инсектицидов, например малатион. Сам по себе малатион неактивен и в организме высших животных разлагается на продукты, которые считаются безвредными. В организме же насекомых малатион превращается под действием ферментов в активный ингибитор их собственной ацетилхолинэстеразы.
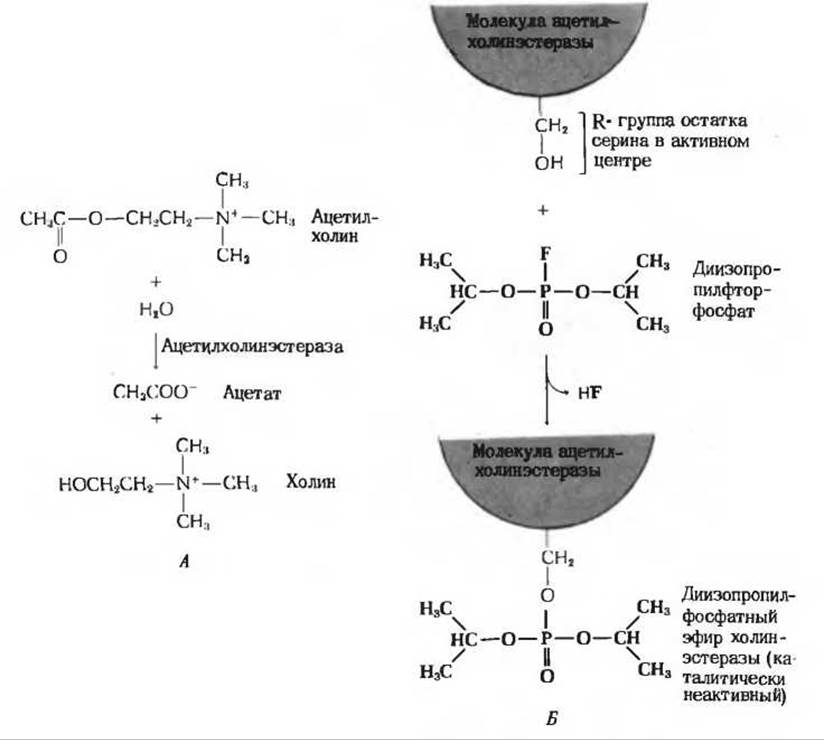
Рис. 9-10. Необратимое ингибирование ацетилхолинэстеразы диизопропилфторфосфатом. А. Реакция, катализируемая ацетилхолинэстеразой. Б. Реакция между диизопропилфторфосфатом и гидроксильной группой серина.
Выяснилось, что ДФФ ингибирует целый класс ферментов, многие из которых способны катализировать гидролиз пептидов или эфирных связей. К этим ферментам относится не только ацетил-холинэстераза, но и трипсин, химотрипсин, эластаза, фосфоглюкомутаза и коконаза (фермент, выделяемый личинкой тутового шелкопряда и используемый ею для гидролиза шелковых нитей и освобождения из кокона). Характерная особенность всех ферментов, ингибируемых ДФФ, состоит в том, что они содержат в активном центре остаток серина, принимающий участие в каталитическом акте (рис. 9-10).
Другой необратимый ингибитор некоторых ферментов, иодацетамид (рис. 9-11), может взаимодействовать с сульфгидрильными (—SH) группами остатков цистеина или с имидазольными группами остатков гистидина, содержащихся в активных центрах этих ферментов. С помощью таких ингибиторов было установлено, что гидроксильная группа серина, тиоловая группа цистеина и имидазольная группа гистидина участвуют в каталитической активности ферментов, принадлежащих к разным классам.