Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Ферменты
Существуют обратимые ингибиторы двух типов - конкурентные и неконкурентные
Изучение обратимых ингибиторов ферментов также позволило получить весьма важные сведения о структуре активных центров различных ферментов.
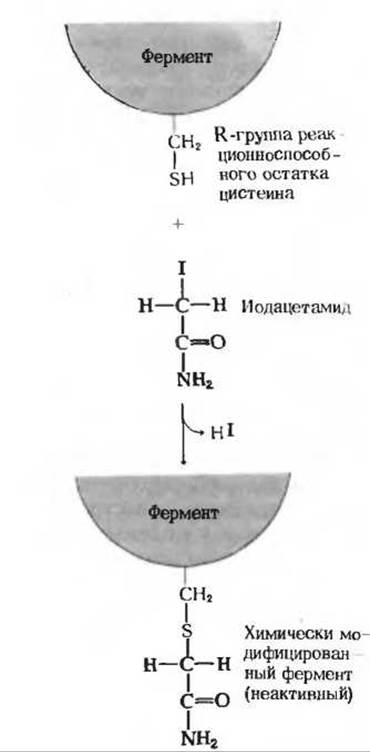
Рис. 9-11. Необратимое ингибирование SH-фермента иодацетамидом.
Конкурентный ингибитор конкурирует с субстратом за связывание с активным центром, но в отличие от субстрата связанный с ферментом конкурентный ингибитор не подвергается ферментативному превращению. Отличительная особенность конкурентного ингибирования состоит в том, что его можно устранить или ослабить, просто повысив концентрацию субстрата. Например, если при заданных концентрациях субстрата и конкурентного ингибитора активность фермента подавлена на 50%, то мы можем уменьшить степень ингибирования, повысив концентрацию субстрата.
По своей трехмерной структуре конкурентные ингибиторы обычно напоминают субстрат данного фермента. Благодаря такому сходству конкурентному ингибитору удается «обмануть» фермент и связаться с ним. Конкурентное ингибирование можно количественно изучать на основе теории Михаэлиса-Ментен. Конкурентный ингибитор I просто обратимо присоединяется к ферменту Е, образуя с ним комплекс
Е + 1 ⇄ ЕІ.
Однако в отличие от субстрата ингибитор не подвергается действию фермента и новые продукты реакции не образуются.
Классическим примером конкурентного ингибирования служит ингибирование сукцинатдегидрогеназы анионом малоновой кислоты (рис. 9-12). Сукцинатдегидрогеназа входит в состав группы ферментов, катализирующих реакции цикла трикарбоновых кислот-конечный метаболический путь окислительного разрушения углеводов и жиров в митохондриях. Этот фермент катализирует отщепление двух атомов водорода от сукцината - по одному от каждой из двух метиленовых (—СН2 —) групп. Сукцинатдегидрогеназа ингибируется малонатом, который напоминает сукцинат тем, что он также содержит две карбоксильные группы, принимающие при pH 7,0 ионизированную (депротонированную) форму. Однако он отличается от сукцината тем, что в его молекуле имеется только три атома углерода. Сукцинатдегидрогеназа не способна отщеплять водород от малоната, но малонат занимает активный центр фермента, не давая ему возможности взаимодействовать с нормальным субстратом. Малонат является обратимым ингибитором, так как повышение концентрации сукцината при заданной концентрации малоната снижает степень ингибирования фермента.
В качестве конкурентных ингибиторов сукцинатдегидрогеназы могут выступать и другие соединения, содержащие две отрицательно заряженные группы, расположенные на соответствующем расстоянии друг от друга. К ним относится, например, оксалоацетат - промежуточный продукт в цикле трикарбоновых кислот (рис. 9-12). Изучение структурных особенностей всех этих ингибиторов позволило сделать вывод, что в каталитическом центре сукцинатдегидрогеназы находятся две определенным образом расположенные в пространстве положительно заряженные группы, способные притягивать две отрицательно заряженные карбоксильные группы сукцинат-аниона. Таким образом, каталитический центр сукцинатдегидрогеназы оказывается комплементарным структуре своего субстрата (рис. 9-12).
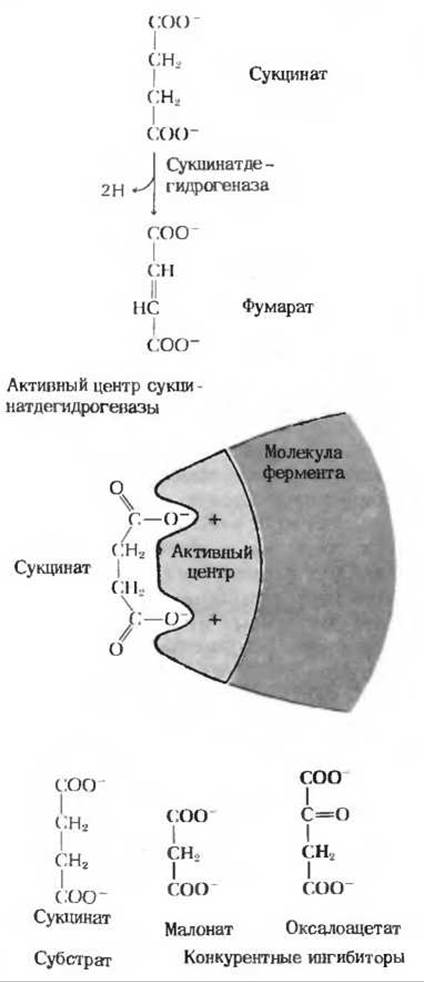
Рис. 9-12. Реакция, катализируемая сукцинат дегидрогеназой, и ее конкурентное ингибирование. Обратите внимание, что конкурентные ингибиторы напоминают в структурном отношении сукцинат: они содержат две определенным образом расположенные в пространстве отрицательно заряженные группы, которые соответствуют конформации активного центра.
Конкурентное ингибирование проще всего можно распознать экспериментальным путем, определив влияние концентрации ингибитора на зависимость начальной скорости реакции от концентрации субстрата. Для выяснения вопроса о том, по какому типу - конкурентному или неконкурентному - происходит обратимое ингибирование фермента (дополнение 9-3), весьма удобно преобразовать уравнение Михаэлиса - Ментен в линейную форму. Чаще всего для этой цели используют метод двойных обратных величин. Из графиков, построенных в двойных обратных координатах, можно определить также значение константы диссоциации комплекса фермент ингибитор. Для реакции диссоциации
EІ ⇄ Е + I
константа диссоциации равна
![]()