Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Ферменты
Неконкурентное ингибирование тоже обратимо, но не может быть ослаблено или устранено повышением концентрации субстрата
В случае неконкурентного ингибирования ингибитор присоединяется к ферменту не в активном центре, где связывается субстрат, а совсем в другом месте. При этом конформация молекулы фермента изменяется таким образом, что происходит обратимая инактивация его каталитического центра. Неконкурентные ингибиторы связываются обратимо как со свободным ферментом, так и с комплексом ES, образуя неактивные комплексы EI и ESI.
Е + I ⇄ EI,
ES + I ⇄ ESI.
Использование графиков, построенных в двойных обратных координатах для анализа данных, полученных при исследовании ингибирования ферментативных реакций, позволяет легко отличать конкурентные ингибиторы от неконкурентных. Проводятся две серии опытов по определению скорости реакции при одной и той же концентрации фермента. В одной серии концентрация субстрата тоже остается постоянной и соответствующими экспериментальными методами определяется влияние повышения концентрации ингибитора на начальную скорость реакции v0. В другой серии, наоборот, концентрация ингибитора поддерживается постоянной, но используются разные концентрации субстрата. На основе данных, полученных в опытах той и другой серии, строят графики в координатах {1 / [S]; 1/v0}.
На рис. 1 представлены такие графики, полученные в отсутствие ингибитора и при двух разных концентрациях конкурентного ингибитора. В случае конкурентных ингибиторов получается семейство прямых с разными углами наклона, пересекающихся в одной точке на оси 1/v0. Поскольку отрезок, отсекаемый на оси 1/v0, численно равен величине 1/Vmах, ясно, что Vmах не изменяется в присутствии конкурентных ингибиторов. Это означает, что независимо от концентрации конкурентного ингибитора всегда можно подобрать достаточно высокую концентрацию субстрата, при которой субстрат вытеснит конкурентный ингибитор из активного центра.
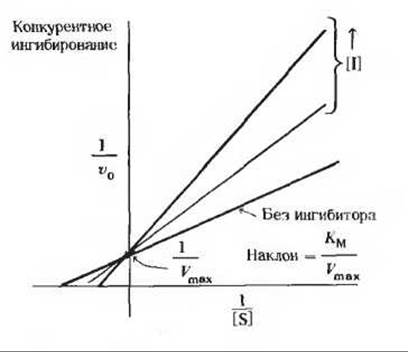
Рис. 1.
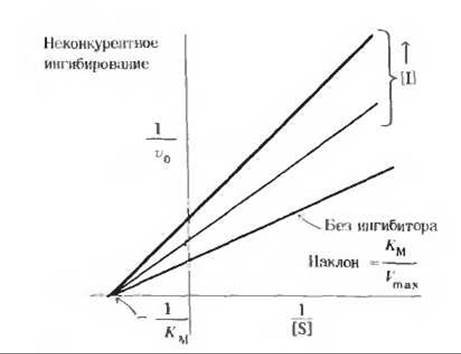
Рис. 2.
Дополнение 9-3. Кинетические тесты, позволяющие отличать конкурентное ингибирование от неконкурентного
При неконкурентном ингибировании аналогичные графики представляют собой семейство прямых (рис. 2), пересекающихся с осью 1 /[S] в одной точке и отсекающих на ней отрезок, численно равный 1/КМ. Это свидетельствует о том, что величина Км не изменяется при изменении концентрации неконкурентного ингибитора, тогда как величина Vmaxпри этом уменьшается.
Неконкурентное ингибирование фермента можно отличить от конкурентного путем анализа кинетических данных, выраженных графически в двойных обратных координатах, как показано в дополнении 9-3.
Наиболее важные неконкурентные ингибиторы представляют собой образующиеся в живых организмах промежуточные продукты метаболизма, способные обратимо связываться со специфическими участками на поверхности некоторых регуляторных ферментов и изменять при этом активность их каталитических центров. Примером может служить ингибирование L-треониндегидратазы L-изолейцином, обсуждаемое в разд. 9.18.