Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Ферменты
Факторы, определяющие каталитическую эффективность ферментов
Ферменты повышают скорости катализируемых ими реакций в 108-1020 раз. Например, уреаза ускоряет гидролиз мочевины в 1014 раз при pH 8 и 20°С. Как же удается ферментам проявлять такую необычайно высокую каталитическую активность в столь мягких условиях?
Существуют четыре основных фактора (табл. 9-7), определяющих способность ферментов ускорять химические реакции.
Сближение и ориентация. Фермент способен связывать молекулу субстрата таким образом, что атакуемая ферментом связь оказывается не только расположенной в непосредственной близости от каталитической группы, но и правильно ориентированной по отношению к ней. В результате вероятность того, что комплекс ES достигнет переходного состояния, сильно увеличивается (рис. 9-13).
Таблица 9-7. Факторы, влияющие на каталитическую эффективность ферментов

Напряжение и деформация: индуцированное соответствие. Присоединение субстрата может вызывать конформационные изменения в молекуле фермента, которые приводят к напряжению структуры активного центра, а также несколько деформируют связанный субстрат, облегчая тем самым достижение комплексом ES переходного состояния.
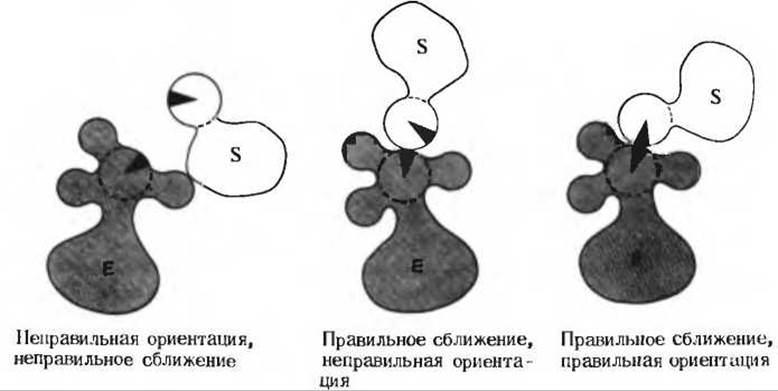
Рис. 9-13. Схематическое изображение процессов сближения и ориентации при взаимодействии молекулы субстрата S с каталитической группой в активном центре фермента Е.
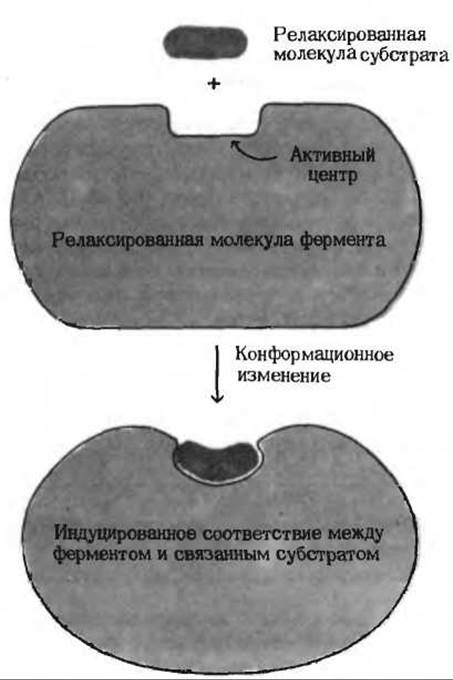
Рис. 9-14. Индуцированное соответствие между активным центром фермента и напряженной формой молекулы субстрата.
При этом возникает так называемое индуцированное соответствие фермента субстрату (рис. 9-14). Таким образом, небольшие изменения третичной или четвертичной структуры относительно крупной молекулы фермента могут играть роль механического рычага для молекулы субстрата. Возможно, что именно по этой причине ферменты представляют собой белки и, следовательно, по своим размерам значительно превосходят молекулы большинства субстратов.
Общий кислотно-основный катализ. В активном центре фермента могут находиться группы специфических аминокислотных остатков, которые являются хорошими донорами или акцепторами протонов (рис. 9-15). Такие кислотные или основные группы общего типа представляют собой мощные катализаторы многих органических реакций, протекающих в водных системах.
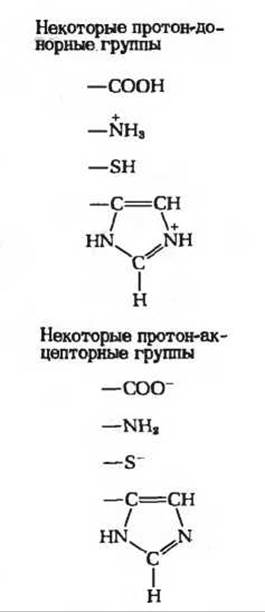
Рис. 9-15. Многие органические реакции ускоряются донорами или акцепторами протонов, т.е. обобщенными кислотами или основаниями. Активные центры ряда ферментов содержат функциональные группы аминокислотных остатков, принимающие участие в каталитических процессах в качестве доноров или акцепторов протонов. Здесь показаны некоторые из этих групп. —SH-гpyппa принадлежит цистеину, имидазольная группа - гистидину.
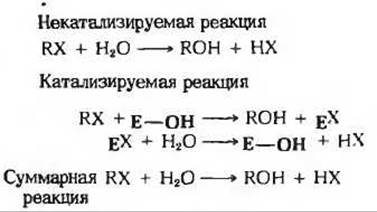
Рис. 9-16. Одна из моделей ковалентного катализа. В некоторых ферментативных реакциях фермент замещает функциональную группу R в субстрате RX, в результате чего образуется ковалентный комплекс ЕХ. Он нестабилен и гидролизуется значительно быстрее, чем RX. К ферментам, осуществляющим ковалентный катализ, относится химотрипсин (дополнение 9-4, Б).
Ковалентный катализ. Некоторые ферменты реагируют со своими субстратами, образуя очень нестабильные, ковалентно связанные фермент-субстратные комплексы, из которых в ходе последующей реакции образуются продукты реакции, причем значительно быстрее, чем в случае некатализируемых реакций (рис. 9-16).
Перечисленные выше четыре фактора, по-видимому, вносят различный вклад в ускорение химических реакций ферментами разных типов, однако ни для одного фермента пока не известно точного механизма, обеспечивающего ускорение той или иной специфической для него реакции.