Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Ферменты
Рентгеноструктурный анализ выявил важные структурные особенности ферментов
Метод рентгеноструктурного анализа позволил получить много важных сведений о структуре и каталитических механизмах ферментов (разд. 8-2-8-4). Он был использован для изучения целого ряда кристаллических ферментов. Результаты этих исследований дополнили информацию, полученную при химическом изучении ферментов. О некоторых наиболее важных успехах в этой области, достигнутых благодаря рентгеноструктурному анализу, речь пойдет в дополнении 9-4, в котором представлена целая «галерея» структур ферментов.
Дополнение 9-4. Структура некоторых ферментов, определенная с помощью дифракции рентгеновских лучей.
Методом рентгеноструктурного анализа было исследовано большое число кристаллических ферментов. Результаты таких исследований часто сопоставляются с данными, полученными химическими методами при 1) определении аминокислотной последовательности ферментов, 2) изучении их субстратной специфичности, 3) исследовании действия специфических ингибиторов и 4) идентификации специфических функциональных групп в активном центре. С целью выявления возможной связи между каталитическим действием ферментов и их третичной структурой были изучены представители большинства основных классов ферментов (см. табл. 9-3). Здесь показаны изображения (в масштабе) молекул трех ферментов, иллюстрирующие некоторые их структурные и функциональные особенности, выявленные при рентгеноструктурном анализе кристаллов этих ферментов.
А. Комплекс лизоцим-субстрат
Хотя фермент-субстратные комплексы обычно неустойчивы и быстро распадаются, иногда удается синтезировать аналог субстрата (или получить химически модифицированный субстрат), который присоединяется к активному центру фермента и остается связанным с ним, но не подвергается его действию.
Такой субстрат был найден для лизоцима, гидролизующего определенные связи в цепях бактериальных полисахаридов. На рис. 1 показана (в масштабе) предполагаемая структура нормального фермент-субстратного комплекса для лизоцима. Это изображение было получено на основе данных рентгеноструктурного анализа кристаллического комплекса лизоцима и «ложного», т. е. негидролизуемого, субстрата, представляющего собой аналог обычного субстрата лизоцима. Эти исследования были проведены Дэвидом К. Филлипсом и его сотрудниками в Оксфордском университете. Полипептидная цепь, включая R-группы и атомы Н, показана красным цветом. Участок молекулы субстрата, обозначенный черными линиями, лежит в канале (или щели) молекулы лизоцима и удерживается в этом положении специфическими водородными связями (изображены ярко-красными линиями) между ферментом и субстратом. Молекула субстрата представляет собой полимер с чередующимися звеньями N-ацетилглюкозамина и N-ацетилмурамовой кислоты, имеющих циклическую форму и связанных друг с другом гликозидными связями, обозначенными A F (гл. 11). Место, в котором молекула субстрата разрывается, показано пунктирной линией.
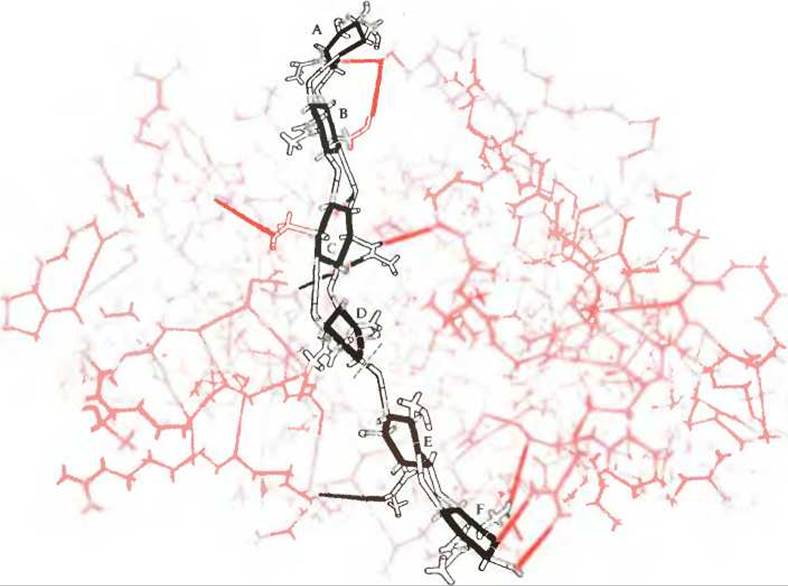
Рис. 1.
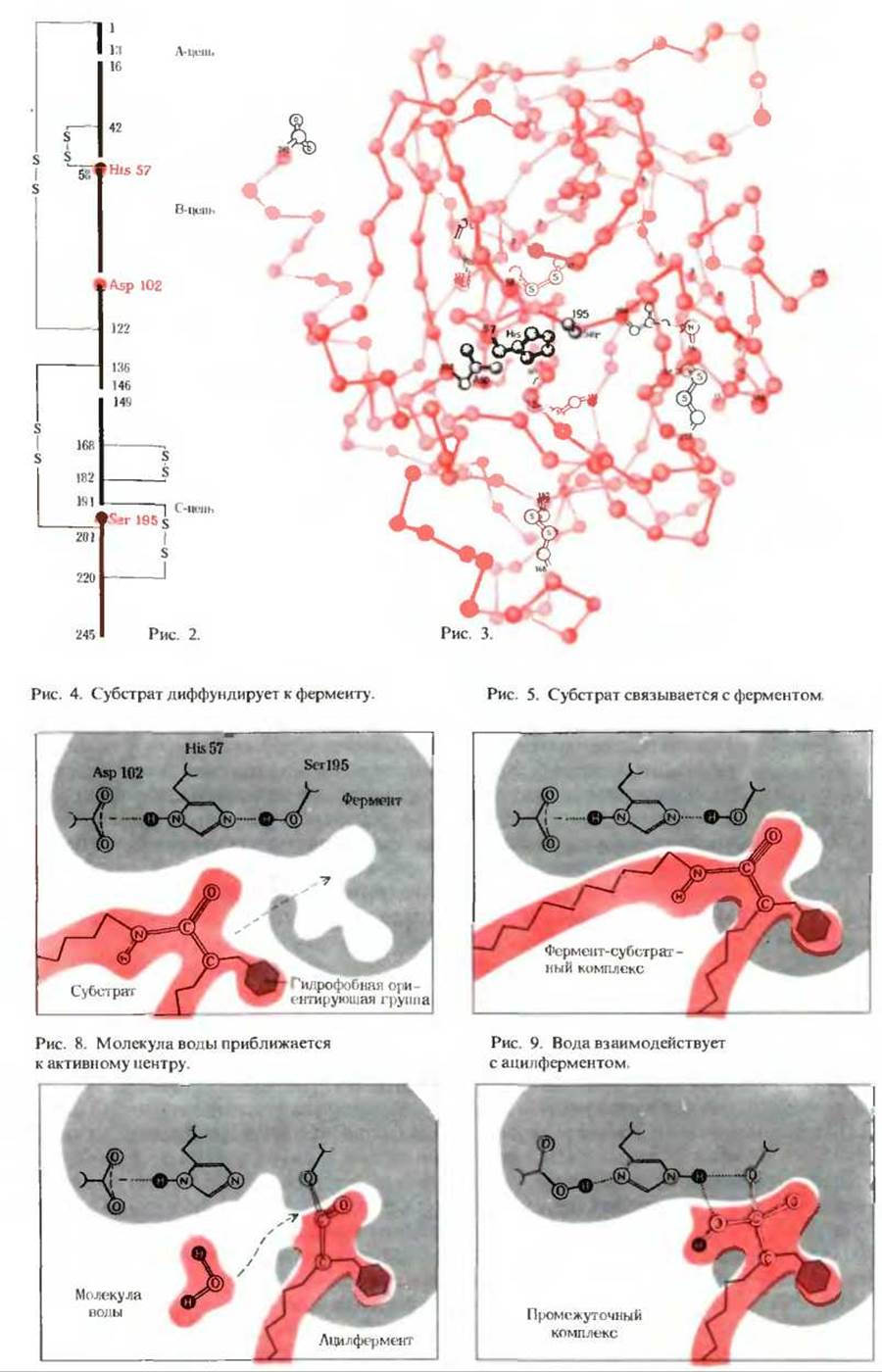
Б. Активный центр химотрипсина
Химотрипсин - это протеолитический фермент, секретируемый из поджелудочной железы в тонкий кишечник в виде неактивної о предшественника, или зимогена, называемого химотрипсиногеном. Химотрипсиноген, представляющий собой полипептидную цепь из 245 аминокислотных остатков и содержащий пять дисульфидных связей, образованных пятью остатками цистина, активируется в тонком кишечнике под действием другого протеолитического фермента-трипсина. Трипсин гидролизует четыре пептидные связи и удаляет из молекулы химотрипсиногена два дипептида в положениях 14-15 и 147-148. В результате образуется активный химотрипсин, состоящий из трех полипептидных цепей, ковалентно связанных двумя дисульфидными мостиками, один из которых соединяет А- и В-цепи, а второй - В- и С-цепи, как показано на рис. 2. Для проявления активности химотрипсина необходимы остаток гистидина 57 и остаток аспарагиновой кислоты 102 в В-цепи, а также остаток серина 195 в С-цепи. Хотя по положению в аминокислотной последовательности эти остатки находятся далеко один от другого (и даже не в одной цепи), в третичной структуре молекулы фермента они оказываются очень близко друг к другу. Это показано на масштабном изображении остова молекулы химотрипсина (рис. 3), полученном по данным рентгеноструктурного анализа кристаллического химотрипсина Дэвидом М. Блоу и его сотрудниками в Кембриджском университете. На этом рисунке изображены R-группы только трех специфических аминокислотных остатков, входящих в состав активного центра.
В. Возможный механизм гидролиза специфических пептидов химотрипсином
Исходя из того, что по данным рентгеноструктурного анализа, аминокислотные остатки His-57, Asp-102 и Ser-195 расположены в молекуле химотрипсина близко друг к другу, был предложен возможный механизм участия этих остатков в каталитическом цикле химотрипсина было высказано предположение о том, что молекула связывается с активным центром так, что ее гидрофобная ориентирующая группа плотно прилегает к внутренней поверхности гидрофобного «кармана» активного центра (рис. 4; разд. 9.11). При этом расщепляемая пептидная связь оказывается рядом с гидроксильной группой Ser-195 (рис. 5).
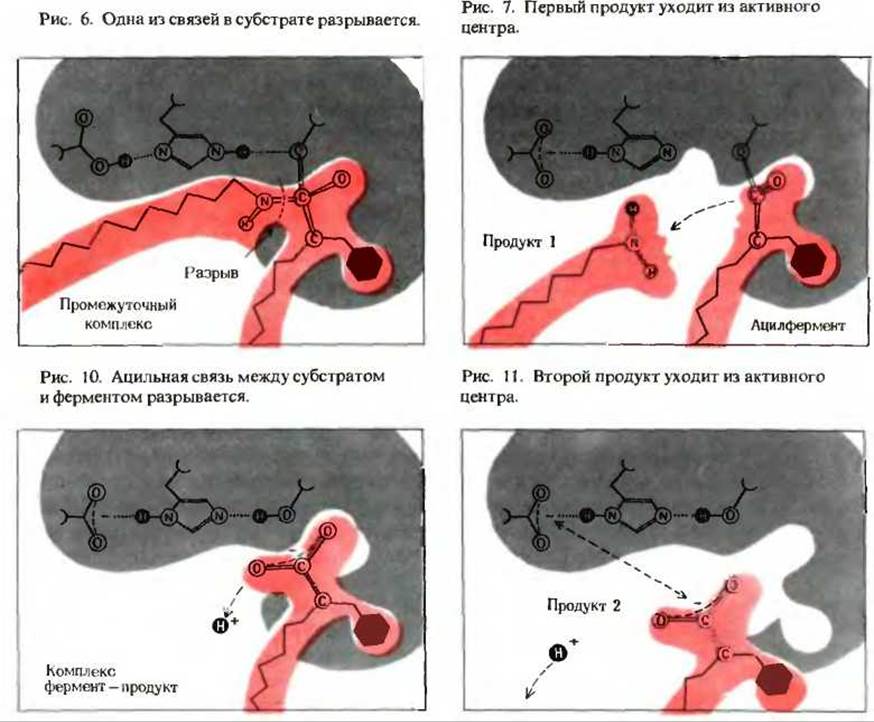
Кислород этой гидроксильной группы соединяется ковалентной сложно-эфирной связью с углеродом ацильной группы субстрата, что приводит к образованию промежуточного фермент-субстратного комплекса (рис. 6; разд. 9.15). Гидроксильная группа серина легко теряет свой атом водорода, так как он сильно притягивается водородной связью к электроотрицательному атому азота в имидазольной R-гpyппе His-57. Одновременно происходит разрыв пептидной связи, в результате чего образуется первый продукт реакции. После его выхода из активного центра ацильная группа субстрата остается ковалентно связанной с остатком серина 195 в молекуле фермента; это производное называется ацилферментом (рис. 7). Его сложно-эфирная связь очень неустойчива по сравнению с пептидной связью субстрата и гидролизуется с образованием второго продукта, представляющего собой карбоксильную часть субстрата. При этом протон вновь присоединяется к серину (рис. 8 и 9) и образуется комплекс фермент-продукт (рис. 10). Второй продукт уходит затем из активного центра, и каталитический цикл завершается (рис. 11). Ацилфермент представляет собой ключевой промежуточный комплекс в этом варианте ковалентного катализа. Имидазольная группа гистидина 57 участвует в перемещении протона по механизму общего кислотно-основного катализа.
Было высказано предположение, что роль остатка аспарагиновой кислоты 102, несущего большой отрицательный заряд, заключается в том. что он усиливает подвижность имидазольной группы гистидина 57, в результате чего последний становится способным притягивать атом водорода серина 195. Однако возникают сомнения относительно того, существует ли на самом деле такая «эстафета» электрических зарядов, поскольку аспарагиновая кислота 102 и гистидин 57 находятся слишком далеко друг от друга. Но какова бы ни была функция остатка аспарагиновой кислоты 102, ясно, что он необходим для каталитического действия фермента.
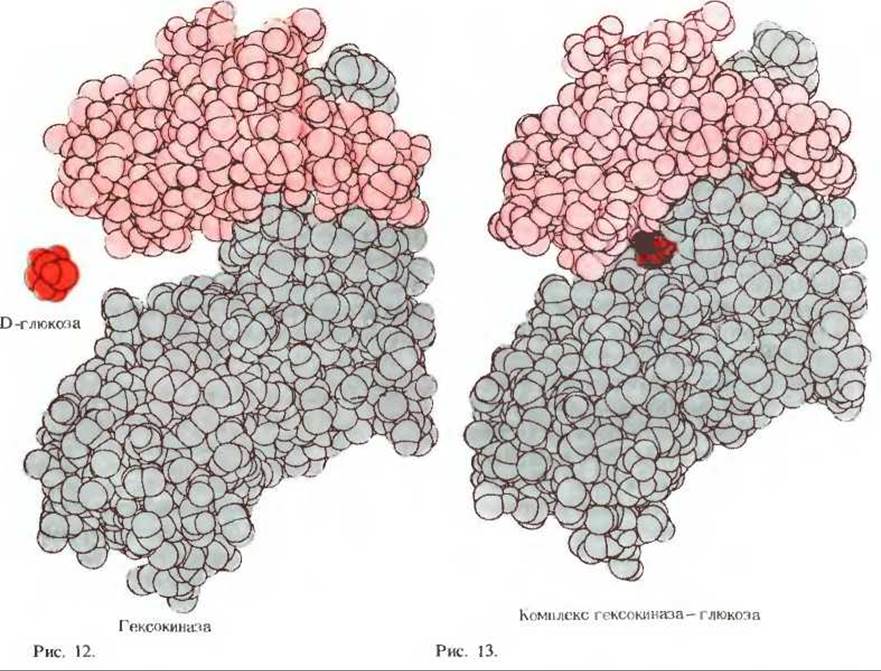
Г. Индуцированное соответствие между молекулой гексокиназы и одним из ее субстратов - D-глюкозой
Гексокиназа, катализирующая фосфорилирование D-глюкозы и других гексоз в реакции с АТР
АТР + D-глюкоза -> ADP + D-глюкозо-б-фосфат,
состоит из двух полипептидных субъединиц, как показано на масштабном изображении пространственной модели ее молекулы (рис. 12). Рядом с «пустой» молекулой гексокиназы изображена также свободная молекула D-глюкозы (темно-красный цвет). Когда молекула D-глюкозы связывается с активным центром фермента в отсутствие второго субстрата, т.е. АТР. обе субъединицы гексокиназы сближаются, так что молекула глюкозы оказывается в «кармане» активного центра (рис. 13). При этом в четвертичной структуре фермента происходят довольно существенные изменения, так как при образовании комплекса гексокиназа - глюкоза в отсутствие АТР гексокиназа подвергается «вынужденной подгонке» к молекуле субстрата. Этот комплекс достаточно стабилен, и его удалось получить в кристаллическом виде. Ренгеноструктурный анализ этого комплекса был проведен Томасом А. Стейцем из Йельского университета. Если одновременно присутствуют и АТР и глюкоза, они связываются со своими специфическими центрами, после чего происходит каталитическая реакция с образованием и последующим освобождением ADP и глюкозо-6-фосфата. Фермент при этом вновь принимает первоначальную конформацию, чтобы начать новый каталитический цикл.
Прежде всего рентгеноструктурный анализ позволяет определить вторичную, третичную и четвертичную структуры молекул различных ферментов, что дает возможность сравнивать их с соответствующими структурами некаталитических глобулярных белков. Такие сравнения не выявили никаких специфических особенностей в трехмерной структуре ферментов, по которым они отличались бы от некаталитических белков. Однако ферменты, принадлежащие к одному классу (например, ферменты, катализирующие перенос фосфатных групп от АТР на молекулы, играющие роль акцепторов фосфата) могут обладать какими- то общими для всех них структурными особенностями.
Кроме того, благодаря рентгеноструктурному анализу были идентифицированы активные центры многих ферментов. Активный центр часто представляет собой щель (или углубление) на поверхности молекулы фермента; по своей форме эта щель оказывается комплементарной входящей в нее молекуле субстрата. У одних ферментов активные центры выстланы петлями полипептидных цепей, находящихся в ß-конформации, а у других они имеют форму «кармана», внутреннюю поверхность которого образуют аминокислотные остатки с заряженными полярными группами. В некоторых случаях рентгеноструктурный метод позволил определить структуру фермент-субстратного комплекса. Примером может служить фермент лизоцим (дополнение 9-4, А), разрывающий определенные связи в остове бактериальных полисахаридов.
Благодаря сочетанию рентгеноструктурных и химических исследований была выяснена детальная топография активного центра химотрипсина, состоящего из трех полипептидных цепей, соединенных друг с другом дисульфидными связями остатков цистина (дополнение 9-4, Б). Химические исследования показали, что при инактивации химотрипсина диизопропилфторфосфатом образуется ковалентное производное остатка серина в положении 195 полипептидной цепи; отсюда следует, что этот остаток входит в состав активного центра. По данным других химических исследований, остаток гистидина в положении 57 и остаток аспарагиновой кислоты в положении 102 также участвуют в каталитическом процессе. Хотя эти остатки занимают в полипептидном остове положения, находящиеся далеко друг от друга, и даже в разных полипептидных цепях, данные рентгеноструктурного анализа свидетельствуют о том, что в трехмерной структуре свернутой нативной молекулы химотрипсина (дополнение 9-4, Б) они расположены в пространстве очень близко друг к другу. Эти точные данные о структуре химотрипсина в сочетании с результатами химических исследований фермента позволили предложить ряд механизмов каталитического действия химотрипсина (дополнение 9-4, Б), а также исключить некоторые другие механизмы, не соответствующие данным о структуре активного центра. Хотя до сих пор точно не известно во всех деталях, как функционирует химотрипсин, механизм его действия мы понимаем лучше, чем механизм действия любого другого фермента.
Рентгеноструктурные исследования выявили еще одну важную особенность механизма действия ферментов, а именно возникновение конформационных изменений в молекуле фермента в процессе присоединения к ней субстрата и последующего их взаимодействия. Яркий пример этого - гексокиназа (разд. 9-3), катализирующая фосфорилирование D-глюкозы в реакции с АТР. Как описано в дополнении 9-4, Г, присоединение относительно небольшой молекулы глюкозы к активному центру гексокиназы приводит к сближению полипептидных цепей двух субъединиц, которые, как клещи, захватывают молекулу глюкозы и подготавливают ее для атаки со стороны молекулы АТР. По-видимому, при такой индуцированной «подгонке» конформации фермента к структуре субстрата молекула глюкозы деформируется и ее структура приближается к структуре переходного состояния.