Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Ферменты
Аллостерические ферменты регулируются путем нековалентного присоединения к ним молекул модуляторов
В некоторых мультиферментных системах первый (регуляторный) фермент отличается характерной особенностью: он ингибируется конечным продуктом мультиферментной системы. Как только концентрация конечного продукта такой последовательности метаболических реакций превысит его обычную стационарную концентрацию, т. е. он будет произведен в большем количестве, чем нужно клетке, конечный продукт начинает действовать как специфический ингибитор первого, или регуляторного, фермента. В результате функционирование всей ферментной системы в целом замедляется, для того чтобы вновь привести скорость выработки конечного продукта в соответствие с потребностями клетки. Регуляция такого типа называется ингибированием по принципу обратной связи или ретроингибированием. Классическим примером подобного аллостерического ингибирования может служить бактериальная ферментная система, катализирующая превращение L-треонина в L-изолейцин - процесс, включающий пять ферментативных реакций (рис. 9-18). Эта система относится к числу тех ферментных систем, в которых впервые было обнаружено ингибирование по принципу обратной связи. Фермент, катализирующий первую реакцию указанного процесса, треониндегидратаза, ингибируется продуктом последней реакции-изолейцином, выступающим в качестве высокоспецифического ингибитора. Ни один из промежуточных продуктов этой цепи реакций не ингибирует треониндегидратазу, и ни один другой фермент цепи не ингибируется изолейцином. Ингибирование по принципу обратной связи - это один из нескольких известных типов аллостерической регуляции.
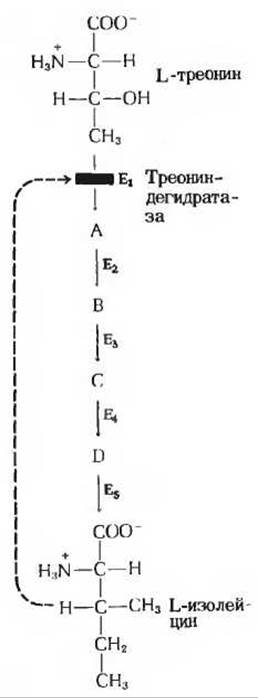
Рис. 9-18. Ингибирование по принципу обратной связи процесса превращения L-треоиина в L-изолейцин, происходящего в ходе пяти последовательных реакций, катализируемых пятью ферментами (Е1 - Е5), через образование четырех промежуточных продуктов А, В, С и D. Первый фермент, треониидегидратаза (Е1), специфически ингибируется L-изолейцином - конечным продуктом всей последовательности реакций, но не ингибируется ни одним из промежуточных соединений (А, В, С и D). Такое ингибирование обозначено пунктирной линией и красной полоской, пересекающей стрелку, указывающую направление реакции, катализируемой треониндегидратазой.
Ингибирование треониндегидратазы изолейцином обратимо; при повышении концентрации изолейцина активность фермента возрастает. Таким образом, треониндегидратазная активность очень быстро и обратимо изменяется в зависимости от концентрации изолейцина в клетке. Хотя изолейцин представляет собой весьма специфический ингибитор треониндегидратазы, он не связывается с субстратным центром фермента. Вместо этого молекула изолейцина присоединяется к другому специфическому участку на поверхности молекулы фермента, который называется регуляторным центром. Взаимодействие изолейцина с регуляторным центром треониндегидратазы не сопровождается образованием ковалентных связей и потому легко обратимо. Треониндегидратаза - типичный представитель класса аллостерических, или регуляторных, ферментов, которые осуществляют свои функции путем обратимого нековалентного связывания с молекулой модулятора. Термин «аллостерический» происходит от греческих слов alio и stereos, означающих соответственно «другой» и «место» (или «участок»). Аллостерические ферменты - это ферменты, имеющие «другие центры».
По своим свойствам аллостерические ферменты значительно отличаются от простых нерегуляторных ферментов, описанных выше в этой главе. Во-первых, как и все ферменты, аллостерические ферменты имеют каталитический центр, в котором происходит связывание субстрата и превращение его в продукт, но у аллостерических ферментов есть по меньшей мере еще один регуляторный, или аллостерический, центр для связывания регулирующего метаболита, называемого эффектором или модулятором (рис. 9-19). Аллостерический центр специфичен по отношению к своему модулятору аналогично тому, как каталитический центр специфичен по отношению к своему субстрату. Во-вторых, молекулы аллостерических ферментов обычно намного крупнее и более сложно устроены по сравнению с молекулами простых ферментов. Большинство из них состоит из двух или более полипептидных цепей, или субъединиц. И наконец, в-третьих, кинетика реакций, катализируемых аллостерическими ферментами, обычно значительно отклоняется от классического уравнения Михаэлиса-Ментен; это один из признаков, по которому они были впервые обнаружены.
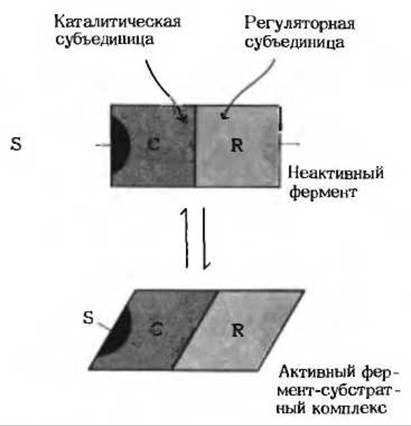
Рис. 9-19. Схематическая модель взаимодействия между субъединицами аллостерического фермента. У многих аллостерических ферментов центр связывания субстрата и центр связывания модулятора расположены в разных субъединицах - соответственно каталитической (С) и регуляторной (R). «Сообщение» о присоединении положительного модулятора М к его специфическому центру в регуляторной субъединице передается посредством конформационных изменений каталитической субъединице, которая становится активной и ее сродство к связывающемуся с ней субстрату S повышается. После отделения модулятора М от регуляторной субъединицы фермент вновь переходит в неактивную или менее активную форму.