Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Ферменты
Субъединицы аллостерических ферментов сообщаются между собой
У аллостерических ферментов имеются и другие сходные черты с гемоглобином. Во-первых, молекулы аллостерических ферментов, как и молекула гемоглобина, состоят обычно из нескольких полипептидных субъединиц; некоторые аллостерические ферменты содержат по шесть, восемь или даже по двенадцать и более субъединиц. Во-вторых, у аллостерических ферментов связывающий центр для модулятора и каталитический центр для субстрата, по-видимому, сообщаются между собой подобно тому, как сообщаются друг с другом субъединицы гемоглобина: связывание первой молекулы кислорода с одной из субъединиц гемоглобина служит «сигналом» для других субъединиц повысить их сродство к кислороду. В-третьих, аллостерические ферменты претерпевают конформационные изменения при связывании с молекулой модулятора, что дает им возможность переходить из относительно активного состояния в относительно неактивное, и наоборот (рис. 9-19). Здесь опять мы обнаруживаем сходство с гемоглобином, в котором конформационные изменения позволяют «включать» и «выключать» механизм его действия.
Дополнение 9-5. Трехмерная структура регуляторного фермента аспартат - карбамоилтрансферазы
Этот аллостерический регуляторный фермент (рис. 1) имеет два каталитических кластера, в каждом из которых находится по три свернутые в третичную структуру полипептидные цепи и три регуляторных кластера (показаны красным цветом), содержащие по две полипептидные цепи. Один каталитический кластер с тремя полипептидными цепями в свернутой конформации обведен более жирной линией. За ним виден другой каталитический кластер. Структуру этого фермента установили по данным рентгеноструктурного анализа Уильям Липском и его сотрудники в Гарвардском университете1. Вопросы, связанные с ролью этого фермента в синтезе нуклеотидов и с его регуляцией, будут рассмотрены в гл. 22.
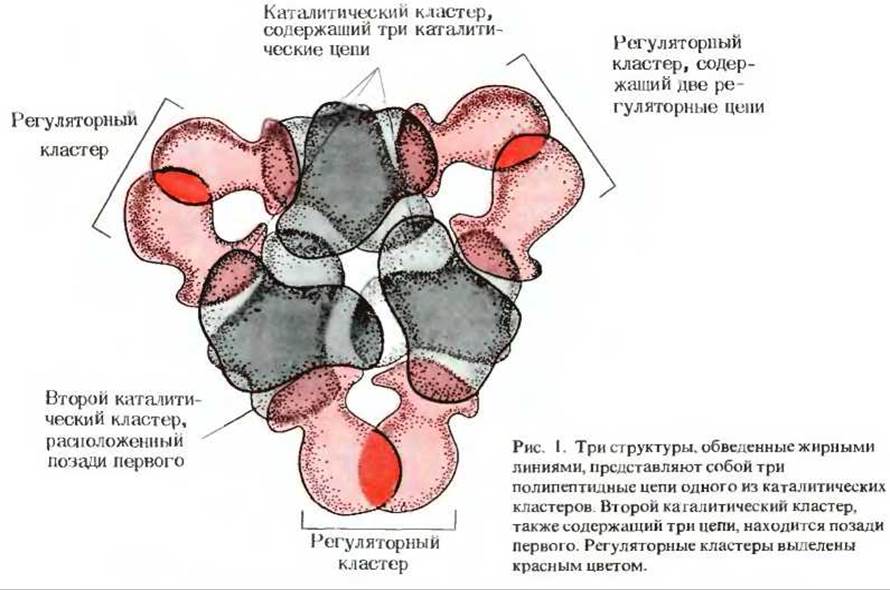
1 Прекрасное описание этого фермента дано в книге: Cantor С. R. and Schimmel Р. R. Biophysical Chemistry, pt. I, pp. 139-144, Freeman, San Francisco, 1980.
Некоторые аллостерические ферменты имеют чрезвычайно сложную структуру и содержат много полипептидных цепей. К ним относится, например, такой важный фермент, как аспартат-карбамоилтрансфераза, которая состоит из 12 полипептидных цепей, образующих каталитические и регуляторные субъединицы. В дополнении 9-5 показана очень сложная четвертичная структура этого фермента, установленная по данным рентгеноструктурного анализа. Аспартат - карбамоилтрансфераза катализирует важную реакцию в биосинтезе нуклеотидов. Более подробно мы рассмотрим его действие и регуляторные свойства в гл. 22.