Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Ферменты
Некоторые ферменты регулируются путем обратной ковалентной модификации
Еще один важный класс регуляторных ферментов - это ферменты, у которых переход активной формы в неактивную происходит путем ковалентной модификации молекулы фермента. К этому классу относится, например, такой важный фермент, как гликогенфосфорилаза из мышц и печени, катализирующая реакцию:

Образовавшийся в этой реакции глюкозо-1-фосфат может затем расщепиться и превратиться либо в молочную кислоту (в мышце), либо в свободную глюкозу (в печени). Гликогенфосфорилаза существует в двух формах: в виде фосфорилазы а (активная форма) и фосфорилазы b (относительно неактивная форма; рис. 9-22). Фосфорилаза а представляет собой димер, состоящий из двух идентичных субъединиц, в каждой из которых имеется один специфический остаток серина, фосфорилированный по гидроксильной группе. Эти остатки фосфосерина необходимы для максимальной активности фермента. Фосфатные группы, соединенные с остатками серина, можно удалить из фосфорилазы а с помощью фермента, называемого фосфатазой фосфорилазы, который катализирует гидролитический разрыв связи между фосфатом и остатком серина.

В этой реакции фосфорилаза а превращается в фосфорилазу b, гораздо менее активно катализирующую распад гликогена. Таким образом, активная форма гликогенфосфорилазы превращается в относительно неактивную форму в результате расщепления двух ковалентных связей между остатками фосфорной кислоты и двумя специфическими остатками серина в молекуле фермента.
Фосфорилаза b может снова реактивироваться, т.е. превратиться в активную фосфорилазу а. Эта реакция осуществляется с помощью другого фермента, называемого киназой фосфорилазы, который катализирует перенос фосфатных групп от АТР к гидроксильным группам специфических остатков серина в фосфорилазе b (рис. 9-22):

Итак, распад гликогена в скелетных мышцах и печени регулируется путем изменения количественных соотношений активной и неактивной форм фермента. Переход из одной формы в другую сопровождается изменениями четвертичной структуры фермента, затрагивающими и его каталитический центр. Естественно, что при этом каталитическая активность фермента изменяется.
Хотя в большинстве известных случаев регуляция действия ферментов путем их ковалентной модификации осуществляется через фосфорилирование и дефосфорилирование специфических остатков серина, как только что описано на примере гликогенфосфорилазы, существуют и другие способы ковалентной модификации ферментов, такие, как метилирование определенных аминокислотных остатков или присоединение к ним аденилатных групп. Другие примеры ковалентной модификации регуляторных ферментов будут рассмотрены в последующих главах.
Некоторые более сложные регуляторные ферменты модулируются посредством ковалентных и нековалентных механизмов. Такие ферменты катализируют реакции, представляющие собой наиболее важные этапы метаболизма; поэтому они взаимодействуют со множеством регуляторных метаболитов, осуществляющих как аллостерическую, так и ковалентную модификацию этих ферментов. К подобным ферментам относится только что рассмотренная гликогенфосфорилаза. Хотя регуляция этого фермента осуществляется в основном через ковалентную модификацию, как описано выше, возможно также и нековалентное (аллостерическое) взаимодействие его с аденилатом, который является активирующим модулятором фосфорилазы b (гл. 20).
Другой пример - глутаминсинтетаза Е. coli, один из наиболее сложных регуляторных ферментов, известных в настоящее время. Она взаимодействует со многими аллостерическими модуляторами и регулируется также путем обратимой ковалентной модификации (гл. 23). Оба этих фермента будут обсуждаться дальше в связи с их ролью в метаболизме.
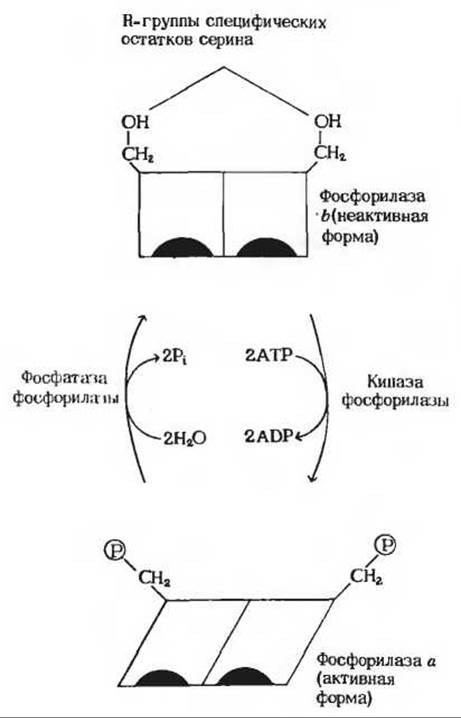
Рис. 9-22. Регуляция активности гликогенфосфорилазы путем ее ковалентной модификации. В активной форме фермента (фосфорилаза) специфические остатки серина (по одному в каждой субъединице) фосфорилированы. В результате ферментативного отщепления фосфатных групп, катализируемого фосфатазой фосфорилазы, фосфорилаза а переходит в относительно неактивную фосфорилазу b. Фосфорилаза b может реактивироваться и превратиться в фосфорилазу а под действием киназы фосфорилазы, катализирующей фосфорилирование гидроксильных групп серина за счет АТР.