Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Ферменты
Многие ферменты существуют в нескольких формах
Известно много ферментов, которые существуют не менее чем в двух молекулярных формах, встречающихся у одного и того же вида, в одной и той же ткани, и даже в одной и той же клетке. В таких случаях все эти формы фермента катализируют одну и ту же реакцию, но, так как они различаются по своим кинетическим свойствам, а также по аминокислотному составу или последовательности аминокислотных остатков, их можно выделить и охарактеризовать с помощью соответствующих методов. Такие множественные формы ферментов называются изоферментами или изозимами. Одним из первых ферментов, у которого были обнаружены такие формы, была лактатдегидрогеназа, катализирующая обратимую окислительно-восстановительную реакцию:
Лактат + NAD +⇄ Пируват + NADH+ + Н+.
В ходе этой реакции лактат теряет два атома водорода и в результате окисляется в пируват (NAD+ и NADH - это окисленная и восстановленная формы кофермента никотинамидадениндинуклетида, о котором речь пойдет в следующей главе). Лактатдегидрогеназа присутствует в тканях животных в виде пяти разных изоферментов, которые можно разделить методом электрофореза (рис. 9-23). Каждая из форм лактатдегидрогеназы состоит из четырех полипептидных цепей с молекулярной массой 33 500. Все пять изоферментов содержат в разных соотношениях полипептидные цепи двух видов, различающиеся по аминокислотному составу и последовательности аминокислот. A-цепи, называемые также М-цепями (от англ. «muscle» - мышца), кодируются двумя разными генами. Изоформа лактатдегидрогеназы, преобладающая в скелетной мышце, содержит четыре A-цепи, а изоформа, преобладающая в мышечной ткани сердца, состоит из четырех В-цепей. Лактатдегидрогеназы из других тканей представляют собой смеси пяти возможных форм, которые можно обозначить как А4, А3В, А2В2, АВ3, В4. Эти изоферменты значительно различаются по максимальной скорости Vmax и константе Михаэлиса-Ментен (Км) для своих субстратов, в частности для пирувата. Изофермент А4 предпочтительно катализирует быстрое восстановление пирувата в лактат в скелетной мышце при очень низких концентрациях пирувата, тогда как изофермент В4 предпочтительно катализирует быстрое окисление лактата в пируват в мышечной ткани сердца. Другие формы лактатдегидрогеназы имеют промежуточные кинетические свойства.
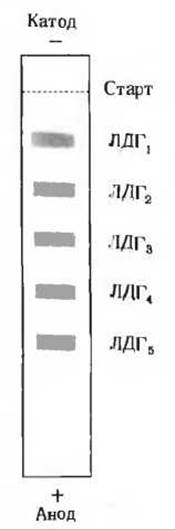
Рис. 9-23. Электрофоретическое разделение разных молекулярных форм лактатдегидрогеназы (ЛДГ). Изоферменты обычно обозначаются цифровыми индексами, указывающими относительную скорость юс перемещения при электрофорезе в полиакриламидном или крахмальном геле в стандартных условиях.
Разные формы лактатдегидрогеназы обозначаются также и буквами, как указано в тексте.
Анализ изоферментов часто используется для медицинской диагностики. В мышечной ткани сердца преобладает изофермент ЛДГ1 (обозначаемый также Н4 или B4). При сердечном приступе, приводящем к ограничению или прекращению циркуляции крови в каком-то участке сердца, концентрация этого изофермента в плазме крови сильно возрастает. Это обусловлено тем, что мембраны поврежденных клеток сердца не могут нормально функционировать и пропускают в кровоток некоторые цитозольные ферменты, в том числе ЛДГ. При некоторых болезнях печени (таких, как инфекционный гепатит) в крови возрастает содержание ЛДГ4 и ЛДГ5 - изоферментов, характерных для печени.
Было показано, что многие ферменты, участвующие в клеточном метаболизме, существуют в нескольких молекулярных формах. Все эти формы данного фермента катализируют одну и ту же реакцию, но различаются по активности, а иногда и по чувствительности к аллостерическим модуляторам. Распространение изомерных форм того или иного фермента в различных тканях и органах определяется по меньшей мере четырьмя факторами. К ним относятся:
1. Различия в каких-либо особенностях метаболизма в разных органах. Например, наличие разных форм лактатдегидрогеназы в сердечной и скелетной мышцах отражает именно такие различия.
2. Различия в локализации и метаболической роли данного фермента в клетках одного и того же типа. Например, фермент малатдегидрогеназа существует в разных формах в митохондриях и цитозоле, где эти изоферменты выполняют несколько различные функции (гл. 17).
3. Дифференцировка и развитие тканей взрослого организма из эмбриональных форм этих тканей. Например, для печени эмбрионов характерно определенное соотношение различных форм лактатдегидрогеназы, изменяющееся в процессе дальнейшего развития этого органа. Интересно, что некоторые ферменты, катализирующие расщепление глюкозы, присутствуют в опухолевых клетках в тех формах, которые встречаются у эмбрионов.
4. Тонкая регулировка скоростей метаболических реакций, осуществляемая благодаря различной чувствительности изоферментов к аллостерическим модуляторам. Некоторые регуляторные ферменты существуют в нескольких молекулярных формах, различающихся по своей чувствительности к модуляторам (гл. 22).