Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Витамины и микроэлементы: их роль в функционировании ферментов
Витамин А, вероятно, выполняет несколько функций
Роль витамина А как необходимого фактора питания впервые установил в 1915 г. Элмер Мак-Коллум. Позднее он выделил этот витамин из жира, содержащегося в печени рыб. Известны две природные формы витамина А - витамин А1, или ретинол, который получают из печени морских рыб, и витамин А2, выделяемый из печени пресноводных рыб. Оба этих витамина-20-атомные спирты, состоящие из изопреновых единиц. В растениях витамин А, как таковой, не встречается, но многие растения содержат вещества изопреноидной природы, называемые каротиноидами, которые в организме большинства животных могут превращаться ферментативным путем в витамин А. На рис. 10-19 показано, как в результате расщепления ß-керотина из него образуется витамин А. ß-Каротин придает моркови, батату и другим овощам характерный для них цвет.
У людей и экспериментальных животных недостаточность витамина А приводит к целому ряду симптомов, между которыми на первый взгляд трудно найти что-либо общее. К числу таких симптомов относятся сухость кожи, ксерофтальмия («сухие глаза»), сухость слизистых оболочек, задержка развития и роста, стерильность самцов, ночная (куриная) слепота. Последний симптом обычно используют для ранней диагностики недостаточности витамина А (разд. 26.16).
Интенсивные биохимические и биофизические исследования витамина А, начало которым положил Джордж Уолд в Гарвардском университете, позволили получить всестороннюю информацию о функции витамина А в процессе зрения. На рис. 10-20 показан цикл химических изменений зрительного пигмента родопсина в палочках сетчатки. Эти клетки воспринимают световые сигналы низкой интенсивности, но не чувствительны к цвету. Роль активного компонента в зрительном процессе играет окисленная форма ретинола - ретиналь, или альдегид витамина А, связанный с белком опсином. Комплекс ретиналя с опсином, называемый родопсином, расположен в уложенных стопками внутриклеточных мембранах палочек. При возбуждении родопсина видимым светом ретиналь, у которого одна двойная связь в 11-м положении находится в цис-конфигурации (остальные двойные связи имеют трансконфигурацию), в результате очень сложных, но быстро протекающих внутримолекулярных перестроек изомеризуется в полностью транс-ретиналь. Считают, что эти изменения, влияющие на геометрическую конфигурацию ретиналя (рис. 10-20), вызывают изменение формы всей молекулы родопсина. Такое конформационное изменение служит молекулярным пусковым механизмом, возбуждающим в окончаниях зрительного нерва импульс, который затем передается в мозг. В ходе «темновых» ферментативных реакций образовавшийся при освещении полностью транс-ретиналь вновь превращается в исходный 11-цис-ретиналь.
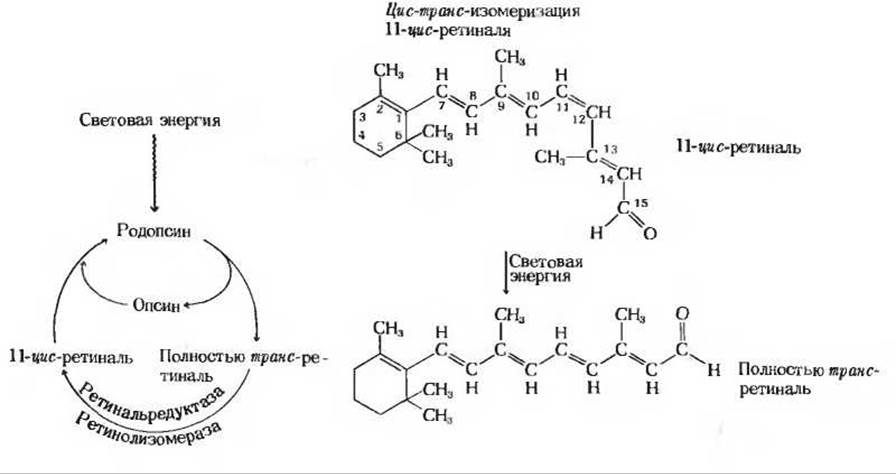
Рис. 10-20. Циклический процесс синтеза и распада зрительного пигмента родопсина. При возбуждении молекулы родопсина видимым светом его простетическая группа 11-цис-ретиналь поглощает световую энергию и в результате изомеризации, состоящей из нескольких стадий, превращается в полностью транс-ретиналь. Этот процесс возбуждает нервный импульс. Поскольку структура полностью транс-ретиналя не соответствует конформации активного центра белка опсина, ретиналь отщепляется от него. В ходе двух последовательных ферментативных реакций полностью транс-ретиналь вновь превращается в исходный 11-цис-ретииаль, который связывается с опсином, вновь образуя родопсин.
Ретиналь содержится также в бактериородопсине - светочувствительном пигменте, представляющем собой ретиналь-белковый комплекс, который присутствует в клеточной мембране галобактерий - «солелюбивых» прокариот, получающих основное количество энергии за счет света, поглощенного этим пигментом (гл. 17).