Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Углеводы: строение и биологические функции
Типичные моносахариды имеют циклическую структуру
На рис. 11 -1 - 11 -4 и 11-6 строение различных альдоз и кетоз представлено в виде прямолинейных цепочек. Такая форма соответствует структуре лишь триоз и тетроз; что касается моносахаридов, скелет которых состоит из 5 и более атомов углерода, то в растворах они существуют в виде замкнутых циклических структур, причем карбонильная группа находится не в свободном состоянии, как это изображено на рисунках, а образует ковалентную связь с одной из гидроксильных групп, связанных с атомом углерода основной цепи. Одним из доказательств того, что D-глюкоза имеет замкнутую циклическую структуру, служит тот факт, что в кристаллическом виде это вещество существует в двух формах, несколько различающихся по свойствам. Если производят кристаллизацию D-глюкозы из воды, то образуется a-D-глюкоза с величиной удельного вращения (разд. 5.2) [a]20D = + 112,2°. Если же D-глюкозу кристаллизуют из пиридина, то образуется ß-D-глюкоза, для которой [а]20D = + 18,7°. По химическому составу обе формы идентичны. На основе ряда химических данных был сделан вывод, что углеродные скелеты а- и ß-изомеров D-глюкозы образуют два разных шестичленных кольца (рис. 11 -8), а не прямолинейные цепочки. Такие циклические формы сахаров из-за их сходства с шестичленным циклическим соединением пираном получили название пираноз. Две циклические формы D-глюкозы называются a-D-глюкопиранозой и ß-D-глюкопиранозой (рис. 11 -8).
При растворении a-D-глюкозы в воде ее удельное вращение постепенно меняется во времени, достигая в конце концов стабильного значения 52,7°; в аналогичных условиях удельное вращение и ß-D-глюкозы достигает того же значения. Это изменение оптической активности, получившее название мутаротации, обусловлено тем, что как a-, так и ß-D-глюкоза образуют при 25°С равновесную смесь, состоящую примерно на 1/3 из a-D-глюкозы и на 2/3 из ß-D-глюкозы и содержащую лишь очень небольшое количество незамкнутой формы. Из этих экспериментов следует, что а- и ß-изомеры D-глюкозы в водном растворе могут превращаться друг в друга.
Формирование пиранозного кольца в молекуле D-глюкозы обусловлено протеканием обычной реакции между альдегидной и гидроксильной группами, приводящей к образованию полуацеталя (рис. 11-9). Полуацетали содержат асимметрический атом углерода и потому могут существовать в двух стереоизомерных формах. D-глюкопираноза - это внутримолекулярный полуацеталь: он образуется в результате взаимодействия свободной гидроксильной группы при пятом атоме углерода с альдегидобразующим первым углеродным атомом, который в результате становится асимметричным. D-глюкопираноза может существовать, таким образом, в виде двух стереоизомеров, для обозначения которых используют буквы а и ß (рис. 11-8). В итоге при циклизации число асимметрических центров в молекуле D-глюкозы оказывается на один больше по сравнению с тем числом, которое предусматривает формула в віще прямой цепочки. Изомерные формы моносахаридов, отличающиеся друг от друга только конфигурацией полуацетального углеродного атома, такие, как а-D-глюкоза и ß-D-глюкоза, называются аномерами. Полуацетальный, или карбонильный, атом углерода называется аномерным углеродом. Устойчивые пиранозные кольца могут образовывать только альдозы, содержащие пять или более атомов углерода. Альдогексозы также существуют в виде циклических соединений с пятичленными кольцами. Из-за сходства таких колец с пятичленным циклическим соединением фураном их называют фуранозами (рис. 11-10). Однако шестичленное альдопиранозное кольцо намного более устойчиво, чем альдофуранозное, и потому в растворах альдогексоз преобладает альдопиранозная форма.
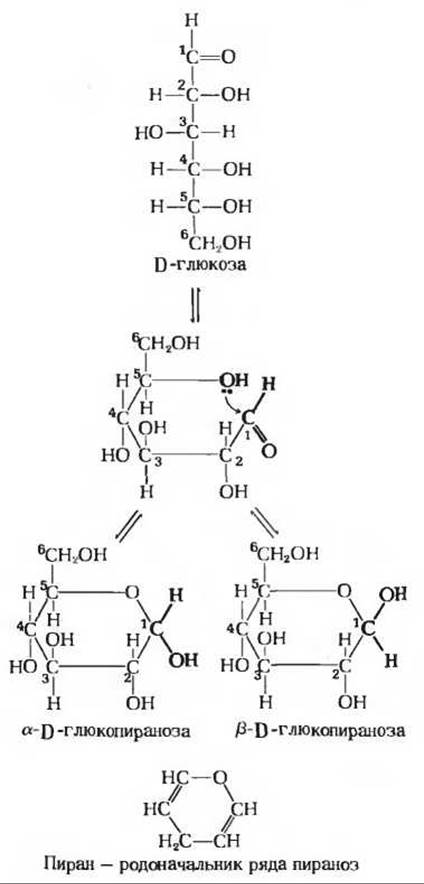
Рис. 11-8. Образование двух форм D-глюкопиранозы. Когда между альдегидной группой при С1 и гидроксильной группой при С5 формируется полуацетальная связь, из-за асимметрии атома C1 могут образовываться два стереоизомера, обозначаемые буквами а и ß.
Кетогексозы также существуют в виде а- и ß-аномеров. В этих соединениях гидроксильная группа пятого атома углерода взаимодействует с карбонильной группой второго атома углерода, образуя пятичленное фуранозное кольцо с полукетальной связью (рис. 11-9). D-фруктоза образует две фуранозы (рис. 11-10), из которых чаще встречается β-D-фруктофураноза.
Для изображения циклических форм моносахаридов обычно пользуются проекционными формулами Хеуорса. В таких формулах часть кольца, расположенную ближе к читателю, изображают жирными линиями (рис. 11-10). Следует иметь в виду, что в действительности шестичленное пиранозное кольцо не лежит в одной плоскости, как это кажется при использовании проекции Хеуорса. У большинства сахаров оно имеет форму кресла, а у некоторых - форму лодки; эти конформации изображаются при помощи конформационных формул (рис. 11-11). Как мы увидим дальше, биологические свойства и функции многих полисахаридов определяются в значительной мере особенностями конформации образующих их простых шестиатомных сахаров.
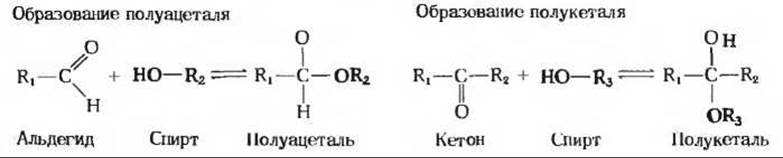
Рис. 11-9. Альдегиды и кетоны могут взаимодействовать со спиртами, образуя полуацетали и полукетали. В этих реакциях атом углерода карбонильной группы становится асимметричным.
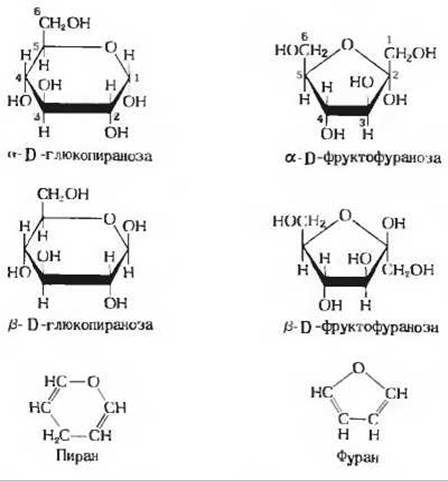
Рис. 11-10. Пиранозные формы D-глюкозы и фуранозные формы D-фруктозы, изображенные с помощью проекционных формул Хеуорса»
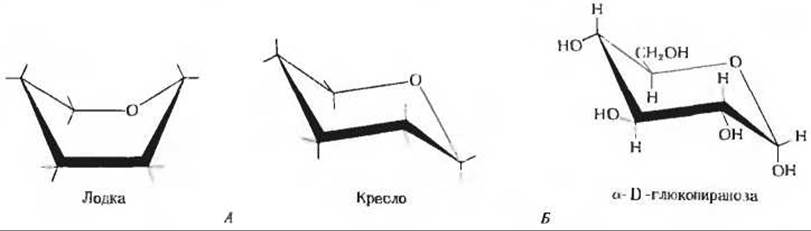
Рис. 11-11. А. Две изомерные формы пиранозного кольца (лодка и кресло), изображенные при помощи конформациоиныч формул. Б. Конформационпая формула a-D-глюкопиранозьц имеющей конформацию кресла.