Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Липиды и мембраны
Жирные кислоты - структурные компоненты большинства липидов
В предыдущих главах мы уже рассмотрели такие важные компоненты клетки, как вода, белки, ферменты, коферменты и углеводы. Перед тем как перейти к изучению метаболических процессов в клетках, следует рассмотреть еще одну группу биомолекул - липиды. Липиды представляют собой нерастворимые в воде маслянистые или жирные вещества, которые могут быть экстрагированы из клеток неполярными растворителями. такими, как эфир или хлороформ. Наиболее распространенные липиды-жиры или триацилглицеролы, играют роль топлива для большинства организмов. Именно в них запасается большая часть энергии, выделяющейся в результате химических реакций.
Рассмотрение липидов в этой главе уместно и еще по одной причине. Дело в том, что наряду с неполярными липидами существуют также полярные липиды. Они составляют главные компоненты клеточных мембран, т.е. тех «контейнеров», в которых протекают основные метаболические процессы. Мембраны не только отделяют содержимое клеток от окружающей среды, но и обеспечивают пространственное разделение метаболических процессов внутри клеток. Вместе с тем мембраны - это не просто клеточный «покров»: в них локализованы многочисленные ферменты и транспортные системы. Более того, на внешней поверхности клеточной мембраны располагаются разнообразные распознающие, или рецепторные, участки, которые способствуют узнаванию других клеток, связывают определенные гормоны и воспринимают иные сигналы из внешнего окружения. Многие свойства клеточных мембран обусловлены наличием в них полярных липидов.
Существует несколько классов липидов, каждый из которых выполняет специфические биологические функции (табл. 12-1). Мы начнем рассмотрение с жирных кислот - характерных структурных компонентов большинства липидов. Жирные кислоты - это длинноцепочечные органические кислоты, содержащие от 4 до 24 углеродных атомов; они содержат одну карбоксильную группу и длинный неполярный углеводородный «хвост» (рис. 12-1), из-за которого большинство липидов нерастворимы в воде и проявляют свойства масел или жиров. В клетках и тканях жирные кислоты встречаются не в свободном состоянии, а в ковалентно связанной форме в составе липидов различных классов; в свободном виде жирные кислоты можно получить только путем химического или ферментативного гидролиза. Из природных липидов выделены разнообразные жирные кислоты, различающиеся длиной цепи, наличием, числом и положением двойных связей; некоторые жирные кислоты содержат также боковые метальные группы. На рис. 12-1 и в табл. 12-2 приведено строение основных жирных кислот, обнаруженных в природных липидах.
Таблица 12-1. Липиды основных типов, сгруппированные в соответствии с их химическим строением
|
Известны липиды и некоторых других типов, но они менее распространены в животных тканях |
|
Триацилглицеролы Воска |
|
Фосфоглицериды Фосфатидилэтаноламин Фосфатидилхолин Фосфатидилсерин Фосфатидилинозитол Кардиолипин |
|
Сфинголипиды Сфингомиелин Цереброзиды Ганглиозиды |
|
Стеролы и их эфиры с жирными кислотами |
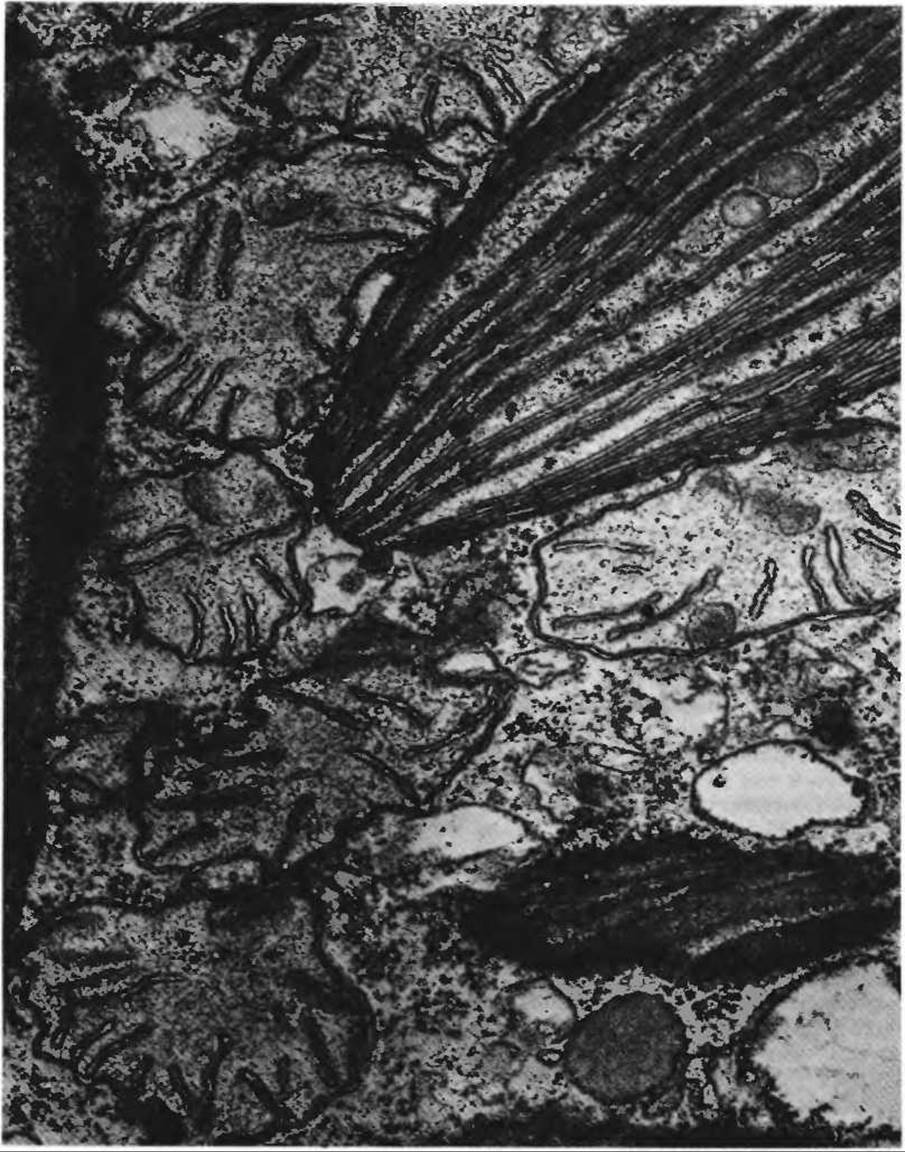
Липиды играют важную роль в построении и функционировании клеток» На этой электронной микрофотографии показана цитоплазма фотосинтезирующей водоросли Euglena. Отчетливо видны липидсодержащие мембраны хлоропласта (наверху справа) и нескольких митохондрий (вокруг хлоропласта и внизу слева).
В хлоропласте видны также две липидные капли, которые служат энергетическим резервом. Серая овальная структура внизу справа - липидное включение в цитоплазме.
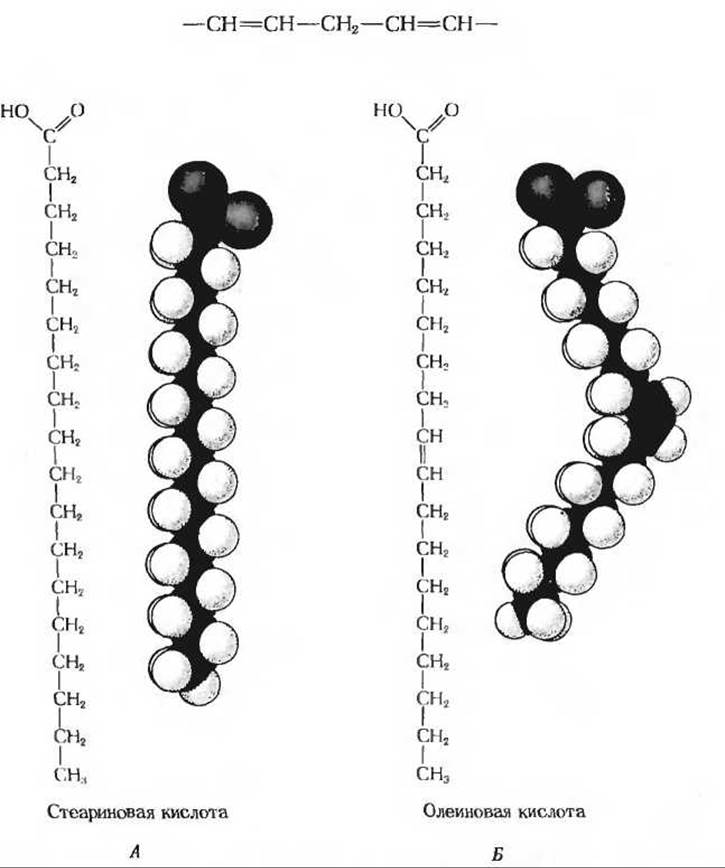
Рис. 12-1. Структурные формулы и пространственные модели двух типичных жирных кислот.
А. Стеариновая кислота изображена в виде вытянутой цепочки, однако в действительности ее молекула не имеет жесткой линейной структуры. Поскольку вокруг любой одинарной связи возможно свободное вращение, углеводородная цепь стеариновой кислоты (как и всех других насыщенных жирных кислот) обладает большой гибкостью и может принимать разнообразные конформации. Б. В молекуле олеиновой кислоты цис-двойная связь фиксирует определенный изгиб углеводородной цепи. Все остальные связи в цепи одинарные, и потому относительно них возможно свободное вращение.
Практически все встречающиеся в естественных условиях жирные кислоты содержат четное число атомов углерода, причем чаще всего - 16 или 18 углеродных атомов. Длинная углеводородная цепь, составляющая хвост молекулы, может быть полностью насыщена, т. е. содержать только одинарные связи, или ненасыщена, т. е. содержать одну или несколько двойных связей. Как правило, ненасыщенные жирные кислоты встречаются и у животных, и у растений в два раза чаще, чем насыщенные. В большинстве жирных кислот имеющаяся двойная связь расположена между 9-м и 10-м атомами углерода (она обозначается ∆9). Дополнительные двойные связи обычно расположены между ∆9-двойной связью и метальным концом цепи. Две двойные связи в жирных кислотах не бывают сопряженными (—СН=СН—СН=СН—), а всегда между ними находится метиленовая группа:
—СН=СН—СН2—СН=СЕ—
Таблица 12-2. Некоторые природные жирные кислоты

Двойные связи практически во всех природных жирных кислотах находятся в цис-конформации, что приводит к сильному изгибу алифатической цепи (рис. 12-1). Жирные кислоты с несколькими двойными связями (такие, как, например, арахидоновая кислота, содержащая четыре двойные связи) имеют несколько изгибов цепи, и их молекулы обладают большей жесткостью, чем молекулы насыщенных жирных кислот; последние благодаря свободному вращению вокруг одинарных связей характеризуются большей гибкостью и большей длиной. При температуре тела насыщенные жирные кислоты ряда от С12 до С24 находятся в твердом воскоподобном состоянии, а ненасыщенные жирные кислоты представляют собой жидкости.
Обычные жирные кислоты нерастворимы в воде, но в разбавленных растворах NaOH или КОН они могут образовывать мицеллы (разд. 4.3), превращаясь в так называемые мыла - соли жирных кислот. Употребляемое для мытья мыло состоит в основном из калиевых солей жирных кислот. Na+-или К+-мыла - это амфипатические соединения (разд. 4.3): их ионизированная карбоксильная группа образует полярную голову, а углеводородная цепь - неполярный хвост. Na+- или К+-мыла способны эмульгировать нерастворимые в воде масла и жиры. Углеводородные хвосты мыла при этом встраиваются в капли жира, а полярные головы взаимодействуют с водой. Таким образом, мыла формируют гидрофильную оболочку вокруг капель жира, образуя мелкодисперсную смесь или эмульсию (рис. 12-2).
Са2+ - и Mg2+-мылa жирных кислот растворяются очень плохо и потому не эмульгируют жиров. Именно этим объясняется появление белых хлопьев осадка при растворении банного мыла (состоящего главным образом из К +-мыла) в жесткой воде, которая содержит соли Са2+ и Mg2+.
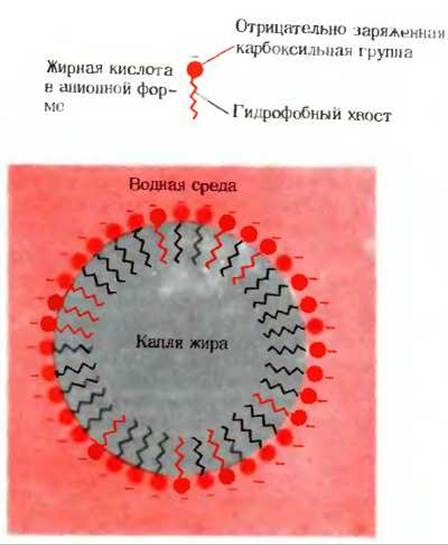
Рис. 12-2. Эмульгирующее действие мыла на жир. Мыло разбивает жир на капли, окруженные оболочкой из гидрофильных, высокополярных карбоксильных групп и таким путем образует стабильную эмульсию. Отрицательный заряд карбоксильных групп компенсируется равным числом положительно заряженных ионов, например Na+.