Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Вода
Необычные физические свойства воды обусловлены ее способностью участвовать в образовании водородных связей
По сравнению с большинством других жидкостей вода имеет необычно высокие температуры плавления и кипения и теплоту испарения (табл. 4-1). Эти особенности воды свидетельствуют о сильном притяжении между соседними молекулами, вследствие чего жидкая вода характеризуется большим внутренним сцеплением. Теплота испарения и температура кипения жидкости непосредственно определяются количеством энергии, необходимой для преодоления сил притяжения между соседними молекулами, в результате чего они отрываются друг от друга и жидкость переходит в газообразное состояние.
Таблица 4-1. Температуры плавления, температуры кипения и теплоты испарения некоторых общеизвестных жидкостей
|
Т. пл., С |
Т. кип., С |
Теплота испарения кал/г1) |
|
|
Вода |
0 |
100 |
540 |
|
Метиловый спирт |
- 98 |
65 |
263 |
|
Этиловый спирт |
-117 |
78 |
204 |
|
Пропиловый спирт |
-127 |
97 |
164 |
|
Ацетон |
-95 |
56 |
125 |
|
Гексан |
-98 |
69 |
101 |
|
Бензол |
6 |
80 |
94 |
|
Хлороформ |
-63 |
61 |
59 |
1) Количество тепловой энергии в калориях, необходимое для превращения 1,0 г жидкости при температуре ее кипения и атмосферном давлении в газообразное состояние при той же температуре и том же давлении.
Почему же для жидкой воды характерно столь сильное взаимное притяжение молекул? Ответ на этот вопрос вытекает из самой структуры молекулы воды. Каждый из двух атомов водорода (в молекуле воды) объединяет свой электрон с одним из электронов атома кислорода. Взаимное расположение возникающих при этом двух электронных пар обусловливает V-образную форму молекулы воды (рис. 4-1). Поскольку у атома кислорода имеются еще две неподеленные электронные пары, он несет частичный отрицательный заряд (в вершине V-образной структуры). Более электроотрицательный атом кислорода стремится притянуть электроны атомов водорода; поэтому на ядрах обоих атомов водорода (протонах) локализуются частичные положительные заряды. Хотя молекула воды в целом электрически нейтральна, ее частичные отрицательный и положительный заряды пространственно разделены, что приводит к возникновению у нее электрического дипольного момента. Благодаря такому разделению зарядов две соседние молекулы воды могут притягиваться друг к другу за счет сил электростатического взаимодействия между частичным отрицательным зарядом, локализованным на атоме кислорода одной молекулы воды, и частичным положительным зарядом, локализованным на атоме водорода другой молекулы (рис. 4-1). Такой тип электростатического притяжения называется водородной связью.
Поскольку расположение электронов вокруг атома кислорода близко к тетраэдрическому (рис. 4-1), каждая молекула воды в принципе может образовать водородные связи максимально с четырьмя соседними молекулами воды. Предполагается, что в любой данный момент в жидкой воде при комнатной температуре каждая молекула воды образует водородные связи в среднем с 3,4 других молекул. Молекулы в жидкой воде находятся в непрерывном движении, поэтому образующиеся водородные связи постоянно и быстро разрываются и вновь восстанавливаются. Во льду же молекулы воды зафиксированы в пространстве, и каждая из них оказывается связанной водородными связями с максимально возможным числом соседних молекул, т.е. с четырьмя; при этом образуется регулярная кристаллическая структура (рис. 4-2). Вода может служить примером полярной жидкости. В отличие от нее молекулы неполярных жидкостей, таких, как бензол или гексан, не проявляют заметной тенденции к электростатическому притяжению. Поэтому для разрушения межмолекулярных взаимодействий в таких жидкостях требуется гораздо меньше энергии, и значения теплоты испарения у гексана и бензола, как показывает опыт, действительно намного меньше, чем у воды (табл. 4-1).
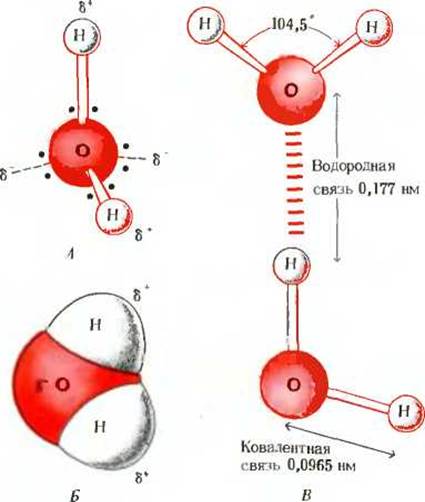
Рис. 4-1. Биполярная природа молекулы Н2О. показанная при помощи модели из шариков и стержней (А) и пространственной модели {Б). Поскольку расположение валентных электронных пар вокруг атома кислорода в молекуле воды близко к тетраэдрическому, на двух атомах водорода локализованы частичные положительные заряды, а на атоме кислорода два частичных отрицательных заряда. В. Две молекулы Н2О, связанные друг с другом водородной связью (обозначена цветными черточками), соединяющей атом кислорода верхней молекулы и атом водорода нижней молекулы. Каждая молекула Н2О в принципе может быть связана водородными связями максимально с четырьмя другими молекулами Н2О, как это имеет место в случае льда (см. рис. 4-2).
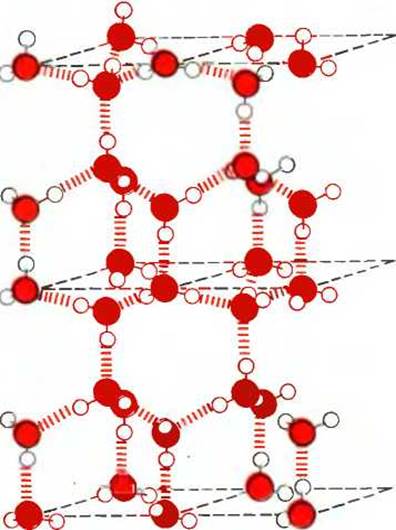
Рис. 4-2. Каждая молекула воды во льду связана водородными связями с четырьмя другими молекулами воды, так что при этом образуется регулярная кристаллическая решетка. В жидкой воде при комнатной температуре каждая молекула воды связывается при помощи водородных связей в среднем приблизительно с 3,4 молекул воды. Таким образом, в жидкой воде молекулы воды расположены относительно друг друга менее «рыхло», чем в кристаллической решетке льда, вследствие чего лед обладает меньшей плотностью по сравнению с водой и поэтому всплывает в ней.
Водородные связи слабее ковалентных. Согласно имеющимся данным, энергия водородных связей в жидкой воде (т.е. энергия, необходимая для разрушения одной связи) составляет всего лишь около 4,5 ккал/моль, тогда как энергия ковалентных связей Н- -О в молекулах воды равна 110 ккал/моль. Тем не менее благодаря своей многочисленности водородные связи обеспечивают высокую устойчивость жидкой воды. Хотя в любой данный момент большинство молекул в жидкой воде соединено между собой водородными связями, время полужизни каждой из водородных связей составляет менее 1∙10-9 с. Вследствие этого жидкая вода представляет собой не вязкую, а весьма подвижную жидкость. Для обозначения присутствующих в жидкой воде короткоживущих групп молекул, связанных друг с другом водородными связями, иногда используют термин «мерцающие скопления» (flickering clusters).