Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Вода
Водородные связи широко распространены в биологических системах и играют в них важную роль
Водородные связи характерны не только для воды. Они легко образуются между любым электроотрицательным атомом (обычно кислородом или азотом) и атомом водорода, ковалентно связанным с другим электроотрицательным атомом в той же или другой молекуле (рис. 4-3). Атомы водорода, соединенные ковалентной связью с сильно электроотрицательными атомами, такими, как кислород, всегда несут частичные положительные заряды и потому способны к образованию водородных связей, тогда как атомы водорода, ковалентно связанные с атомами углерода, которые не обладают электроотрицательностью, не несут частичного положительного заряда и, следовательно, не способны образовывать водородные связи. Именно это различие служит причиной того, что бутиловый спирт (СН3СН2СН2СН2ОН), в молекуле которого один из атомов водорода связан с кислородом и может, таким образом, образовать водородную связь с другой молекулой бутилового спирта, обладает сравнительно высокой температурой кипения (+117 °С. Наоборот, бутан (СН3СН2СН2СН3), который не способен образовывать межмолекулярные водородные связи, поскольку все атомы водорода в его молекулах связаны с углеродом, имеет низкую температуру кипения (-0,5 °С). Некоторые примеры биологически важных водородных связей показаны на рис. 4-4.
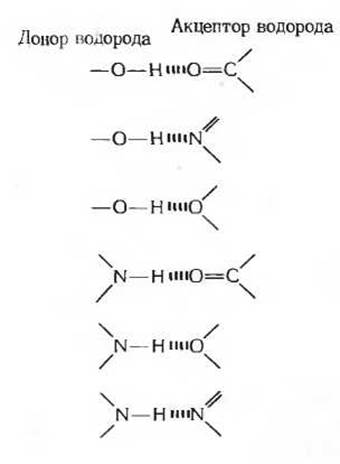
Рис. 4-3. Водородные связи. В связях этого типа атом водорода неравномерно распределен между двумя электроотрицательными атомами. Атом, с которым водород связан ковалентно, служит донором водорода, а электроотрицательный атом другой молекулы акцептором. В биологических системах электроотрицательными атомами, участвующими в образовании водородных связей, являются кислород и азот; атомы углерода принимают участие в образовании водородных связей только в редких случаях. Расстояние между двумя электроотрицательными атомами, соединенными водородной связью, варьирует от 0,26 до 0,31 нм. Ниже показаны обычные типы водородных связей.
Одна из характерных особенностей водородных связей состоит в том, что они обладают наибольшей прочностью в тех случаях, когда взаимная ориентация связанных между собой молекул обеспечивает максимальную энергию электростатического взаимодействия (рис. 4-5). Другими словами, водородная связь характеризуется определенной направленностью и вследствие этого способна удерживать обе связанные с ее помощью молекулы или группы в определенной взаимной ориентации. Ниже мы увидим, что именно это свойство водородных связей способствует стабилизации строго определенных пространственных структур, характерных для молекул белков и нуклеиновых кислот, содержащих большое число внутримолекулярных водородных связей (гл. 7, 8 и 27).