Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Вода
Вода как растворитель обладает необычными свойствами
Вода является значительно лучшим растворителем, чем большинство других общеизвестных жидкостей. Многие кристаллические соли, такие, как хлористый натрий, хорошо растворимы в воде, но почти нерастворимы в неполярных жидкостях, например в хлороформе или бензоле. Это свойство обусловлено биполярным характером молекулы воды. Кристаллическая решетка соли стабилизирована за счет очень сильного электростатического притяжения между чередующимися друг с другом положительно и отрицательно заряженными ионами. Когда кристалл NaCl помещают в воду, биполярные молекулы воды начинают очень сильно притягивать ионы Na+ и Сl-, извлекая их из решетки. В результате эти ионы в гидратированной форме постепенно переходят в раствор (рис. 4-6). Вода растворяет также многие простые органические соединения, содержащие карбоксильные группы или аминогруппы, способные ионизироваться при взаимодействии с водой.
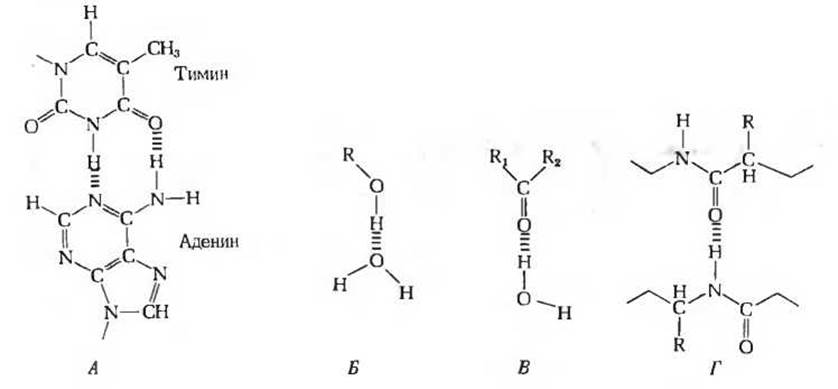
Рис. 4-4. Водородные связи, играющие важную роль в биологических системах, могут соединять два комплементарных основания, расположенные в разных цепях ДНК (А), гидроксильную группу спирта и молекулу воды (Б), карбонильную группу кетона и молекулу воды (В), две полипептидные цепи (Г).
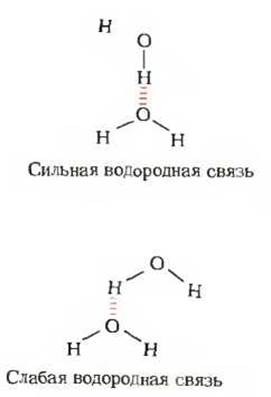
Рис. 4-5. Направленность водородной связи. Верхняя структура характеризуется более прочной водородной связью, поскольку при такой ориентации взаимодействующих молекул обеспечивается максимально возможное притяжение между частичными электрическими зарядами.
Второй класс веществ, хорошо растворимых в воде, включает многие нейтральные органические соединения, содержащие полярные функциональные группы. К ним относятся, в частности, сахара, спирты, альдегиды и кетоны. Растворимость этих веществ обусловлена способностью молекул воды образовывать водородные связи с гидроксильными группами сахаров и спиртов, а также с карбоксильными группами альдегидов и кетонов (см. рис. 4-4).
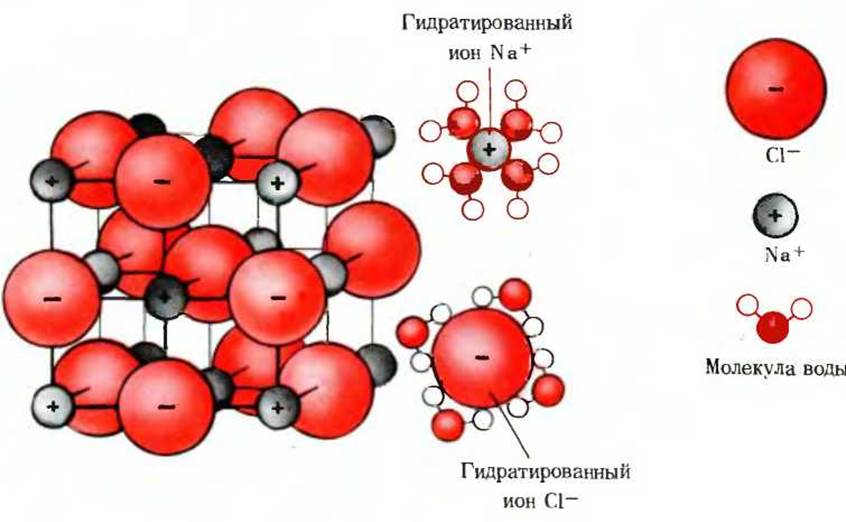
Рис. 4-6. Хорошая растворимость в воде многих кристаллических солей обусловлена гидратацией ионов, образующих эти соли. Изображенная здесь кристаллическая решетка NaCl стабилизирована за счет сил притяжения между ионами Na+ и Сl-. Кристалл растворяется в воде вследствие гидратации ионов Nа+ и Сl-, что приводит к их «выталкиванию» из кристаллической решетки.
Третий класс веществ - это вещества, диспергируемые водой. Он включает соединения, содержащие как гидрофобные (водоотталкивающие), так и гидрофильные («любящие» воду) группы. Их часто называют амфипатическими соединениями. Примером таких соединений может служить натриевая соль олеиновой кислоты - жирной кислоты с длинной цепью. Поскольку длинная углеводородная цепь гидрофобна и, по существу, нерастворима в воде, стремление молекул олеата натрия (мыла) перейти в водную фазу с образованием истинно молекулярного раствора выражено очень слабо. Однако олеат натрия легко диспергируется в воде, образуя агрегаты, называемые мицеллами, в которых гидрофильные отрицательно заряженные карбоксильные группы обращены к водной фазе и взаимодействуют с молекулами воды, а гидрофобные неполярные углеводородные цепи спрятаны внутри структуры (рис. 4-7). Мицеллы могут содержать сотни или даже тысячи молекул мыла. Такие мицеллы остаются равномерно суспендированными в воде, так как все они несут отрицательный заряд и потому стремятся оттолкнуться друг от друга. Мыльная вода обычно бывает мутной, потому что мицеллы имеют довольно большие размеры и рассеивают свет.
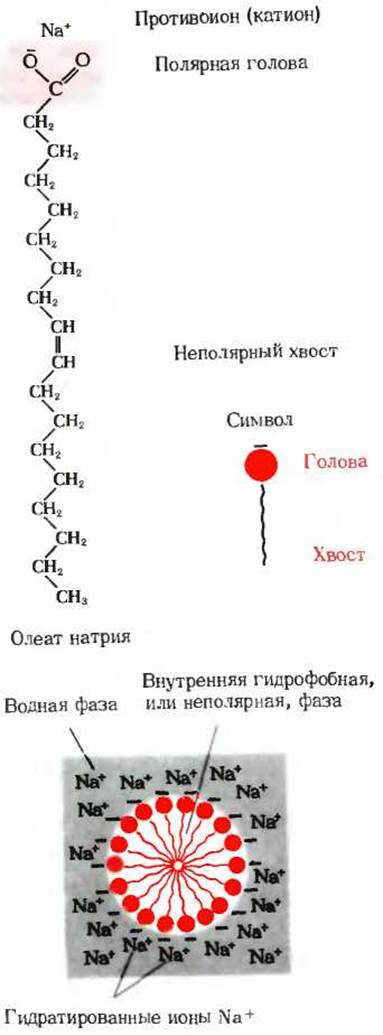
Рис. 4-7. Образование мицеллы мыла в воле. Неполярные хвосты молекул олеата натрия скрыты внутри мицеллы, тогда как отрицательно заряженные карбоксильные группы находятся на поверхности мицеллы. Число ионов Na+ в водной фазе равно числу отрицательных зарядов на мицелле, так что в целом раствор электронейтрален.
Характерное расположение неполярных групп в таких мицеллах обусловлено стремлением окружающих мицеллу молекул воды образовывать водородные связи друг с другом и связываться с гидрофильными карбоксильными группами, вынуждая тем самым углеводородные цепи перемещаться внутрь мицеллы, где они не могут контактировать с водой. Молекулам воды «нравятся» другие молекулы воды и карбоксильные группы больше, чем углеводородные цепи, которые не способны образовывать водородных связей. Мы используем термин гидрофобное взаимодействие для обозначения процесса объединения гидрофобных участков амфипатических молекул внутри таких мицелл, однако на самом деле речь идет о стремлении молекул воды, окружающих мицеллу, образовать как можно больше водородных связей друг с другом; именно это стремление и служит движущей силой образования мицелл и причиной их стабильности. Многие компоненты живых клеток, например фосфолипиды (гл. 12), белки (гл. 8) и нуклеиновые кислоты (гл. 27), обладают амфипатическими свойствами и стремятся образовать в водных растворах структуры, в которых неполярные, гидрофобные, участки изолированы от водной фазы. Более того, как мы увидим ниже (гл. 12), именно мицеллярная организация амфипатических липидных молекул составляет «основу» биологических мембран.