Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Вода
Ионизацию воды можно охарактеризовать величиной константы равновесия
Перейдем теперь от общих рассуждений к рассмотрению интересующего нас процесса ионизации воды и попытаемся описать его в количественных терминах. Этот обратимый процесс приводит, как указывалось выше, к образованию водородных и гидроксильных ионов. Однако, когда мы используем термин «водородный ион» и символ «Н+», следует иметь в виду, что «голых» водородных ионов, т. е. свободных протонов, в воде не существует, поскольку они, как и большинство других ионов, всегда гидратированы, т.е. окружены гидратной оболочкой. Гидратированную форму иона Н+ называют ионом гидрония или ионом гидроксония. Его часто обозначают Н3О+, однако в действительности каждый ион Н+ плотно окружен несколькими молекулами Н2O, число которых зависит от температуры.
В соответствии с уравнением
![]()
ионизация воды происходит лишь в незначительной степени; в любой данный момент при 25°С всего одна из 10 миллионов молекул чистой воды находится в ионизированном состоянии. Хотя вода характеризуется очень слабой тенденцией к ионизации, образующиеся при этом ионы Н+ и ОН- играют исключительно важную роль в биологических процессах. Поэтому мы должны уметь количественно выражать степень ионизации воды.
Мы можем сделать это, если напишем выражение для константы равновесия обратной реакции (3):
![]()
Это выражение можно упростить, так как относительная концентрация Н2O очень высока (она равна числу граммов воды в 1 л, деленному на ее молекулярную массу в граммах, т. е. 1000:18 = 55,5 М) и поэтому представляет собой практически постоянную величину по отношению к очень низким концентрациям (1∙10-7 М) ионов Н+ и ОН- в чистой воде при 25°С. Таким образом, мы можем подставить в выражение для константы равновесия величину 55,5, после чего получим
![]()
или
![]()
Численное значение величины K'eq было тщательно определено на основе данных по электропроводности чистой воды (в чистой воде электрический ток могут проводить только ионы, образующиеся в результате диссоциации Н2O). При 25°С оно оказалось равным 1,8∙10-16. Подставляя это значение в приведенное выше уравнение, получим:
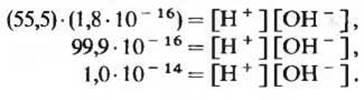
Если обозначить произведение 55,5 K'eq через Kw, то можно записать соотношение:
Kw = 1,0∙10-14 = [Н+] [ОН-].
Величина Kw называется ионным произведением воды; ее численное значение при 25°С равно 1,0∙10-14. Это означает, что произведение [Н+] [ОН-] в водных растворах при 25°С всегда равно строго определенной величине, а именно 1∙10-14. Если концентрации ионов Н+ и ОН- в точности равны друг другу, что имеет место, например, в чистой воде, то такой раствор называется нейтральным. Исходя из численного значения ионного произведения воды, можно рассчитать концентрацию ионов Н+ и ОН- в воде:
Kw = [H+][OH-] = [H+]2.
Решая это уравнение относительно Н+, имеем
![]()
Так как ионное произведение воды является величиной постоянной, очевидно, что если концентрация ионов Н+ превышает 1∙10-7 М, то концентрация ионов ОН- должна быть меньше 1∙10-7 М, и наоборот. Таким образом, когда концентрация ионов Н+ очень высока, как это имеет место, например, в растворе соляной кислоты, концентрация ионов ОН- должна быть очень низка, поскольку их произведение всегда должно оставаться равным 1∙10-14. И наоборот, если концентрация ионов ОН- очень высока, как, например, в растворе NaOH, то концентрация ионов Н+ должна быть очень низка. Следовательно, если мы знаем концентрацию ионов ОН-, то, исходя из численного значения ионного произведения воды, мы можем вычислить концентрацию ионов Н+, а если мы знаем концентрацию ионов Н+, то можно вычислить соответственно концентрацию ионов ОН- (см. дополнение 4-1).