Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Вода
Шкала pH: обозначения концентраций ионов Н+ и ОН-
Шкала pH представляет собой удобный способ обозначения истинной концентрации ионов Н+ (а следовательно, и ионов ОН-) в любом водном растворе, кислотность которого лежит в интервале между 1,0 М Н+ и 1,0 М ОН-. Шкала pH составлена на основе ионного произведения воды Kw.
Термин pH определяется выражением
![]()
В строго нейтральном растворе, в котором концентрация ионов Н + составляет 1,0∙10-7 М, величина pH при 25°С равна
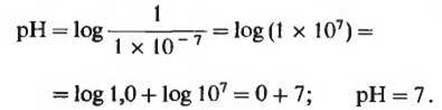
Значение 7,0 для pH строго нейтрального раствора-это не случайно выбранная цифра; оно получено из численного значения ионного произведения воды при 25°С. Растворы, имеющие pH больше чем 7, являются щелочными, поскольку концентрация ионов ОН- в таких растворах больше концентрации ионов Н+. И наоборот, растворы, имеющие pH меньше 7, - это кислые растворы (табл. 4-2).
Особенно важное значение имеет то обстоятельство, что шкала pH является не арифметической, а логарифмической. Если говорят, что величины pH каких-то двух растворов различаются на одну единицу, то это означает, что концентрация ионов Н+ в одном из них в 10 раз больше, чем в другом, хотя мы можем и не знать абсолютные значения pH этих растворов. На рис. 4-9 приведены значения pH для некоторых жидкостей. Заметим, что концентрация ионов Н+ в напитке кока-кола (pH 3) или в красном вине (pH)
Дополнение 4-1. Ионное произведение воды
Ионное произведение воды позволяет вычислить концентрацию ионов Н+, если известна концентрация ионов ОН-, и наоборот. Две приведенные ниже задачи иллюстрируют эту возможность.
1. Какова концентрация ионов Н+ в 0,1 н. растворе NaOH?
Kw = [H+][OH-].
Решая это уравнение относительно [Н+], имеем
![]()
2. Какова концентрация ионов ОН в растворе, в котором концентрация ионов Н+ равна 0,00013 М?
Kw = [H+][OH-].
Решая это уравнение относительно [ОН], имеем 3,7) приблизительно в 10 000 раз больше, чем в крови.
![]()
Таблица 4-2. Шкала pH
|
[Н+], м |
pH |
[ОН-], М |
рОН |
|
1,0 |
0 |
10-14 |
14 |
|
0,1 |
1 |
10-13 |
13 |
|
0,01 |
2 |
10-12 |
12 |
|
0,001 |
3 |
10-11 |
11 |
|
10-4 |
4 |
10-10 |
10 |
|
10-5 |
5 |
10-9 |
9 |
|
10-6 |
6 |
10-8 |
8 |
|
10-7 |
7 |
10-7 |
7 |
|
10-8 |
8 |
10-6 |
6 |
|
10-9 |
9 |
10-5 |
5 |
|
10-10 |
10 |
10-4 |
4 |
|
10-11 |
11 |
0,001 |
3 |
|
10-12 |
12 |
0,01 |
2 |
|
10-13 |
13 |
0,1 |
1 |
|
10-14 |
14 |
1,0 |
0 |
Иногда для количественной характеристики основности, т. е. концентрации ионов ОН- в растворе, используют величину рОН, определяемую выражением
![]()
которое аналогично выражению для pH. Например, значение рОН раствора с 0,1 М концентрацией ионов ОН- равно единице, тогда как значение рОН раствора, в котором ионы ОН- присутствуют в 10-7 М концентрации, равно 7,0. Следует запомнить, что величины pH и рОН связаны одна с другой очень простым соотношением:
pH + рОН = 14.
В табл. 4-2 показана эта обратная зависимость между величинами pH и рОН.
Величину pH водного раствора можно приблизительно оценить, используя различные индикаторные красители, такие, как лакмус, фенолфталеин и фенилрот, однако точные измерения pH в химических и клинических лабораториях производят при помощи специальных стеклянных электродов, которые обладают избирательной чувствительностью по отношению к ионам Н+, но нечувствительны к ионам Na+, К+ и другим катионам. В приборе, называемом рН-метром, сигнал от этого электрода усиливается и сравнивается с сигналом, генерируемым раствором, который имеет точно известную величину pH.
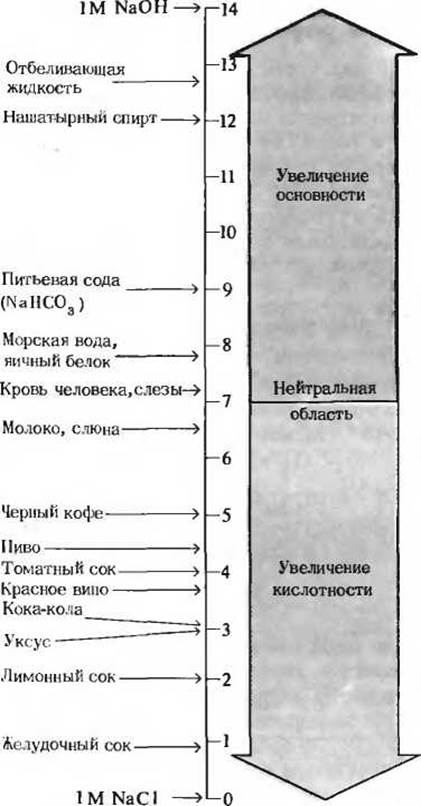
Рис. 4-9. Величины pH некоторых жидкостей.
Измерение pH является одной из наиболее важных и часто используемых в биохимии процедур, поскольку от pH зависят очень многие существенные структурные особенности и активность биологических макромолекул, в частности каталитическая активность ферментов. Более того, измерения pH крови и мочи - это рутинные процедуры, постоянно используемые при диагностике заболеваний. Например, у людей, страдающих тяжелой формой диабета, значение pH крови часто снижено по сравнению с нормальной величиной pH 7,4. Такое состояние называется ацидозом. Наоборот, при некоторых других заболеваниях величина pH у больных может быть выше нормы-состояние, называемое алкалозом.