Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Вода
Стереоизомеры обозначаются в соответствии с их абсолютной конфигурацией
В основе более строгой системы классификации и обозначения стереоизомеров лежит не вращение плоскости поляризации света, а абсолютная конфигурация молекулы стереоизомера, т.е. взаимное расположение четырех замещающих групп, находящихся в вершинах тетраэдра, вокруг локализованного в центре асимметрического атома углерода. Для выяснения конфигурации оптически активных соединений их сравнивают с каким-то одним соединением, выбранным в качестве эталона. Таким соединением служит трехуглеродный сахар глицеральдегид (рис. 5-5), простейший из сахаров, содержащих асимметрический атом углерода (структура сахаров будет рассмотрена в гл. 11). Два возможных стереоизомера глицеральдехида принято обозначать буквами L и D. Абсолютные конфигурации этих стереоизомеров, установленные методом рентгеноструктурного анализа, показаны на рис. 5-5. Непосредственно под изображением стереоизомеров глицеральдегида приведены конфигурации соответствующих стереоизомеров аминокислоты аланина. Для сравнения конфигураций этих стереоизомеров в качестве маркера используют наиболее сильно окисленный атом углерода, связанный с асимметрическим атомом углерода. Таким атомом в молекуле L-аланина служит углерод карбоксильной группы, а в молекуле L-глицеральдегида - углерод альдегидной группы. Если эти два атома расположить в пространстве одинаковым образом, то, как видно из рис. 5-5, аминогруппа L-аланина будет соответствовать гидроксильной группе L-глицеральдегида, а метильная группа (R-гpyппa) L-аланина СН2ОН-группе L-глицеральдегида. Такое же соответствие в абсолютной конфигурации замещающих групп наблюдается и для D-стереоизомеров аланина и глицеральдегида. Стереоизомеры всех хиральных соединений, соответствующие по конфигурации L-глицеральдегиду, обозначаются буквой L, а стереоизомеры, соответствующие D-глицеральдегиду, - буквой D, независимо от направления вращения плоскости поляризации плоскополяризованного света. Таким образом, буквы L и D относятся к абсолютной конфигурации четырех замещающих групп при хиральном атоме углерода, а не к направлению вращения плоскости поляризации. В табл. 5-2 приведены величины удельного вращения некоторых L-аминокислот.
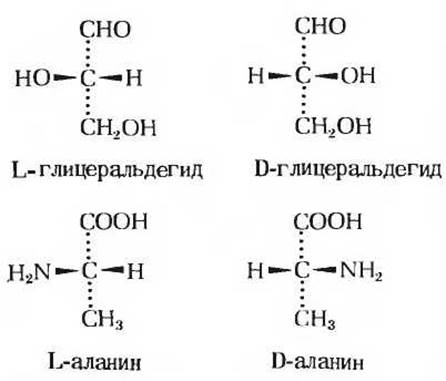
Рис. 5-5. Стерическое соответствие между структурой энантиомеров аланина и абсолютной конфигурацией L- и D-глицеральдегида.
Если соединение содержит два или более хиральных центров, оно может иметь 2n стереоизомеров, где n-число хиральных центров. Глицин не содержит асимметрического атома углерода (см. 5-3), и поэтому у него нет стереоизомеров. Все другие аминокислоты, обычно встречающиеся в белках, содержат по одному асимметрическому атому углерода. Исключение составляют треонин и изолейцин, каждый из которых имеет по два таких атома и 2n = 22 = 4 стереоизомера. Однако в состав белков входит только по одному из этих четырех возможных изомеров той и другой аминокислоты.
Для соединений, содержащих два или более хиральных центров, приведенная выше система обозначения стереоизомеров связана с определенными трудностями и иногда оказывается неоднозначной. Поэтому для таких соединений все чаще используется новая система обозначения стереоизомеров-так называемая RS-система (см. дополнение 5-1).
Дополнение 5-1. RS-система обозначения оптических изомеров
Если соединение содержит два или более хиральных центров, обозначение изомеров на основе DL-системы может оказаться неоднозначным. Чтобы избежать той или иной неопределенности при обозначении оптических изомеров, была предложена так называемая RS-система. Рассмотрим конкретный пример, чтобы понять, как нужно пользоваться этой системой. Прежде всего следует внимательно рассмотреть четыре замещающие группы при каждом асимметрическом атоме углерода и расположить их в порядке уменьшения атомных номеров или в порядке понижения «плотности валентности», так чтобы группа, оказавшаяся последней в этом ряду (имеющая наименьший приоритет), была направлена в противоположную от наблюдателя сторону. Наблюдатель как бы смотрит вниз на рулевое колесо с тремя спицами, причем связь между асимметрическим атомом углерода и замещающей группой с наименьшим приоритетом представляет собой рулевую колонку. Если остальные группы располагаются при этом в порядке уменьшения приоритета по часовой стрелке, то конфигурация молекулы относительно рассматриваемого хирального центра обозначается буквой R (от лат. rectus - правый); если же они располагаются против часовой стрелки, то конфигурация обозначается буквой S (sinister - левый). Таким способом определяются обозначения для всех хиральных центров.
Некоторые часто встречающиеся в биомолекулах функциональные группы располагаются в порядке уменьшения их приоритета следующим образом:
![]()
Конфигурации большинства аминокислот, обнаруживаемых в белках, однозначно устанавливаются с помощью DL-системы; однако треонин и изолейцин представляют особый случай, так как каждый из них содержит два асимметрических атома углерода и для них возможно существование четырех (22) стереоизомеров. В этих изомерах конфигурация замещающих групп относительно каждого хирального центра была установлена путем сравнения их с L- и D-формами глицеральдегида, и изомеры получили соответствующие обозначения (приставка «алло» означает по-гречески «другой»).
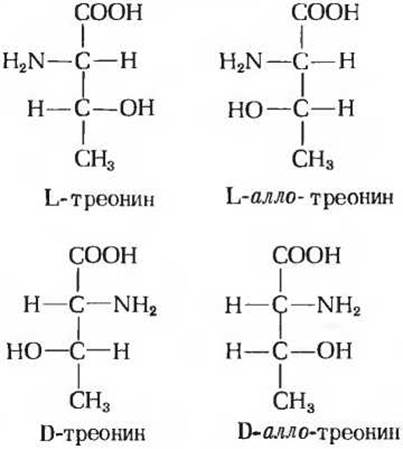
Буквы L и D в обозначениях аминокислот относятся к а-атому углерода (т.е. к углероду во втором положении). Приставка алло относится к конфигурации замещающих групп при атоме углерода в третьем положении. Изомеры соединений, имеющих два хиральных центра, называются диастереоизомерами.
Рассмотрим теперь, как L-треонин, нормальный изомер, встречающийся в белках, обозначается с помощью RS-системы. Начнем с атома углерода во втором положении. Если расположить его четыре замещающие группы в порядке уменьшения атомных номеров или «плотности валентности» атомов, связанных с углеродом-2, то получим следующий ряд: —NH2, —СООН, —СНОНСН3, —Н. Если теперь представить себе молекулу L-треонина как рулевое колесо, у которого рулевой колонкой служит связь между углеродом-2 и атомом водорода, направленная вниз за плоскость рисунка, то остальные три группы расположатся следующим образом:
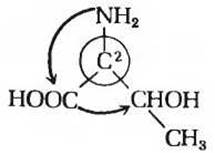
Видно, что направление, в котором происходит уменьшение приоритета (показано стрелками) замещающих групп, соответствует повороту против часовой стрелки. Следовательно, углерод-2 имеет конфигурацию S. Такую же стерическую диаграмму можно нарисовать и для атома углерода-3, причем связь между этим атомом углерода и атомом водорода (группой с наименьшим приоритетом) должна быть направлена за плоскость рисунка:
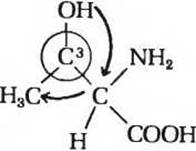
В этом случае все остальные замещающие группы расположатся в порядке уменьшения приоритета по часовой стрелке, т.е. мы получим конфигурацию R. Следовательно, в рамках RS-системы L-треонин обозначается как (2S, 3R)-треонин.
Традиционные обозначения изомеров треонина как L-, D-, L-алло- и D-алло-изомеры известны нам уже в течение многих лет и настолько вошли в привычку, что их продолжают использовать и теперь. То же справедливо и в отношении названий и стереообозначений простых сахаров (гл. 11). Вместе с тем RS-система представляет собой однозначный способ обозначения оптических изомеров соединений, которые либо нельзя сопоставить с изомерами глицеральдегида, либо невозможно однозначно охарактеризовать в рамках DL-системы. Это часто имеет место, когда речь идет о сложных природных соединениях, содержащих два или более хиральных центров.