Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Вода
Семь аминокислот содержат незаряженные полярные R-группы
Эти аминокислоты (рис 5-6) лучше растворяются в воде, т. е. они более гидрофильны, чем неполярные аминокислоты, так как их функциональные группы образуют водородные связи с молекулами воды. В этот класс аминокислот входят глицин, серин треонин, цистеин тирозин, аспарагин и глутамин. Полярность серина, треонина и тирозина обусловлена их гидроксильными группами, полярность аспарагина и глутамина - их амидными группами, а полярность цистеина его сульфгидрильной, или тиоловой, группой. R-гpyппa глицина, представляющая собой всего лишь один атом водорода, слишком мала, чтобы компенсировать сильную полярность а-аминогруппы и а-карбоксильной группы.
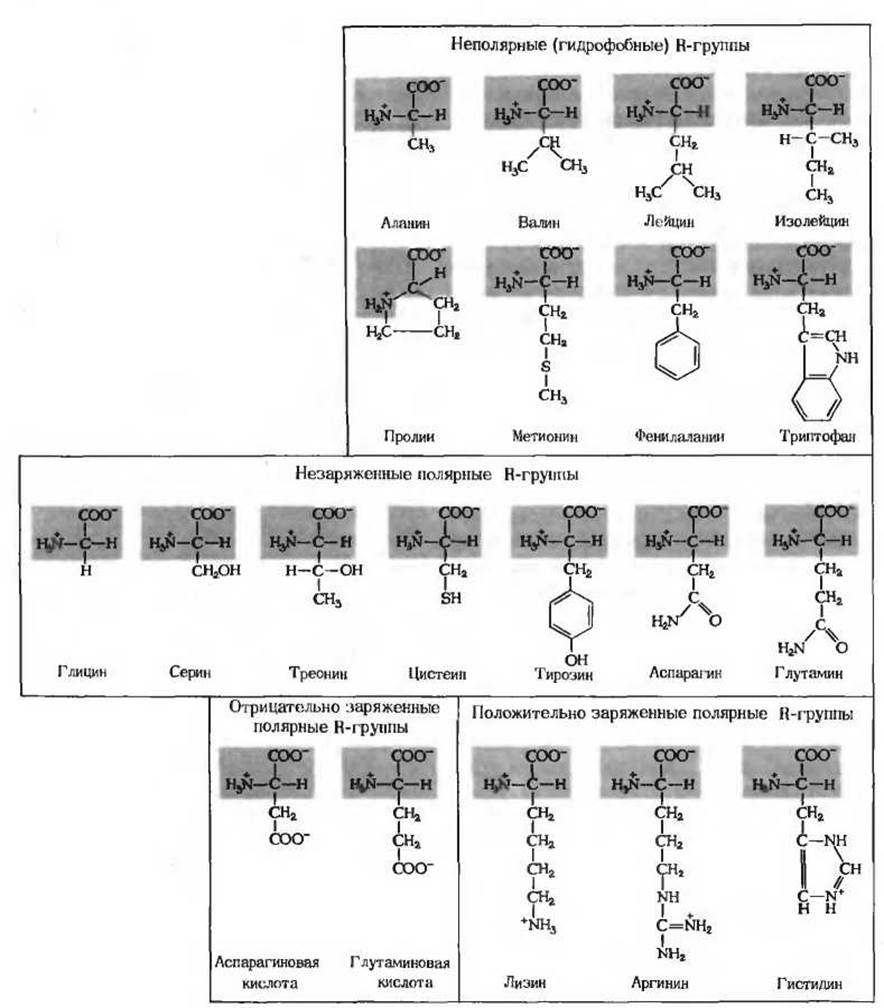
Рис. 5-6. 20 аминокислот, из которых обычно состоят белки. Их аминогруппы и карбоксильные группы показаны ионизированными, как это действительно имеет место при pH 7,0. Части молекул, одинаковые для всех аминокислот, изображены на красном фоне. R-группы обозначены черным.
Аспарагин и глутамин представляют собой амиды двух других аминокислот - соответственно аспарагиновой и глутаминовой кислот, которые также служат строительными блоками белков. При кислотном или щелочном гидролизе аспарагин и глутамин легко переходят в эти аминокислоты. Цистеин и тирозин содержат R-группы, диссоциирующие с образованием ионов Н+, однако при pH 7,0 обе эти группы - тиоловая группа цистеина и гидроксильная группа тирозина - ионизированы лишь в незначительной степени.
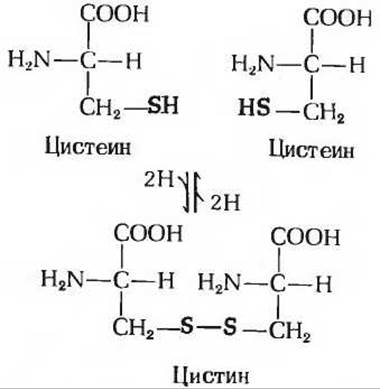
Рис. 5-7. Цистеин и цистин. Тиоловые (—SH) группы двух молекул цистеина легко окисляются и, соединяясь друг с другом, образуют дисульфидную группу цистина. В белках встречаются как цистеин, так и цистин.
Цистеин заслуживает особого упоминания по другой причине. Он может присутствовать в белках в двух формах - либо в форме собственно цистеина, либо в форме цистина, молекула которого представляет собой две молекулы цистеина, ковалентно связанные друг с другом при помощи дисульфидного мостика, образующегося при окислении обеих тиоловых групп (рис. 5-7). Цистин играет важную роль в формировании некоторых белков, например гормона инсулина и иммуноглобулинов (антител). В этих белках две половины молекулы цистина служат строительными блоками двух разных полипептидных цепей, и благодаря дисульфидной связи они оказываются поперечно связанными между собой (разд. 6.8). Такие поперечные связи обычно отсутствуют во внутриклеточных белках, но широко представлены в белках, секретируемых во внеклеточную жидкость, в которой они выполняют свои функции.