Основы биохимии Том 2 - А. Ленинджер 1985
Биоэнергетика и метаболизм
Метаболизм. Общий обзор
Регуляция метаболических путей осуществляется на трех уровнях
В регуляции метаболических путей участвуют механизмы трех типов. Первый из них, наиболее быстро реагирующий на любое изменение ситуации, связан с действием аллостерических ферментов (рис. 13-15), каталитическая активность которых может меняться под влиянием особых веществ, оказывающих стимулирующее или тормозящее действие (их называют эффекторами или модуляторами; разд. 9.18). Как правило, аллостерические ферменты занимают место в начале или поблизости от начала данной мультиферментной последовательности и катализируют ту ее стадию, которая лимитирует скорость всего процесса в целом; обычно роль такой стадии играет практически необратимая реакция. В катаболических процессах, сопровождающихся синтезом ATP из ADP, в роли аллостерического ингибитора одной из ранних стадий катаболизма часто выступает именно этот конечный продукт - ATP. Аллостерическим ингибитором одной из ранних стадий анаболизма нередко служит конечный продукт биосинтеза, например какая-нибудь аминокислота (разд. 9.18). Активность некоторых аллостерических ферментов стимулируется специфическими положительными модуляторами. Аллостерический фермент, регулирующий одну из катаболических последовательностей реакций, может, например, подчиняться стимулирующему влиянию положительных модуляторов-ADP или АМР и ингибирующему действию отрицательного модулятора-АТР. Известны также случаи, когда аллостерический фермент какого-нибудь метаболического пути специфическим образом реагирует на промежуточные или конечные продукты других метаболических путей. Благодаря этому оказывается возможной координация скорости действия различных ферментных систем.
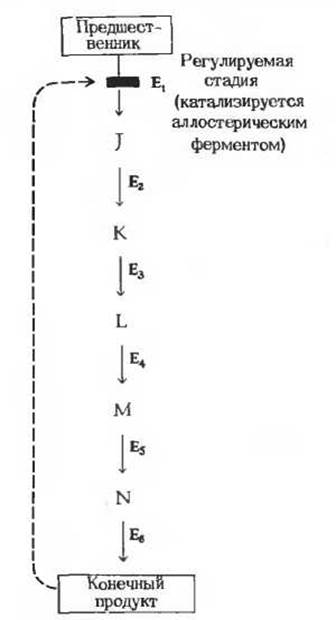
Рис. 13-15. Регуляция катаболического пути по типу обратной связи, т. е. за счет ингибирования аллостерического фермента конечным продуктом данного процесса. Буквами J, К, L и т.д. обозначены промежуточные продукты данного метаболического пути, а буквами Е1, Е2, Е3 и т. д.- ферменты, катализирующие отдельные стадии. Первая стадия катализируется аллостерическим ферментом (E1), который ингибируется конечным продуктом данной последовательности реакций. Аллостерическое ингибирование показано прерывистой красной стрелкой, которая соединяет ингибирующий метаболит с реакцией, катализируемой аллостерическим ферментом. Регулируемая стадия (катализируемая ферментом E1) в условиях клетки обычно представляет собой практически необратимую реакцию.
Второй тип механизмов, регулирующих метаболизм у высших организмов, - это гормональная регуляция (рис. 13-16). Гормонами называют особые химические вещества (химические «посредники»), вырабатываемые различными эндокринными железами и выделяемые непосредственно в кровь; они переносятся кровью к другим тканям или органам и здесь стимулируют или тормозят определенные виды метаболической активности. Гормон адреналин, например, секретируется мозговым веществом надпочечника и переносится кровью в печень, где он стимулирует распад гликогена до глюкозы, что вызывает повышение уровня сахара в крови. Кроме того, адреналин стимулирует распад гликогена в скелетных мышцах; этот процесс приводит к образованию лактата и к запасанию энергии в форме АТР. Адреналин вызывает эти эффекты, присоединяясь к особым рецепторным участкам на поверхности мышечных клеток или клеток печени. Связывание адреналина служит сигналом; этот сигнал передается во внутренние отделы клетки и вызывает здесь ковалентную модификацию, под влиянием которой гликоген-фосфорилаза (первый фермент в системе, катализирующей превращение гликогена в глюкозу и другие продукты; разд. 9.22) переходит из менее активной формы в более активную (рис. 13-16).
Третий тип механизмов, регулирующих метаболизм, связан с изменением концентрации данного фермента в клетке. Концентрация всякого фермента в любой данный момент определяется соотношением скоростей его синтеза и распада. Скорость синтеза некоторых ферментов при определенных условиях резко возрастает; соответственно увеличивается и концентрация данного фермента в клетке. Если, например, животное получает рацион, богатый углеводами, но бедный белком, то в печени у него оказывается крайне низким содержание ферментов, катализирующих в обычных условиях распад аминокислот до ацетил-СоА. Поскольку при таком рационе эти ферменты практически не нужны, они и не вырабатываются в больших количествах. Стоит, однако, перевести животное на рацион, богатый белком, и уже через сутки в его печени заметно повысится содержание ферментов, которые потребуются теперь для расщепления перевариваемых аминокислот. Клетки печени, следовательно, обладают способностью включать или выключать биосинтез специфичных ферментов в зависимости от природы поступающих в них питательных веществ. Это явление носит название индукции ферментов (рис. 13-17).
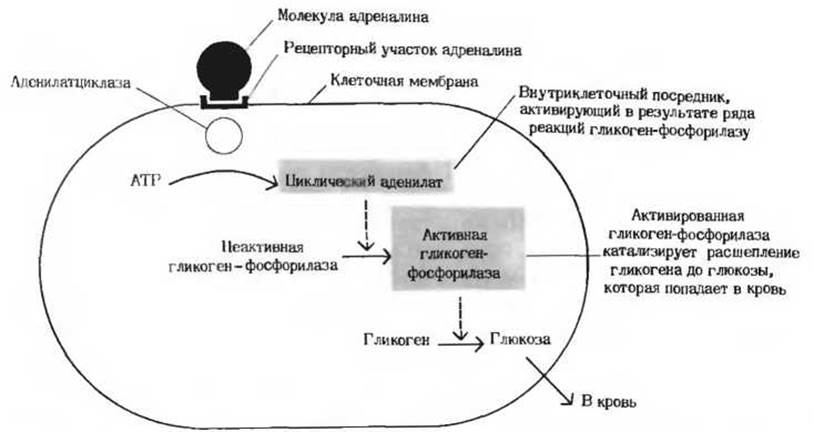
Рис. 13-16. Гормональная регуляция ферментативной реакции. В результате присоединения гормона адреналина к специфическим рецепторам, находящимся на поверхности клеток печени, образуется при участии связанного с мембраной фермента (аденилатциклазы) циклический аденилат. Последний функционирует как аллостерический активатор, или внутриклеточный посредник, под действием которого гликоген-фосфорилаза переходит из неактивной формы в активную, что влечет за собой ускорение превращения гликогена печени в глюкозу крови. Подробно этот метаболический путь описан в гл. 25.
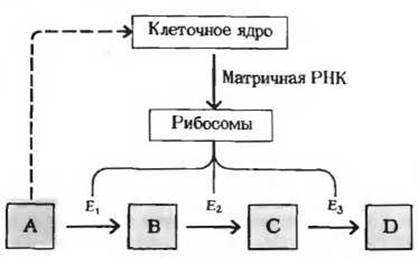
Рис. 13-17. Индукция ферментов. Высокая внутриклеточная концентрация субстрата А может стимулировать биосинтез ферментов Е1, Е2 и Е3. Содержание этих ферментов в клетке возрастает, и тем самым создается возможность для ускорения тех реакций, в результате которых избыток субстрата А удаляется. Избыток субстрата А служит, следовательно, для клеточного ядра сигналом, вынуждающим его «включить» гены, контролирующие образование ферментов E1, Е2 и Е3. Включение генов означает синтез соответствующей матричной РНК; она поступает в рибосомы, и вследствие этого в них осуществляется синтез ферментов Е1, Е2 и Е3.