Основы биохимии Том 2 - А. Ленинджер 1985
Биоэнергетика и метаболизм
Биосинтез углеводов в животных тканях
Гликоген-синтаза и гликоген-фосфорилаза регулируются реципрокно
Ранее мы видели, что расщепление гликогена регулируется посредством ковалентной и аллостерической модуляции гликоген-фосфорилазы (разд. 15.11). Фосфорилаза а, активная форма фермента, содержащая существенные для каталитической активности фосфорилированные остатки серина, дефосфорилируется под действием фосфатазы фосфорилазы и превращается в фосфорилазу b - значительно менее активную форму, которую может активировать АМР (ее аллостерический модулятор). Киназа фосфорилазы превращает фосфорилазу b снова в фосфорилазу а за счет АТР, фосфорилирующего упомянутые остатки серина.
Гликоген-синтаза также существует в двух формах - фосфорилированной и дефосфорилированной, но она регулируется реципрокно по отношению к гликоген-фосфорилазе, т. е. прямо противоположным образом (рис. 20-11). Ее активная форма, гликоген-синтаза а, дефосфорилирована. В результате катализируемого протеинкиназой фосфорилирования за счет АТР по двум гидроксильным группам серина гликоген-синтаза а превращается в менее активную форму, гликоген-синтазу b

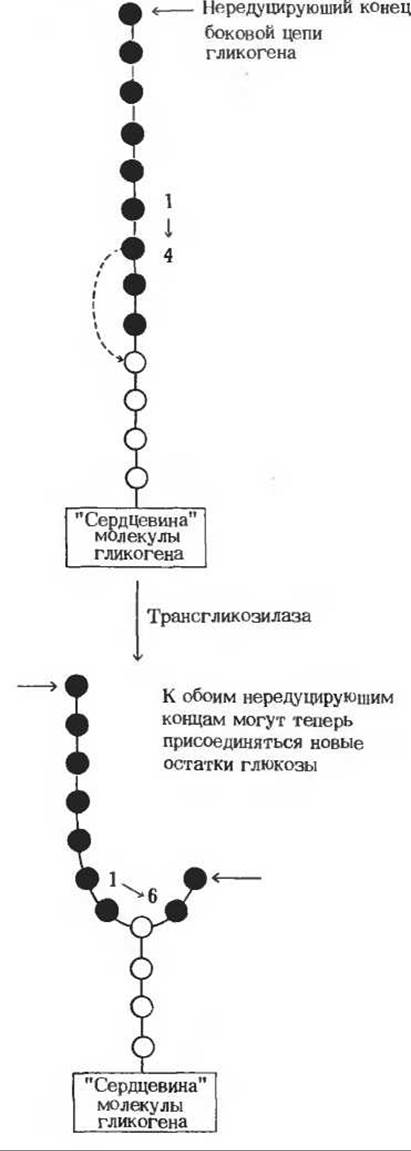
Рис. 20-10. Схема, поясняющая, каким образом при синтезе гликогена в его молекуле возникает новая точка ветвления. В ее образовании участвует ветвящий фермент. Часть цепи, выделенная красным, переносится на остаток глюкозы, находящийся в той же цепи, но ближе к «сердцевине», как показано пунктирной стрелкой Перенесенный фрагмент присоединяется а(1→6)-связью.
Переход менее активной гликоген-синтазы b обратно в активную форму катализируется фосфопротеин-фосфатазой, которая отщепляет фосфатные группы от остатков серина
![]()
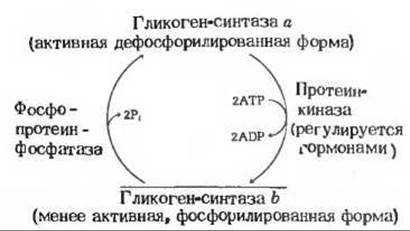
Рис. 20-11. Регуляция активности гликоген- синтазы путем ферментативного фосфорилирования и дефосфорилирования. Сама протеинкиназа также существует в двух формах, активной и неактивной; их соотношение регулируется гормонами (гл. 25).
Таким образом, гликоген-фосфорилаза и гликоген-синтаза регулируются реципрокно: в то время как один из ферментов активируется, активность другого подавляется (рис. 20-12). Сказанное означает, что проявлять полную активность одновременно оба эти фермента, по-видимому, не могут.
Гликоген-синтаза изменяет свою активность также и под влиянием аллостерических модуляторов. Менее активная форма, гликоген-синтаза b, активируется своим аллостерическим модулятором, глюкозо-6-фосфатом. Поскольку активность этой формы гликоген-синтазы зависит от глюкозо-6-фосфата, ее называют зависимой формой или D-формой (от англ. dependent - зависимая). Гликоген-синтаза а не активируется глюкозо-6-фосфатом, т. е. не зависит от него, и потому ее называют независимой формой или 1-формой (от англ. independent - независимая).
Соотношение между скоростями синтеза и распада гликогена в печени регулируется в конечном счете двумя гормонами: адреналином (вырабатывается мозговым веществом надпочечников) и глюкагоном (вырабатывается поджелудочной железой). Эти гормоны действуют, изменяя соотношение активной и неактивной форм гликоген-фосфорилазы и гликоген-синтазы. Секреция адреналина стимулирует расщепление гликогена в печени и мышцах, повышая отношение фосфорилазы а к фосфорилазе b и одновременно понижая отношение гликоген-синтазы а к гликоген-синтазе b. Глюкагон вызывает тот же конечный эффект, но действует иначе. Подробно гормональную регуляцию обмена гликогена мы рассмотрим в гл. 25.
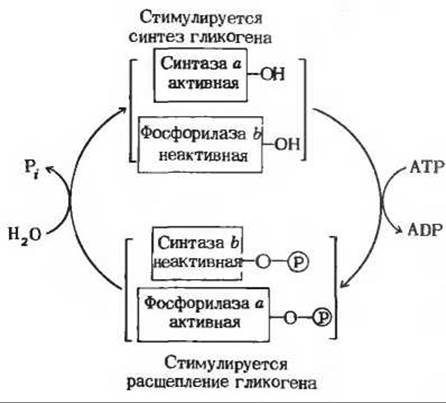
Рис. 20-12. Реципрокная регуляция гликоген-синтазы и гликоген-фосфорилазы путем фосфорилирования и дефосфорилирования. Активная форма каждого из ферментов показана красным, неактивная черным. Символом ![]() обозначены фосфорилированные остатки серина.
обозначены фосфорилированные остатки серина.