Основы биохимии Том 2 - А. Ленинджер 1985
Биоэнергетика и метаболизм
Биосинтез липидов
Присоединение каждого двухуглеродного фрагмента происходит в четыре этапа
а. Конденсация
На первом из четырех этапов удлинения углеродной цепи жирной кислоты ацетильная и малонильная группы, ковалентно связанные с —SH-группами синтазы, подвергаются конденсации с образованием ацетоацетильной группы, ковалентно связанной с —SH-группой фосфопантетеина: одновременно с этим происходит выделение молекулы СО2. Эту реакцию катализирует 3-кетоацил-АПБ—синтаза:
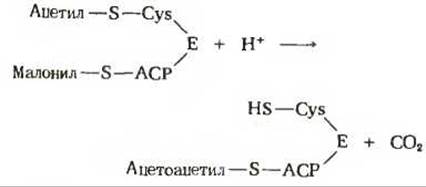
Обратите внимание на то, что ацетильная группа переносится с —SH-группы цистеина на малонильную группу, которая связана с —SH-группой фосфопантетеина; таким образом, она становится концевым двухуглеродным звеном вновь образованной ацетоацетильной группы (рис. 21-9). При этом ацетильная группа вытесняет свободную карбоксильную группу остатка малоната в виде СО2. В ходе этой реакции образуется та самая СО2, которая исходно включилась в молекулу малонил-СоА путем описанной выше ацетил-СоА-карбоксилазной реакции. Таким образом, в ходе биосинтеза жирной кислоты двуокись углерода не используется для построения ковалентного остова молекулы жирной кислоты, а играет роль катализатора, поскольку каждый раз при присоединении новой двухуглеродной единицы она регенирирует, отщепляясь от растущей цепи жирной кислоты.
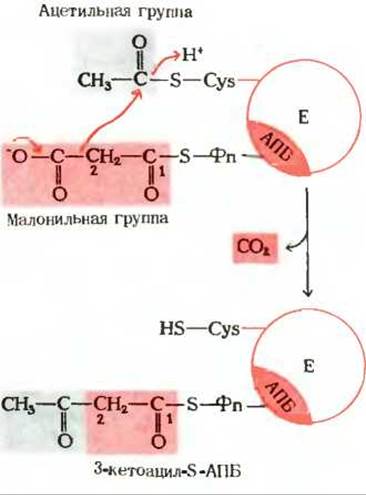
Рис. 21-9. Реакция конденсации в биосинтезе жирных кислот. Отщепление СО2 от малонильной группы (показана красным цветом) создает движущую силу для переноса ацетильной группы (на сером фоне) от Cys—SH на 2-й углеродный атом малонильной группы. Исходная ацетильная группа по завершении синтеза жирной кислоты становится последней двухуглеродной единицей метильного конца молекулы жирной кислоты.
Зачем клеткам понадобилось создавать малонильную группу из ацетильной, присоединяя СО2, которая затем вновь отщепляется при образовании ацетоацетата? Ответ на этот вопрос заключается в том, что при отщеплении СО2 от малонильной группы резко возрастает реакционная способность оставшегося двухуглеродного фрагмента и благодаря этому он может быстро взаимодействовать с ацетильной группой (рис. 21-9).
б. 3-кетовосстановление
Ацетоацетил-S-AПБ подвергается далее восстановлению по карбонильной группе с образованием D-3-гидроксибутирил-S-AПБ. В этой реакции, катализируемой 3-кетоацил-АПБ—редуктазой, в качестве донора электронов используется NADPH (рис. 21.10).
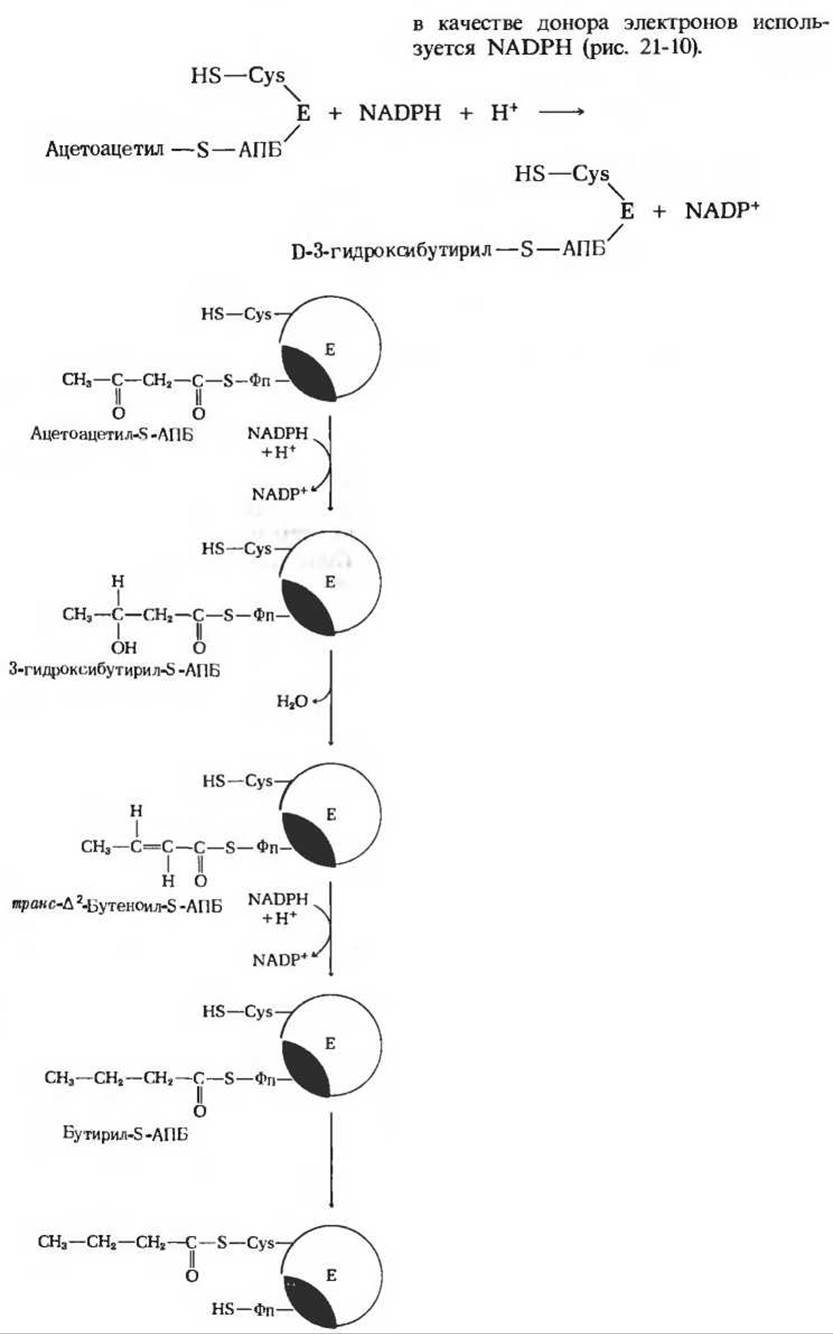
Рис, 21-10. Три последовательных этапа цикла синтеза жирной кислоты. По окончании последней реакции бутирильная группа переносится на —SH-группу цистеина. После этого Фп—SH-группа опять готова соединиться со следующей вступающей в реакцию малонильной группой малонил-СоА.
Отметим, что D-3-гидроксибутирильная группа стерически не идентична L-3-гидроксиацильной группе промежуточного продукта, образующегося при окислении жирных кислот (разд. 18.4,6).
в. Дегидратация
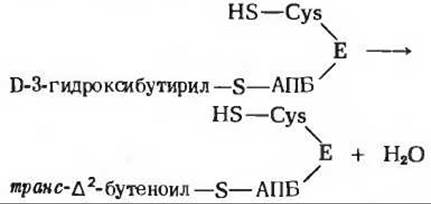
В ходе третьего этапа цикла синтеза жирной кислоты D-3-гидроксибутирил-S-АПБ дегидратируется под действием 3-гидроксиацил-АПБ — дегидратазы с образованием транс-∆2-бутеноил-S- АПБ (рис. 21-10).
г. Насыщение
На четвертом этапе, завершающем один цикл реакций, осуществляемых синтазным комплексом для жирных кислот, двойная связь транс-∆2-бутеноил-S-АПБ восстанавливается, или насыщается, под действием еноил-АПБ—редуктазы с образованием бутирил-S-АПБ (рис. 21-10). Роль донора электронов в этой реакции вновь играет NADPH.
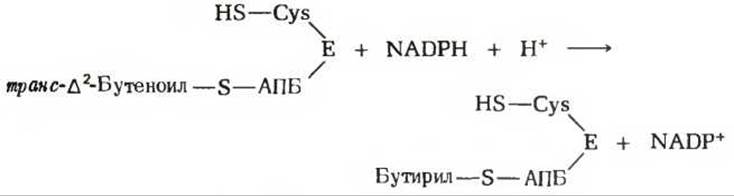
Бутирильная группа после этого переносится с —SH-группы фосфопантетеина на —SH-группу цистеина.
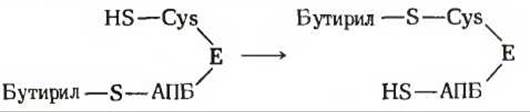
Вновь образованная удлиненная ацильная группа занимает теперь положение при той —SH-группе, с которой исходно была связана ацетильная группа.
Новый цикл реакций, приводящих к удлинению цепи еще на одно двухуглеродное звено, начинается с переноса следующей малонильной группы с малонил-СоА на—SH-группу фосфопантетеина АПБ (рис. 21-11). Далее бутирильная группа покидает —SH-группу цистеина и замещает СO2 в малонильной группе на HS—АПБ. В результате получается шестиуглеродная ацильная группа, ковалентно связанная с —SH-группой фосфопантетеина. В ходе трех следующих этапов синтазного цикла 3-кетогруппа образовавшейся ацильной группы восстанавливается и образуется шестиуглеродная насыщенная ацильная группа подобно тому, как это происходит в предыдущем цикле реакций. Далее гексаноильная группа переносится с —SH-группы фосфопантетеина на —SH-группу цистеина.
После семи таких циклов образуется конечный продукт - пальмитоил—S-АПБ. Процесс наращивания цепи заканчивается на 16-м углеродном атоме, после чего под действием гидролитического фермента молекула пальмитиновой кислоты отщепляется от молекулы АПБ.
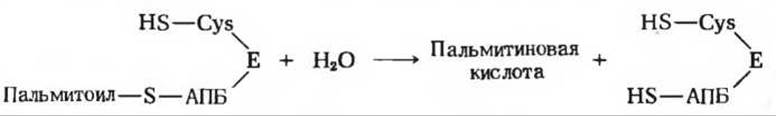
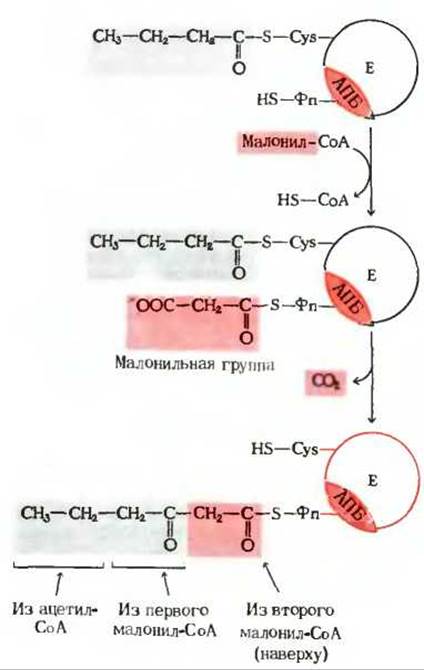
Рис. 21-11. Начало второго оборота цикла синтеза жирной кислоты. Бутирильная группа связана с —SH-группой цистеина. Вступающая в реакцию малонильная группа связывается с Фп—SH-группой. На этапе конденсации бутирильная группа, соединенная с Cys—SH-группой, обменивается на свободную карбоксильную группу малонильного остатка, которая при этом отщепляется в виде СО2 (на красном фоне). В образовавшемся продукте - шестиуглеродной 3-кетоацильной группе - четыре атома углерода происходят из малонил-СоА, а остальные два - из ацетил-СоА, с которого начиналась реакция.
Отметим, что для синтеза пальмитиновой кислоты необходимы два вида химической энергии энергия фосфатной группы АТР и восстановительный потенциал NADPH. АТР нужен для образования тиоэфирной связи в ацетил-СоА и построения малонил-СоА путем присоединения СO2 к ацетил-СоА, тогда как NADP используется для восстановления двойных связей.
NADPH, который необходим для восстановительных реакций, протекающих в ходе биосинтеза жирной кислоты, в разных клетках поступает из двух различных источников В печени NADPH образуется главным образом в реакциях пентозофосфатного пути (разд. 16.13), в основном под действием глюкозо-6-фосфат—дегидрогеназы
![]()
В жировых клетках (адипоцитах) NADPH образуется преимущественно в результате действия малат-дегидрогеназы
![]()
Обе эти реакции, приводящие к образованию NADPH, протекают в цитозоле, в котором молярное отношение NADPH/NADP+ очень велико (около 75), что обеспечивает высокий восстановительный потенциал, необходимый для синтеза жирных кислот. Напротив, молярное отношение NADH/NAD+ в цитозоле значительно меньше (оно составляет приблизительно 8 ∙ 10-4). NADPH в цитозоле прекрасно приспособлен для роли первичного донора водородных атомов, используемых в ходе восстановительных биосинтетических реакций.
Суммируя все изложенное выше, можно сказать, что ферментативный биосинтез пальмитиновой кислоты отличается от ее ферментативного окисления 1) внутриклеточной локализацией; 2) природой переносчика ацильных групп; 3) формой, в которой двухуглеродные единицы присоединяются к цепи жирной кислоты или отщепляются от нее; 4) стереоконфигурацией промежуточного ß-гидроксиацильного соединения; 5) типом пиридинового нуклеотида, используемого в восстановительных реакциях, и 6) участием СO2. Перечисленные различия (табл. 21-1) показывают, что эти два противоположно направленных процесса характеризуются разными физическими и химическими параметрами.
Таблица 21-1. Различия между ферментативным биосинтезом и ферментативным окислением пальмитиновой кислоты
|
Биосинтез |
Окисление |
|
|
Внутриклеточная локализация |
Цитозоль |
Митохондрии |
|
Переносчик ацильных групп |
АПБ |
СоА |
|
Форма, в которой двухуглеродные фрагменты участвуют в реакции |
Малонил-СоА |
Ацетил-СоА |
|
Стереоизомерная форма 3-гидроксиацильной группы |
D |
L |
|
Донор или акцептор электронов |
NADPH |
FAD, NAD+ |
|
Участие СО2 |
Да |
Нет |