Основы биохимии Том 2 - А. Ленинджер 1985
Биоэнергетика и метаболизм
ATP-Цикл и биоэнергетика клетки
Изменения стандартной свободной энергии химических реакций аддитивны
Рассмотрим две последовательно протекающие химические реакции:
![]()
Каждая из этих реакций характеризуется определенной константой равновесия и определенным изменением стандартной свободной энергии, ∆G0'1 и ∆G0'2. Поскольку эти две химические реакции протекают последовательно одна за другой, мы можем исключить компонент В и записать суммарную реакцию в виде
А → С.
Суммарная реакция также имеет свою константу равновесия, и, следовательно, для нее можно рассчитать изменение стандартной свободной энергии ∆G0'S. Это подводит нас к очень важному свойству изменений стандартной свободной энергии. Оказывается, величины ∆G0' последовательно протекающих химических реакций аддитивны. Изменение стандартной свободной энергии суммарной реакции А → С, которое мы обозначили через ∆G0'S равно алгебраической сумме изменений стандартной свободной энергии двух ее отдельных стадий, т.е. величин ∆G0'1 и ∆G0'2.
![]()
Это соотношение крайне важно, поскольку оно дает возможность легко вычислять изменения стандартной свободной энергии для различных последовательностей метаболических реакций. Например, при расщеплении гликогена в мышцах (о котором будет идти речь в следующей главе) протекают две последовательные реакции:
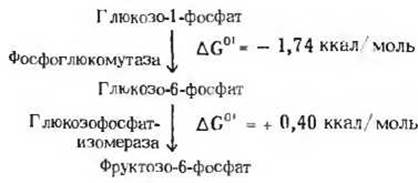
Уравнение суммарной реакции имеет вид
Глюкозо-1-фосфат →
→ Фруктозо-6-фосфат.
Изменение стандартной свободной энергии этой реакции можно определить как алгебраическую сумму величин ∆G0' последовательных стадий:
∆G0'S = - 1,74 + (+ 0,40) =
= - 1,34 ккал/моль.
Часто оказывается возможным вычислить изменение стандартной свободной энергии ∆G0' для какой-либо реакции даже в том случае, когда константа истинного равновесия этой реакции нам не известна. Это можно сделать, если удастся связать исследуемую реакцию с какой-нибудь другой реакцией (для которой известна величина ∆G0') и определить константу равновесия суммарной реакции