Основы биохимии Том 2 - А. Ленинджер 1985
Биоэнергетика и метаболизм
ATP-Цикл и биоэнергетика клетки
АТР может расщепляться также до АМР и пирофосфата
Хотя в клеточных реакциях используемый АТР расщепляется обычно до ADP и фосфата (Рі) а непосредственным акцептором фосфата в реакциях, сопровождающихся выделением энергии, служит ADP, известны и такие клеточные реакции, в которых от молекулы АТР отщепляются в виде одного фрагмента обе его концевые фосфатные группы, ß и у (рис. 14-2); продуктами расщепления оказываются в этом случае неорганический пирофосфат (РРі) и аденозинмонофосфат (АМР). Примером такой реакции может служить ферментативная активация жирных кислот с образованием их СоА-производных (рис. 18-2); жирная кислота приобретает при этом энергию и превращается в соответствующее СоА-производное (рис. 14-16), используемое затем в качестве активированного предшественника при биосинтезе липидов;

Таблица 14-6. Мембранные АТРазы, транспортирующие различные катионы
|
Название фермента |
Тип клеток |
Локализация |
Функция |
|
Na+, К+-АТРаза |
Большинство животных клеток |
Плазматическая мембрана |
Поддерживает высокую внутриклеточную концентрацию К+ |
|
Н+-АТРаза |
Обкладочные клетки слизистой желудка |
То же |
Секретирует Н+ в желудочный сок |
|
Н+-АТРаза |
Животные и растительные клетки |
Внутренняя мембрана митохондрий |
Участвует в окислительном и фотосинтетическом фосфорилировании ADP до АТР |
|
Растительные клетки |
Внутренняя мембрана хлоропластов |
||
|
Бактерии |
Плазматическая мембрана |
||
|
Са2+-АТРаза |
Животные клетки |
То же |
Выкачивает ионы Са2 + из клеток, способствуя накоплению этих ионов в цитозоле |
|
Саркоплазматический ретикулум |
Накачивает ионы Са2+ в цистерны саркоплазматического ретикулума, вызывая расслабление мышцы |
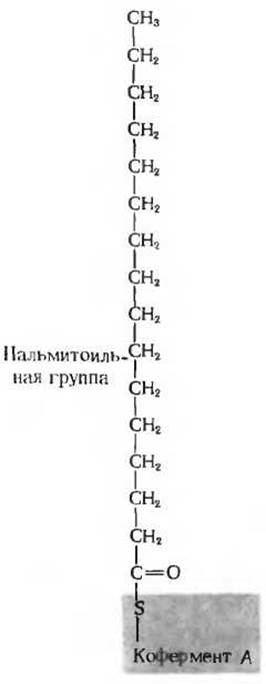
Рис. 14-16. Пальмитоилкофермент А может служить типичным примером Со А-производного жирной кислоты. Гидролиз с разрывом тиоэфирной связи (С—S-связи) между жирной кислотой и коферментом А характеризуется высоким значением ∆G0' равным приблизительно — 7,5 ккал/моль. СоA-производные жирных кислот играют роль активированных предшественников в процессе биосинтеза липидов.
Эта реакция активации сопровождается пирофосфатным расщеплением АТР, продуктами которого являются пирофосфат и АМР; при обычном же ортофосфатном расщеплении от АТР отщепляется только одна ортофосфатная группа, как, например, в гексокиназной реакции

характеризуется величиной ∆G0' = -7,7 ккал/моль, что несколько превышает ∆G0' гидролиза концевой, или у- фосфатной, связи. Неорганический пирофосфат затем гидролизуется при участии пирофосфатазы с образованием двух молекул неорганического ортофосфата.
![]()
Суммарная реакция описывается уравнением
![]()
Величина ∆G0' этой суммарной реакции равна алгебраической сумме величин ∆G0' двух ее последовательных стадий. Нетрудно видеть, что величина ∆G0' суммарной реакции ровно вдвое превышает величину ∆G0' гидролиза концевых фосфатных групп АТР и ADP.
Расходование двух фосфатных групп АТР на активацию одной молекулы предшественника может показаться расточительством, т. е. может сложиться впечатление, что энергия фосфатных групп расходуется в этом случае неэкономно. Позже мы увидим, однако, что за этим кроется важный механизм, обеспечивающий завершение некоторых биосинтетических реакций. Необычным образом используется пирофосфатное расщепление АТР, например, светляками: оно служит им источником энергии для испускания света (дополнение 14-3).
АМР возвращается в ATP-цикл благодаря действию особого фермента, присутствующего во всех животных клетках. Этот фермент, аденилаткиназа, катализирует обратимое фосфорилирование АМР до ADP:
![]()
Образующийся при этом ADP може г затем опять фосфорилироваться до АТР.
У аденилаткиназы есть еще одна важная функция: этот фермент способствует поддержанию уровня АТР в клетке, когда катализируемая им реакция протекает в обратном направлении
![]()
т. е. когда он катализирует перенос концевой фосфатной группы от одной молекулы ADP к другой, которая при этом превращается в АТР. Таким образом в сокращающихся мышцах аденилаткиназа позволяет использовать в качестве источника энергии две фосфатные группы АТР, у и ß (рис. 14-17). Следовательно, действуя на ADP аденилаткиназа может пополнять запас креатинфосфата, который во время мышечного сокращения служит источником АТР.
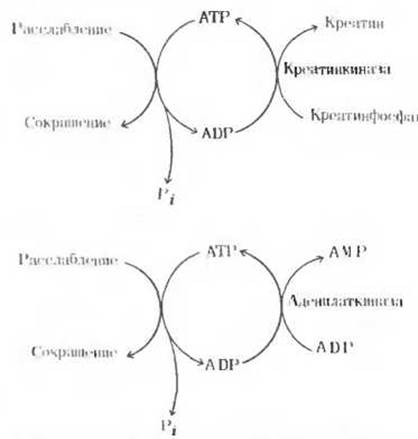
Рис. 14-17. Два процесса, обеспечивающие поддержание соответствующего уровня АТР в быстро сокращающихся скелетных мышцах, работающих в условиях анаэробиоза.
Дополнение 14-3. АТР поставляет энергию для биолюминесценции светляков
Биолюминесценция, для которой требуются значительные количества энергии, свойственна многим видам грибов, морским микроорганизмам, медузам, ракообразным и светлякам (рис. 1). У светляков в последовательности реакций, обеспечивающих преобразование химической энергии в энергию света, используется сочетание энергии АТР и окислительной энергии. Уильям Мак-Элрой и его коллеги из Университета Джона Гопкинса выделили из многих тысяч светляков, собранных для этой цели по их просьбе детьми в окрестностях Балтимора, два главных биохимических компонента, участвующих в процессе свечения: люциферин (рис. 2), представляющий собой карбоновую кислоту довольно сложного строения, и фермент люциферазу. Для генерации световых вспышек люциферин сначала должен быть активирован в ферментативной реакции с АТР. На этой стадии пирофосфатное расщепление АТР приводит к образованию люцифериладенилата (рис. 2). Затем под действием молекулярного кислорода происходит катализируемое люциферазой окислительное декарбоксилирование люциферина, в результате чего образуется оксилюциферин. Именно эта реакция, протекающая через ряд промежуточных стадий, сопровождается световыми вспышками (рис. 3). Спектральный состав испускаемого света у разных видов светляков различен; он зависит, по всей вероятности, от структуры люциферазы. Завершается цикл последовательностью реакций, в результате которых из оксилюциферина вновь образуется люциферин. У других биолюминесцентных организмов свечение обусловливается ферментативными реакциями иного типа.

Рис. 1. Светляк.
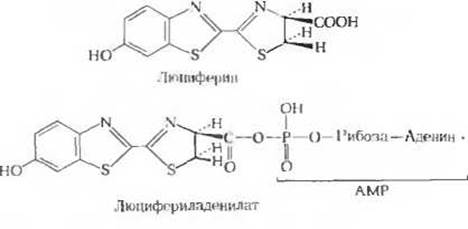
Рис. 2. Главные компоненты, обеспечивающие биолюминесценцию светляков.
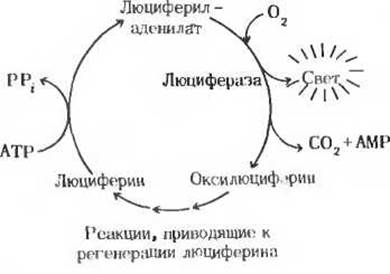
Рис. 3. Циклическое превращение компонентов, обеспечивающих люминесценцию светляка.
Очищенные люциферин и люциферазу светляков используют для измерения очень малых количеств АТР. Мерой количества АТР служит при этом интенсивность световой вспышки. Таким способом удается определять количества АТР порядка нескольких пикомолей (10-12 моль).
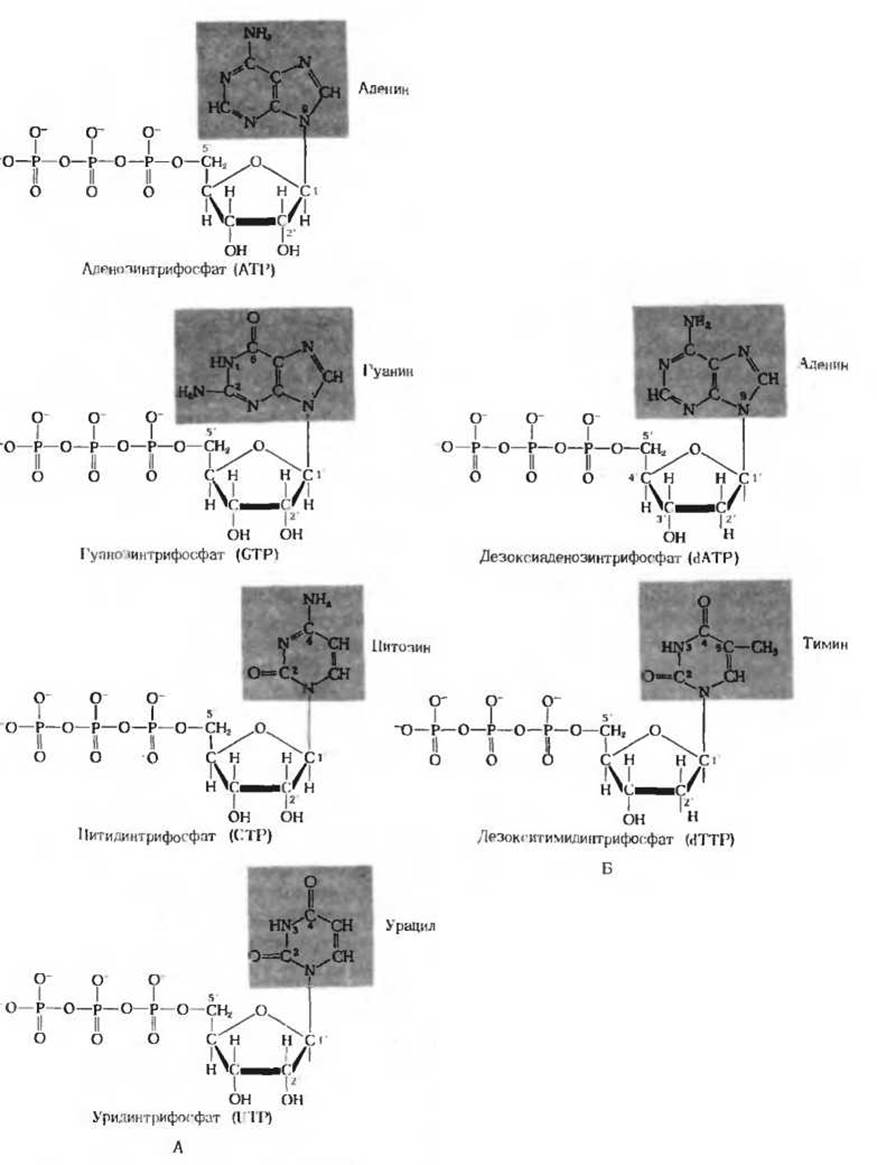
Рис. 14-18. А. Четыре нуклеозид-5'-трифосфата. Каждый из них содержит особое основание (показано на красном фоне). Б. В молекуле дезоксинуклеозид-5'-трифосфатов в положении 2' вместо гидроксила стоит атом водорода. Дезокситимидинтрифосфат служит предшественником остатков тимидиловой кислоты, входящих в состав ДНК. В РНК остатков тимидиловой кислоты нет; вместо них здесь присутствуют остатки уридиловой кислоты (ее предшественником служит уридинтрифосфат).