Основы биохимии Том 2 - А. Ленинджер 1985
Биоэнергетика и метаболизм
Гликолиз - центральный путь катаболизма глюкозы
Вовлечение остатков глюкозы в процесс гликолиза регулируется
Скорости главных катаболических реакций, обеспечивающих расщепление глюкозы и извлечение химической энергии в форме АТР, в каждый данный момент регулируются в соответствии с потребностями клетки в АТР независимо от того, как будет затем этот АТР использоваться - в биосинтетических реакциях, для активного переноса веществ или для механической работы в сократительных структурах. Поскольку продукты расщепления глюкозы играют важную роль и в качестве предшественников, и как промежуточные продукты других метаболических процессов, регуляторные ферменты катаболизма углеводов распознают также соответствующие сигналы других метаболических путей и отвечают на эти сигналы. Теперь мы познакомимся с теми регуляторными ферментами, которые регулируют скорость расщепления углеводов на гликолитическом пути.
Рассмотрим прежде всего, как регулируется само вступление остатков глюкозы на путь гликолиза. Вовлечение глюкозных остатков в процесс гликолиза обеспечивают две важные реакции, и обе эти реакции контролируются регуляторными ферментами. Первая такая реакция - это катализируемое гексокиназой фосфорилирование свободной глюкозы в положении 6 за счет АТР. В некоторых тканях, например в скелетных мышцах, гексокиназа функционирует как аллостерический фермент и ингибируется продуктом реакции глюкозо-6-фосфатом, как это показано на рис. 15-13. Всякий раз, когда концентрация глюкозо-6-фосфата в клетке сильно возрастает, т. е. когда он образуется быстрее, чем потребляется, наступает ингибирование - гексокиназа под действием глюкозо-6-фосфата выключается и дальнейшего фосфорилирования глюкозы не происходит до тех пор, пока избыток глюкозо-6-фосфата не будет использован. В печени, однако, преобладает другой фермент - глюкокиназа, который не ингибируется глюкозо-6-фосфатом (разд. 15.6,а). Поэтому в печени, способной хранить большие количества гликогена, избыточная глюкоза крови может фосфорилироваться с образованием глюкозо-6-фосфата, который затем через глюкозо-1-фосфат превращается в гликоген, т. е. в запасной полисахарид. При повышении концентрации глюкозы в крови гормон инсулин, выделяемый поджелудочной железой в кровь, стимулирует синтез глюкокиназы. При диабете и во время голодания глюкокиназная активность понижена.
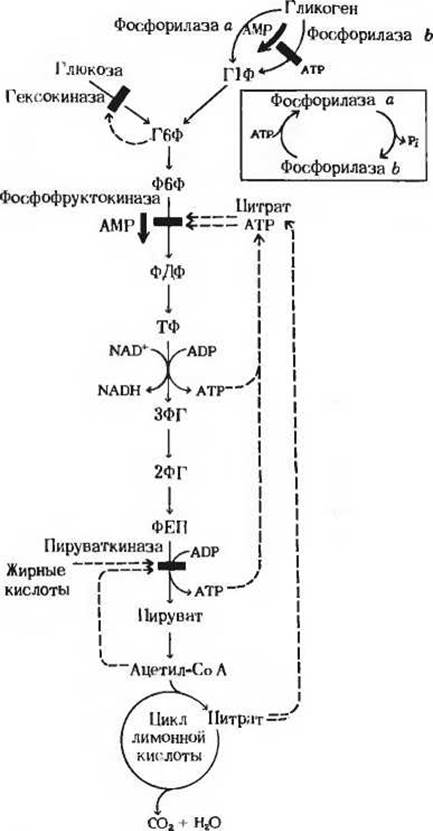
Рис. 15-13. Механизм, с помощью которого регулируется включение остатков глюкозы в процесс гликолиза и расщепление их на этом пути. Регуляторное ингибирование обозначено красными прерывистыми стрелками, указывающими на блокируемый этап (красная полоска поперек стрелки, показывающей направление реакции); регуляторное стимулирование обозначено красными жирными стрелками, параллельными стрелкам, показывающим направление реакции. Г1Ф-глюкозо-1-фосфат; Г6Ф глюкозо-6-фосфат; Ф6Ф фруктозо-6-фосфат; ФДФ фруктозо-1,6-лифосфат; ТФ триозофосфат; 3ФГ-3-фосфоглицерат; 2ФГ 2-фосфоглицерат; ФЕП - фосфоенолпируват.
Во второй реакции, поставляющей глюкозные остатки для процесса гликолиза, субстратом служит гликоген. Эта реакция катализируется гликоген-фосфорилазой, которая также представляет собой регуляторный фермент. Как в печени, так и в мышцах гликоген-фосфорилаза занимает стратегически важную позицию между резервуаром топлива-гликогеном и гликолитической системой, назначение которой состоит в использовании топлива. В скелетных мышцах этот фермент присутствует в двух формах - в каталитически активной фосфорилированной форме (фосфорилаза а) и в значительно менее активной дефосфорилированной форме (фосфорилаза b). Фосфорилаза а была получена в кристаллическом виде (мол. масса 190000). Ее молекулы состоят из двух идентичных субъединиц, каждая из которых содержит существенный для каталитической активности остаток серина в фосфорилированной форме (рис. 15-14). Скорость превращения структурных единиц гликогена в глюкозо-1-фосфат регулируется в мышцах соотношением активной фосфорилазы а и менее активной фосфорилазы b.
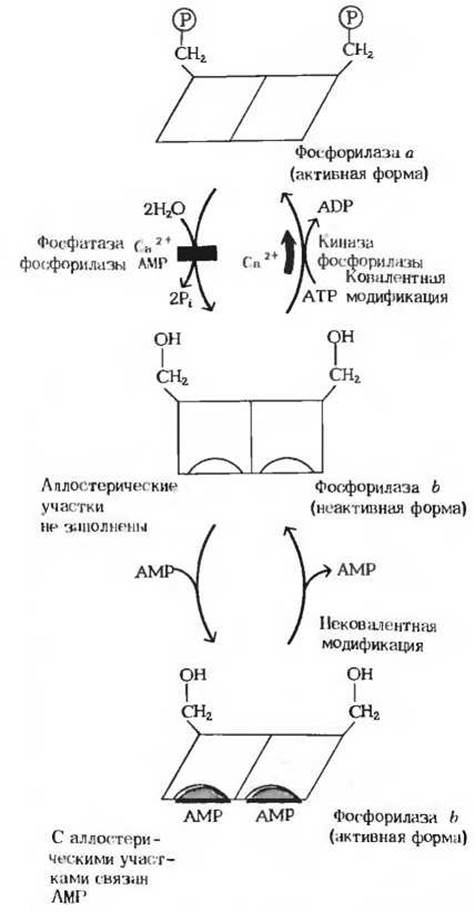
Рис. 15-14. Регуляция активности гликогенфосфорилазы. Молекула этого фермента состоит из двух субъединиц. В каждой из них имеется важный для каталитической активности остаток серина. По гидроксильной группе этого остатка серина обе субъединицы фермента фосфорилируются под действием киназы фосфорилазы, в результате чего образуется фосфорилаза а. Эта реакция стимулируется ионами Са2+ Дефосфорилирование фосфорилазы а подавляется ионами Са2+ и АМР. Фосфорилаза b может активироваться также в результате нековалентного связывания АМР в аллостерических участках молекулы фермента. Конформационные изменения, которые претерпевает фермент, представлены здесь в схематическом виде.
Взаимопревращения двух этих форм гликоген-фосфорилазы происходят под действием специфичных ферментов, катализирующих процесс ковалентной модификации (разд. 9.22) фосфорилазы. Фосфорилаза а превращается в менее активную фосфорилазу b под действием фермента, называемого фосфатазой фосфорилазы а; этот фермент, катализируя гидролитический разрыв связей, удаляет из молекулы фосфорилазы а фосфатные группы, необходимые для каталитической активности (рис. 15-14). Фосфорилаза b вновь превращается в активную фосфорилазу а под действием фермента, называемого киназой фосфорилазы b; он катализирует реакцию, в ходе которой АТР фосфорилирует остатки серина в активном центре молекулы фосфорилазы b, что и приводит к образованию фосфорилазы а. Таким образом, благодаря действию двух ферментов, фосфатазы фосфорилазы а и киназы фосфорилазы b, соотношение активной фосфорилазы а и сравнительно мало активной фосфорилазы b в клетке может изменяться.
В мышцах действует второй механизм регуляции гликоген-фосфорилазной активности. Фосфорилаза b, сравнительно мало активная форма, может становиться более активной в результате нековалентного связывания с аллостерическим модулятором этого фермента, которым является АМР; концентрация же АМР в мышцах возрастает по мере распада АТР в сократительных системах (рис. 15-14, см. также разд. 14.17). Активации фосфорилазы b под действием АМР препятствует АТР, выступающий в роли отрицательного модулятора. Таким образом, активность фосфорилазы b определяется соотношением АМР и АТР. В отличие от фосфорилазы b фосфорилаза а не активируется АМР; поэтому фосфорилазу а называют иногда AMP-независимой формой, а фосфорилазу b-AMP-зависимой. Итак, есть два механизма регуляции, которым подчиняется гликогенфосфорилаза скелетной мышцы: 1) ковалентная модификация посредством фосфорилирования или дефосфорилирования остатков серина в активном центре фермента и 2) аллостерическая регуляция фосфорилазы b путем нековалентного связывания с АМР или АТР. В покоящейся мышце почти вся фосфорилаза находится в неактивной, или b-форме, поскольку в такой мышце концентрация АТР гораздо выше, чем концентрация АМР.