Основы биохимии Том 2 - А. Ленинджер 1985
Биоэнергетика и метаболизм
Перенос электронов, окислительное фосфорилирование и регуляция синтеза АТР
Каждая сопряженная окислительно-восстановительная пара характеризуется определенным стандартным потенциалом
Способность любой сопряженной кислотно-основной пары обратимо отдавать протон характеризуется константой диссоциации (разд. 4.8). Точно так же можно охарактеризовать количественно, при помощи константы, способность каждой сопряженной окислительно-восстановительной пары обратимо отдавать электрон. Эту способность выражают стандартным окислительно-восстановительным потенциалом E'0, величина которого по определению равна электродвижущей силе (э. д. с.) в вольтах, возникающей в полуэлементе, в котором донор электронов и сопряженный с ним акцептор электронов, присутствующие в концентрациях 1,0 М при 25°С и pH 7,0, находятся в равновесии с электродом, способным принимать электроны от донора и передавать их акцептору (рис. 17-3). Для того чтобы измерить величину э. д. с., возникающую в таком полуэлементе, его присоединяют к стандартному полуэлементу, э.д. с. которого известна (рис. 17-3). В качестве стандартного полуэлемента в настоящее время принят водородный электрод, э. д. с. которого при давлении газообразного Н2 1 атм, концентрации ионов Н+ 1,0 М (что соответствует pH 0) и температуре 25°С условно считают равной нулю. Скорригированный для pH 7,0 (т.е. для значения pH, принятого в качестве стандарта при биохимических расчетах) стандартный потенциал водородного электрода равен -0,41 В (рис. 17-3).
В биохимии для выражения стандартных потенциалов принято пользоваться понятием восстановительный потенциал. Чем более отрицательной величиной выражается восстановительный потенциал системы, тем выше ее способность отдавать электроны; и наоборот, чем более положительной величиной выражается восстановительный потенциал, тем выше способность системы присоединять электроны. Термины стандартный восстановительный потенциал, стандартный потенциал и стандартный окислительно-восстановительный потенциал равнозначны.
В табл. 17-1 приведены значения стандартных восстановительных потенциалов для некоторых сопряженных окислительно-восстановительных пар, играющих важную роль при переносе электронов в биологических системах. Они расположены в порядке возрастания потенциала, т.е. в порядке снижения способности отдавать электроны. Таким образом, сопряженные окислительно-восстановительные пары с относительно большей отрицательной величиной стандартного потенциала будут отдавать электроны парам, расположенным в этом перечне ниже, у которых стандартный потенциал выражается более положительной величиной. Например, у пары изоцитрат/а-кетоглутарат + СО2 при концентрациях компонентов 1,0 М стандартный потенциал E'0 равен — 0,38 В. Поэтому в присутствии изоцитратдегидрогеназы (разд. 16.5) она будет отдавать свои электроны окислительновосстановительной паре NADH/NAD+, имеющей более положительный потенциал. Вместе с тем большая положительная величина стандартного потенциала окислительно-восстановительной пары вода/кислород (+0,82 В) указывает на то, что у этой пары способность отдавать электроны (т.е. способность образовывать молекулярный кислород) выражена очень слабо. Можно сформулировать это иначе, сказав, что у молекулярного кислорода очень велико сродство к электронам или водородным атомам. Стандартные потенциалы следует выражать в вольтах, однако для удобства их часто указывают в милливольтах.
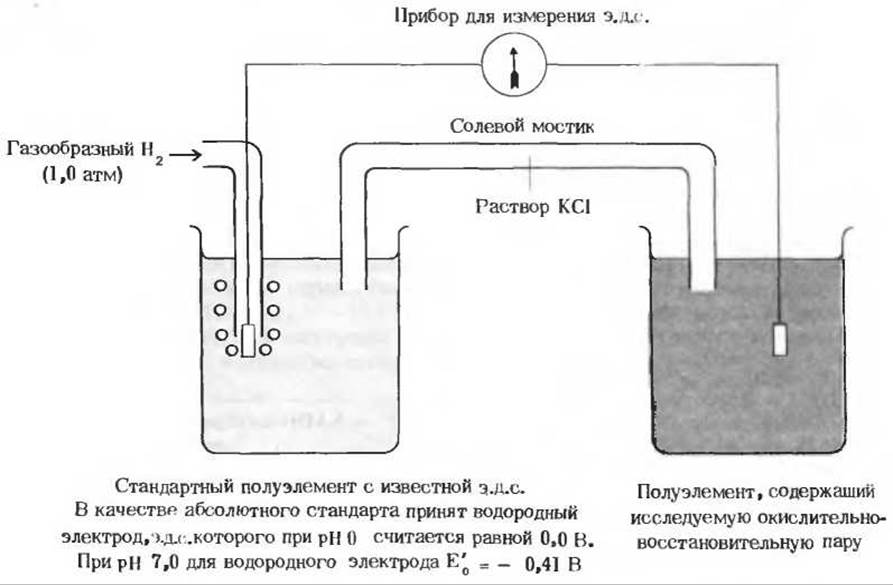
Рис. 17-3. Измерение стандартного восстановительного потенциала. В правый сосуд помещен раствор, содержащий смесь окисленной и восстановленной форм интересующей нас окислительно-восстановительной пары в концентрациях 1,0 М. В этот раствор погружен электрод (обычно платиновый), соединенный внешней цепью со стандартным полуэлементом (левый сосуд), содержащим окислительно-восстановительную пару, потенциал которой известен.
В качестве абсолютного стандарта принят водородный электрод, представляющий собой платиновую пластинку, погруженную в раствор с 1,0 М Н+ (pH 0) и омываемую током газообразного Н2 при давлении 1,0 атм. Стандартный восстановительный потенциал водородного электрода считается равным нулю. Электроды могут присоединять или отдавать электроны окислительно-восстановительным парам в каждом полуэлементе в зависимости от относительной величины их потенциалов. Солевой мостик, содержащий насыщенный раствор КСl, осуществляет электрическое соединение между исследуемым и стандартным полуэлементами. Направление потока электронов во внешней цепи зависит от относительного «давления» электронов, или потенциала обоих элементов, но этот поток всегда направлен от элемента с более отрицательным потенциалом к элементу с более положительным потенциалом. По измеряемой э. д. с. н известной э.д.с. стандартного полуэлемента определяют э.д- с. полуэлемента, содержащего исследуемую окислительно-восстановительную пару.
Таблица 17-1. Стандартные восстановительные потенциалы E'0 некоторых сопряженных окислительно-восстановительных пар, играющих важную роль в окислительном метаболизме1)

1) Приведены данные, рассчитанные для концентраций всех компонентов 1 М. pH 7,0 и температуры 25°С Показаны протекающие в полуэлементе реакции, которые характеризуют сродство данной системы к электронам. Чем более отрицательной является величина E'0, тем это сродство ниже: и наоборот, чем она более положительна, тем выше это сродство. Поэтому электроны будут стремиться переходить от одной окислительно-восстановительной пары к другой в направлении более положительного E'0. Красным выделены потенциалы, занимающие особое, пограничное, положение, а именно потенциалы окислительно-восстанови тельных пар Н2/2Н+ и H2O/1/2O2.