Основы биохимии Том 2 - А. Ленинджер 1985
Биоэнергетика и метаболизм
Перенос электронов, окислительное фосфорилирование и регуляция синтеза АТР
Пиридиновые нуклеотиды выполняют коллекторную функцию
Большинство электронных пар поступает в дыхательную цепь благодаря действию дегидрогеназ, использующих в качестве акцепторов электронов коферменты NAD+ или NADP+ (рис. 17-6). Всю эту группу в целом называют NAD (Р)-зависимыми дегидрогеназами. Мы уже встречались с отдельными ее представителями, когда рассматривали процесс гликолиза и цикл лимонной кислоты. Существует, однако, еще и много других. Некоторые биологически важные реакции, катализируемые такими дегидрогеназами, приведены в табл. 17-2. Дегидрогеназы катализируют обратимые реакции, которые в общем виде могут быть записаны следующим образом:

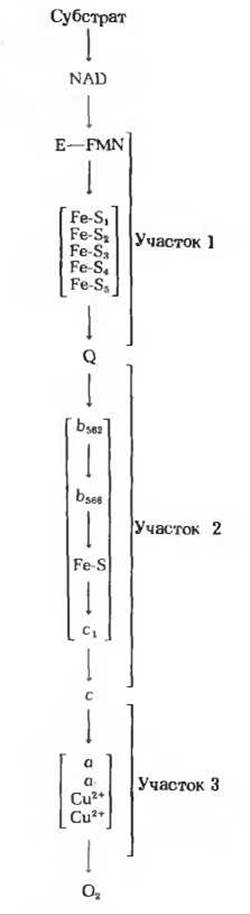
Рис. 17-5. Полный набор переносчиков электронов, входящих в состав дыхательной цепи.
На участке 1 имеется не менее пяти различных железо-серных центров. Участок 2 включает две разные формы цитохрома b (с разными максимумами поглощения) и один железо-серный центр, отличный от тех, какие имеются на участке 1. Участок 3 содержит в дополнение к цитохромам а и а3 еще и два иона меди.
Ни точной последовательности, ни функции всех этих окислительно-восстановительных центров мы пока еще не знаем.
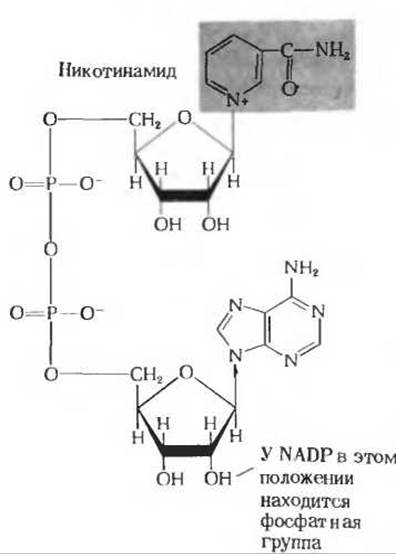
Рис. 17-6 Никотинамидадениндинуклеотид (NAD) и никотинамидадениндинуклеотидфосфат (NADP). А. Окисленные формы (NAD+ и NADP+). Никотинамид (на красном фоне) представляет собой один из витаминов группы В (разд. 10.6); это та часть молекулы NAD, которая принимает участие в переносе электронов. Б. Восстановление никотинамидного кольца NAD+ субстратом. Два восстановительных эквивалента переносятся от субстрата (обозначенного здесь RCH2OH) на NAD+ в форме гидрид-иона(:Н-). Второй водородный атом, отщепляемый от субстрата, превращается в ион Н+.
Подавляющее большинство таких дегидрогеназ содержит NAD+ (табл. 17-2). У некоторых, как, например, у глюкозо-6-фосфатдегидрогеназы (разд. 16.13), акцептором электронов служит NADP+. И лишь совсем немногие, такие, как глутаматдегидрогеназа, способны взаимодействовать как с NAD+, так и с NADP (табл. 17-2). Часть пиридинзависимых дегидрогеназ локализована в цитозоле, часть - в митохондриях, а некоторые присутствуют и здесь, и там. Дегидрогеназы цитозоля способны взаимодействовать только с теми пиридиновыми нуклеотидами, которые находятся в цитозоле; сходным образом обстоит дело и с митохондриальными дегидрогеназами - обычно они взаимодействуют только с пиридиновыми нуклеотидами матрикса митохондрий. Цитозольный и митохондриальный пулы NAD и NADP отделены друг от друга митохондриальной мембраной, которая для этих коферментов непроницаема. Мы еще вернемся к этому вопросу.
Среди NAD-зависимых дегидрогеназ, участвующих в углеводном обмене, главную роль играют глицеральдегидфосфатдегидрогеназа и лактатдегидрогеназа гликолитической системы, локализующиеся в цитозоле, а также пируватдегидрогеназа, находящаяся в митохондриях (табл. 17-2). Три NAD-зависимые дегидрогеназы участвуют в митохондриях в цикле лимонной кислоты: изоцитратдегидрогеназа, а-кетоглутаратдегидрогеназа и малатдегидрогеназа. К числу других важных митохондриальных дегидрогеназ относятся: 3-гидроксиацил-СоА-дегидрогеназа, участвующая в цикле окисления жирных кислот, ß-гидроксибутиратдегидрогеназа (гл. 18) и глутаматдегидрогеназа, функция которой связана с катаболизмом аминокислот (гл. 19).
Таблица 17-2. Некоторые важные реакции, катализируемые NAD(P)-зависимыми дегидрогеназами

1) М митохондрии; Ц - цитозоль.
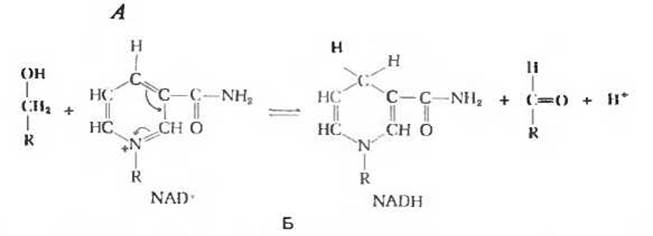
Пиридинзависимые дегидрогеназы отщепляют от своих субстратов по два водородных атома. Один из них в виде гидрид-иона (:Н-) переносится на NAD+ или NADP+, а второй в виде иона Н+ переходит в среду. Каждый гидрид-ион несет два восстановительных эквивалента; один из них в форме водородного атома присоединяется к четвертому углеродному атому никотинамидного кольца, а второй в виде электрона передается азоту этого кольца (рис. 17-6).
Поскольку большая часть клеточных дегидрогеназ переносит водородные атомы от субстратов на NAD+, можно сказать, что этот кофермент выполняет коллекторную функцию - собирает пары восстановительных эквивалентов, поступающие от разных субстратов, в одной молекулярной форме, в форме NADH (рис. 17-7). В конечном счете NAD+ может собирать в этой форме также и восстановительные эквиваленты от субстратов, на которые действуют NADP-зависимые дегидрогеназы. Это оказывается возможным благодаря действию пиридиннуклеотид-трансгидрогеназы - сложного фермента, катализирующего реакцию
![]()