Основы биохимии Том 2 - А. Ленинджер 1985
Биоэнергетика и метаболизм
Окисление жирных кислот в тканях животных
Процесс поступления жирных кислот в митохондрии состоит из трех этапов
Жирные кислоты поступают в цитозоль из двух источников. Некоторые свободные жирные кислоты доставляются клеткам кровью, будучи присоединены к сывороточному альбумину. Отделившись от него, они проходят сквозь клеточные мембраны в цитозоль. Вторым источником жирных кислот служат содержащиеся в самом цитозоле триацил- глицеролы, расщепляющиеся под действием липаз. Свободные жирные кислоты, присутствующие в цитозоле, не способны пройти через митохондриальные мембраны. Они могут попасть в митохондриальный матрикс, в котором происходит их окисление, лишь после того, как подвергнутся ряду ферментативных превращений в трехэтапном процессе. Первый этап этих превращений осуществляется ацил-СоА-синтетазами ферментами, присутствующими в наружной митохондриальной мембране. Эти ферменты катализируют реакцию
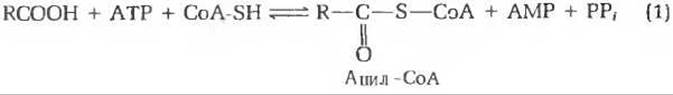
где RCOOH означает жирную кислоту с длинной цепью, а РРi - неорганический пирофосфат. В ходе этой реакции возникает тиоэфирная связь между карбоксильной группой жирной кислоты и тиоловой группой кофермента А, т.е. образуется СоА-производное жирной кислоты (рис. 18-2); одновременно АТР расщепляется на АМР и неорганический пирофосфат. Это сопряженная реакция: энергия, высвобождающаяся при расщеплении АТР на АМР и пирофосфат, используется в активном центре фермента для образования новой тиоэфирной связи. СоА-производные жирных кислот, так же как и ацетил-СоА, представляют собой высокоэнергетические соединения: их гидролиз до свободной жирной кислоты и СоА—SH характеризуется большой отрицательной величиной ∆G0', (около — 7,5 лкал/моль).
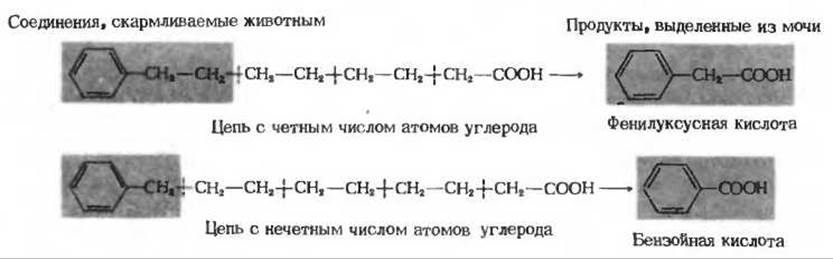
Рис. 18-1. Окисление фенилзамещенных жирных кислот (опыты Кпоопа). Кнооп скармливал кроликам жирные кислоты, меченные фенильной группой при ω-углеродном атоме, т. е при атоме углерода концевой метильной группы. При скармливании ω-фенилзамещенных жирных кислот с четным числом атомов углерода в моче животных всегда обнаруживалась в качестве конечного продукта окисления фенилуксусная кислота, а при скармливании кислот с нечетным числом атомов углерода бензойная кислота. Из этого наблюдения Кнооп заключил, что окисление цепи жирной кислоты начинается с ß-углеродного атома и протекает путем последовательного отщепления от цепи двухуглеродных фрагментов (как это показано на рисунке поперечными пунктирными линиями красного цвета). Двухуглеродные фрагменты отщепляются, вероятно, в виде ацетата, который затем окисляется до СО2 и Н2О. Остальная часть молекулы жирной кислоты (показана на красном фоне) уже более не окисляется и выводится из организма.
Суммарная реакция, описываемая уравнением (1), легко обратима, потому что величина ∆G0' составляет для нее всего — 0,20 ккал/моль. Удалось идентифицировать промежуточный продукт этой реакции, образующийся в связанной с ферментом форме. Он оказался аденилатом жирной кислоты, т. е. смешанным ангидридом жирной кислоты и АМР (рис. 18-3). Аденилат жирной кислоты образуется в активном центре фермента. Здесь он вступает во взаимодействие со свободным СоА—SH, в результате чего получаются СоА-производное жирной кислоты и АМР.
Пирофосфат, образующийся в ходе активации жирных кислот, может затем гидролизоваться под действием второго фермента - неорганической пирофосфатазы:
![]()
Поскольку гидролиз пирофосфата в интактных клетках идет практически до конца, фермент резко сдвигает равновесие реакции активации (1) вправо, т.е. вынуждает ее идти в сторону образования СоА-производного жирной кислоты. Суммарная реакция, объединяющая реакции (1) и (2), может быть записана в следующем виде:

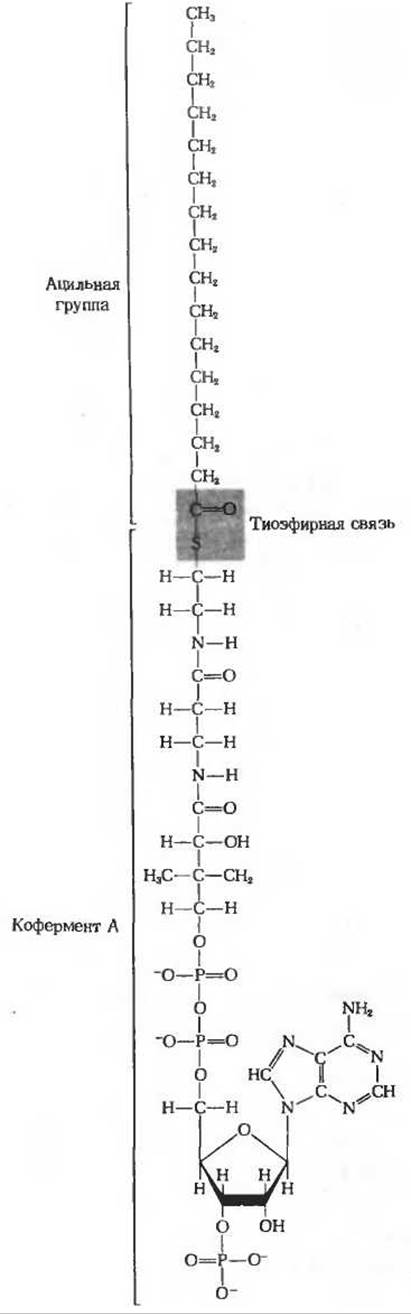
Рис. 18-2. Пальмитоил-СоА. Карбоксильная группа пальмитиновой (16-углеродной) кислоты и тиоловая группа кофермента А взаимодействуют с образованием тиоэфирной связи. Обратите внимание, что СоА-эфиры жирных кислот - это очень большие молекулы.
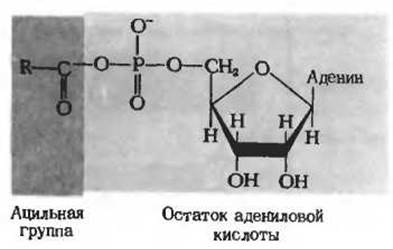
Рис. 18-3. Структура аденилата жирной кислоты. Ацильная группа выделена красным; следует помнить, что эта ацильная группа (остаток жирной кислоты) очень велика по сравнению с аденилатной частью молекулы (см. рис. 18-2).
Позже мы познакомимся с другими примерами, в которых пирофосфатное расщепление ATP (разд. 14.17) с последующим гидролизом пирофосфата тоже используется для активации биомолекул.
СоА-эфиры жирных кислот неспособны проникать через внутреннюю мембрану митохондрий. Однако на наружной поверхности этой внутренней мембраны имеется особый фермент — карнитин-ацилтрансфераза I, который катализирует реакцию, представляющую собой второй этап процесса переноса жирных кислот в митохондрии:
![]()
Сложные эфиры карнитина и жирных кислот способны проходить через внутреннюю мембрану митохондрий и проникать в митохондриальный матрикс. В отличие от СоА-эфиров жирных кислот они содержат не тиоэфирную, а кислородно-эфирную связь. Карнитин (рис. 18-4) обнаружен почти во всех животных и растительных тканях. Известно, что некоторые низшие организмы, например «мучной червь» (Tenebrio molitor), не обладают способностью синтезировать карнитин и потому должны получать его с пищей. В организме человека и у других позвоночных карнитин образуется из лизина.
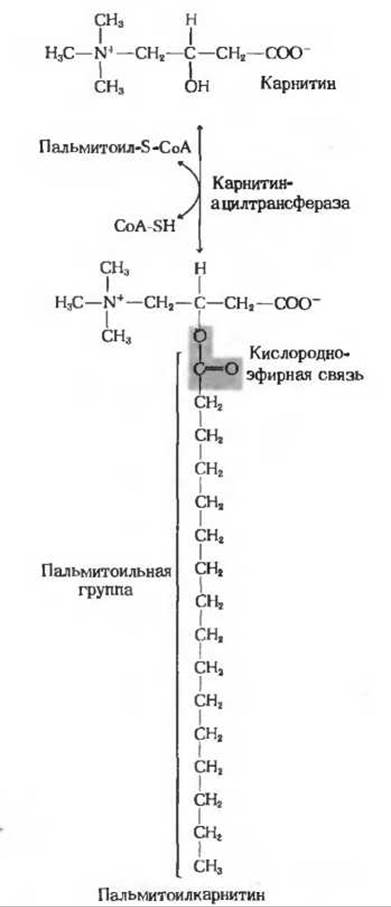
Рис. 18-4. Обратимая реакция, катализируемая карнитинацилтрансферазой.
На третьем и последнем этапе процесса поступления жирных кислот в митохондрии остаток жирной кислоты (ацильная группа) переносится от карнитина на внутримитохондриальный СоА при участии фермента, носящего название карнитин-ацилтрансферазы II. Эта форма фермента локализуется на внутренней поверхности внутренней митохондриальной мембраны; здесь происходит регенерация СоА-производных жирных кислот и отсюда они поступают в матрикс митохондрии:
![]()
Может показаться, что этот трехэтапный процесс [уравнения (1) (3)], обеспечивающий поступление жирных кислот в митохондрии, излишне сложен. Он, однако, позволяет разделить два пула кофермента А - цитозольный и внутримитохондриальный. Такое разделение необходимо, поскольку эти пулы выполняют разные функции. Митохондриальный пул СоА используется главным образом для окислительного расщепления пирувата, жирных кислот и некоторых аминокислот, тогда как цитозольный пул участвует в биосинтезе жирных кислот. В связи с этим уместно вспомнить, что разделение цитозольного и внутримитохондриального пулов NAD и АТР также обеспечивается внутренней митохондриальной мембраной (разд. 17.2). При этом важно и то обстоятельство, что фермент, катализирующий второй этап этого трехэтапного процесса,- карнитин-ацилтрансфераза 1-является регуляторным ферментом. Как мы увидим далее, он регулирует скорость поступления ацильных групп в митохондрии, а следовательно, и скорость окисления жирных кислот.
Теперь СоА-эфиры жирных кислот готовы для того, чтобы их жирнокислотный компонент был подвергнут окислению при помощи ряда специфичных ферментов в матриксе митохондрии.