ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 3. ПУТИ ПЕРЕДАЧИ ИНФОРМАЦИИ - 2017
ЧАСТЬ III. ПУТИ ПЕРЕДАЧИ ИНФОРМАЦИИ
Очевидно, что открытия Гарри [Ноллера] не объясняют, как началась жизнь, и не дают ответа на вопрос, что же было до РНК. Но накапливается все больше косвенных доказательств, что на нашей планете была жизнь и до нас, вот от нее мы и произошли — это факт!
— Джеральд Джойс, из комментария в Science, 1992
27. МЕТАБОЛИЗМ БЕЛКА
Белки — конечный продукт большинства информационных метаболических путей. В каждый момент времени клетке требуются тысячи разных белков. Они должны синтезироваться в соответствии с потребностями клетки, доставляться к месту локализации и разрушаться, если в них больше нет нужды.
Установление механизма биосинтеза белка, очень сложного жизненно важного процесса, — один из самых замечательных успехов биохимии. У эукариот в синтезе белка участвует более 70 различных рибосомных белков, 20 или более ферментов для активации аминокислот, 10 или более вспомогательных ферментов и других белковых факторов для инициации, элонгации и терминации синтеза полипептидов, около 100 дополнительных ферментов для заключительного процессинга белков и 40 или более типов транспортных и рибосомных РНК. В целом в синтезе полипептидов задействовано почти 300 разных макромолекул. Многие из этих макромолекул включены в сложные трехмерные структуры рибосом.
Значение синтеза белка для клетки можно понять, если оценить клеточные ресурсы, направленные на реализацию этого процесса. На синтез белка может расходоваться до 90% химической энергии, затрачиваемой клеткой на все реакции биосинтеза. В каждой клетке бактерий, архей или эукариот содержится от нескольких единиц до нескольких тысяч копий многих белков и молекул РНК. В типичной бактериальной клетке 15 000 рибосом, 100 000 белковых факторов и ферментов, связанных с синтезом белка, и 200 000 молекул тРНК, которые составляют более 35% сухой массы клетки.
Несмотря на то что синтез белка — очень сложный процесс, он происходит исключительно быстро. Полипептид из 100 аминокислотных остатков синтезируется в клетке Escherichia coli (при 37 °С) примерно за 5 секунд. Синтез тысяч различных белков в клетке регулируется таким образом, что их количество точно соответствует текущему метаболическому состоянию. Для поддержания необходимого состава и концентрации белков скорости процессов транспорта и расщепления должны соответствовать скорости синтеза. Благодаря многочисленным исследованиям мы постепенно приоткрываем занавес, скрывающий слаженный молекулярный танец, в ходе которого каждый белок занимает свое место в клетке и избирательно разрушается, если он уже не нужен.
В процессе изучения синтеза белка мы открыли мир каталитических молекул РНК, который мог существовать до того, как зародилась жизнь в ее современном виде. Исследователи установили строение бактериальных рибосом, что позволило понять процессы синтеза белка в клетке во всех изумительных подробностях. Что же они обнаружили? Белки синтезируются гигантскими РНК-ферментами!
27.1. Генетический код
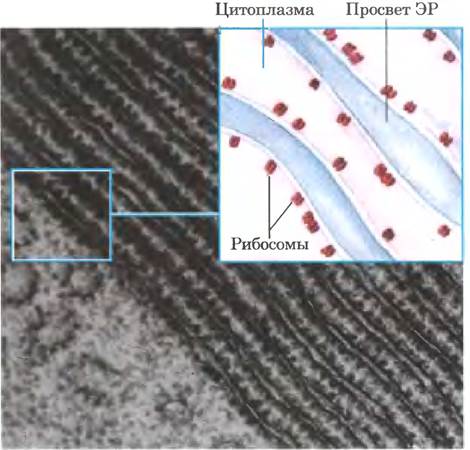
Современные представления о биосинтезе белка основаны на трех больших научных открытиях. В начале 1950-х гг. Пол Замечник с сотрудниками провели серию экспериментов, чтобы выяснить, где в клетке происходит синтез белков. Они вводили крысам путем инъекции радиоактивно меченные аминокислоты, а через разные интервалы времени после инъекции у мертвого животного брали печень, гомогенизировали ее, фракционировали гомогенат центрифугированием и исследовали субклеточные фракции для обнаружения радиоактивного белка. Через несколько часов и суток после инъекции меченых аминокислот все субклеточные фракции содержали меченые белки. Однако если после инъекции проходили минуты, меченые белки обнаруживались только во фракции, содержащей маленькие рибонуклеопротеиновые частицы. Эти частицы, видимые в тканях животных с помощью электронного микроскопа, затем были идентифицированы как место синтеза белка из аминокислот; позднее их назвали рибосомами (рис. 27-1).

Малой Хогланд и Замечник сделали и второе ключевое открытие, обнаружив, что аминокислоты «активировались» при инкубации с АТР и цитозольной фракцией клеток печени Аминокислоты оказывались присоединенными к термостабильной растворимой РНК определенного типа, которая была открыта и описана Робертом Холли и позднее названа транспортной РНК (тРНК); в результате образовывались молекулы аминоацил-тРНК. Ферменты, которые катализируют этот процесс, называются аминоацил- тРНК-синтетазами.
Рис. 27-1. Рибосомы и эндоплазматический ретикулум. Электронная микрофотография и схематическое изображение фрагмента клетки поджелудочной железы, на которых показано присоединение рибосом к внешней (обращенной к цитоплазме) поверхности эндоплазматического ретикулума (ЭР). Рибосомы выглядят как многочисленные маленькие точки по краям параллельно расположенных слоев мембран.
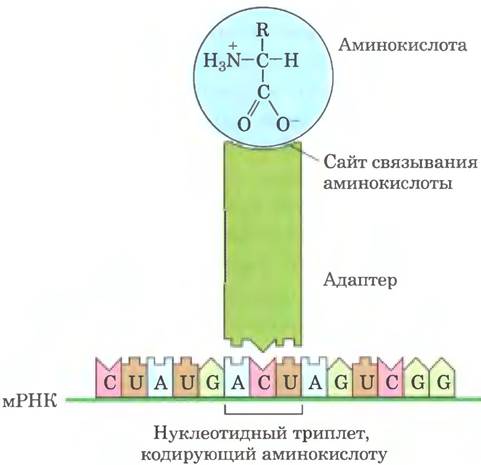
Третье важное открытие появилось в результате исследований Френсиса Крика. Он поставил важный вопрос: каким образом генетическая информация, закодированная в четырехбуквенном языке нуклеиновых кислот, может переводиться на 20-буквенный язык белков? Роль адаптера могли бы выполнять маленькие молекулы нуклеиновой кислоты (возможно, РНК) — одна часть адаптерной молекулы связывается со специфической аминокислотой, другая часть распознает нуклеотидную последовательность, кодирующую данную аминокислоту в составе мРНК (рис. 27-2). Вскоре удалось проверить эту гипотезу. Адаптерная молекула тРНК переводила (транслировала) нуклеотидную последовательность мРНК в аминокислотную последовательность полипептида. Весь процесс направляемого мРНК синтеза белка часто называют просто трансляцией.
Рис. 27-2. Адаптерная гипотеза Крика. Теперь мы знаем, что аминокислота ковалентно связывается с 3'-концом молекулы тРНК, а специфический нуклеотидный триплет в молекуле тРНК взаимодействует с определенным триплетным кодоном в мРНК, образуя водородные связи между комплементарными основаниями.
Вскоре после этих открытий были выявлены основные стадии синтеза белка и расшифрован генетический код, который определяет каждую аминокислоту.
Генетический код был расшифрован с помощью искусственных мРНК
К 1960-м гг. стало очевидно, что для кодирования каждой аминокислоты необходимы по меньшей мере три нуклеотидных остатка в ДНК. Четыре буквы кода ДНК (А, Т, G, С), сгруппированные по две. могут дать только 42 = 16 различных комбинаций, что недостаточно для кодирования 20 аминокислот. При группировке буквенного кода ДНК по 3 возникают 64 комбинации (43 = 64).
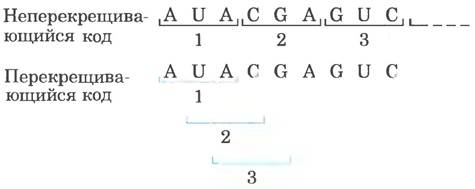
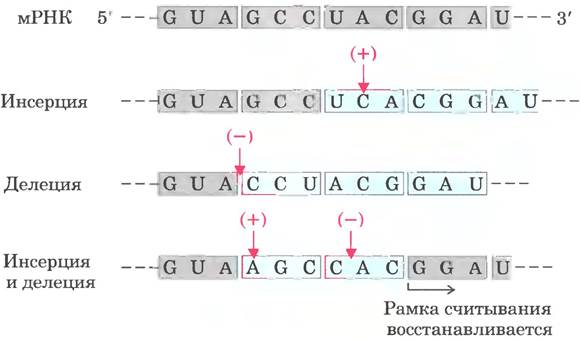
Несколько ключевых принципов кодирования было установлено уже в ранних генетических исследованиях (рис. 27-3, 27-4). Кодон — триплет нуклеотидов, кодирующий определенную аминокислоту. Трансляция осуществляется таким образом, что эти нуклеотидные триплеты считываются в виде непрерывной последовательности. Первый кодон в последовательности определяет рамку считывания, в пределах которой каждый новый кодон начинается через три нуклеотидных остатка. Знаков пунктуации между кодонами нет. Аминокислотная последовательность белка определяется линейной последовательностью соседних триплетов. В принципе каждая одноцепочечная последовательность ДНК или мРНК может иметь три рамки считывания. Каждая рамка считывания содержит свою последовательность кодонов (рис. 27-5), но только одна из них соответствует конкретному белку. Остается вопрос: какие трехбуквенные кодоны каким аминокислотам соответствуют?
Рис. 27-3. Перекрывающийся и неперекрывающийся генетический код. В неперекрывающемся коде кодоны (пронумерованы последовательно) расположены подряд, т. е. не разделены нуклеотидами. В перекрывающемся коде некоторые нуклеотиды в мРНК относятся к нескольким разным кодонам. При триплетном коде с максимальным перекрыванием многие нуклеотиды (например, третий слева (А)) относятся к трем кодонам. Обратите внимание, что в перекрывающемся коде триплетная последовательность первого кодона ограничивает возможные варианты последовательностей для второго кодона. Неперекрывающийся код обеспечивает значительно большую вариабельность нуклеотидов в соседних кодонах и, соответственно, возможных аминокислотных последовательностей, обозначаемых этим кодом. У всех известных в настоящее время организмов генетический код неперекрывающийся.
В 1961 г. Маршалл Ниренберг и Генрих Мат- теи опубликовали работу, ставшую первым прорывом в расшифровке генетического кода. Они инкубировати синтетический полиуридилат (поли U) с экстрактом Е. coli, GTP, АТР и смесью 20 аминокислот в 20 разных пробирках — каждая пробирка содержала одну радиоактивно меченную аминокислоту. Поскольку мРНК полиU состоит из большого количества триплетов UUU, на ней, как на матрице, может синтезироваться только полипептид, состоящий из одной аминокислоты, кодируемой триплетом UUU. В самом деле, радиоактивный полипептид образовался только в одной пробирке, содержащей радиоактивный фенилаланин. Ниренберг и Маттеи сделали вывод, что триплет UUU кодирует фенилаланин. С помощью аналогичного подхода было доказано, что полицитидилат (полиС) кодирует полипептид, состоящий исключительно из пролина (полипролин), а полиаденилат (полиА) кодирует полилизин. Полигуанилат не образует каких-либо пептидов в таком экстракте, поскольку он спонтанно формирует четырехцепочечные структуры (см. рис. 8-20), которые не могут связываться рибосомами.

Рис. 27-4. Неперекрывающийся триплетный код. Принципы организации генетического кода были установлены с помощью многочисленных и разнообразных экспериментов, в том числе генетических экспериментов по изучению мутаций типа инсерций или делеций. Инсерция или делеция одной пары оснований (показано на примере транскрипции мРНК) изменяет последовательность триплетов неперекрывающегося кода; это изменение отражается на всех последующих аминокислотах, кодируемых мРНК. Сочетание инсерции и делеции изменяет отдельные аминокислоты, но в результате может восстановить исходную аминокислотную последовательность. Встраивание или удаление трех нуклеотидов (не показано) не меняет состава триплетов, и это доказывает, что кодон состоит из трех, а не из четырех или пяти нуклеотидов. Серым цветом отмечены кодоны, транскрибируемые с исходного гена; голубым цветом показаны новые кодоны, возникшие в результате инсерции или делеции.
Синтетические полинуклеотиды для этих экспериментов были получены с помощью полинуклеотидфосфорилазы (с. 26.2), которая катализирует образование РНК-иолимеров, начиная с ADP, UDP, CDP и GDP. Этот фермент, открытый Севере Очоа, не нуждается в матрице и создает макромолекулы, состав которых зависит только от относительного содержания в среде нуклеозид-5'-дифосфатов. В присутствии одного UDP фермент синтезирует только полии. Если же его добавить к смеси из пяти частей ADP и одной части CDP, он образует полимер, в котором пять шестых составляют аденилаты, а одну шестую — цитидилаты. Это нерегулярный полимер, содержащий много триплетов ААА, меньше триплетов ААС, АСА и CAA, относительно немного ACC, ССА и САС и совсем мало триплетов ССС (табл. 27-1). С помощью разнообразных искусственных молекул мРНК, созданных с помощью полинуклеотидфосфорилазы из разных стартовых смесей ADP, GDP, UDP и СDР, исследователи вскоре идентифицировали состав триплетов, кодирующих почти все аминокислоты. Хотя эти эксперименты позволили выявить состав оснований в триплетах, последовательность оснований этим способом установить не удалось.
Рис. 27-5. Рамки считывания и генетический код. В неперекрывающемся триплетном коде все молекулы мРНК могут иметь до трех рамок считывания, которые здесь изображены разными цветами. Триплеты и, соответственно, кодируемые ими аминокислоты разные в каждой рамке считывания.
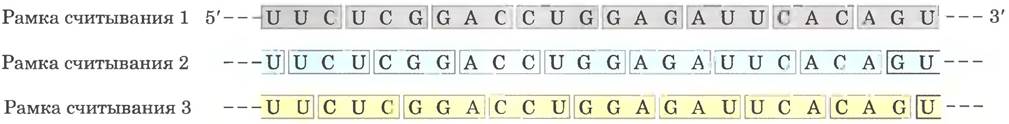
Таблица 27-1. Включение аминокислот в состав полипептидов в присутствии нерегулярных полимеров — РНК
Аминокислота |
Наблюдаемая частота включения (Lys=100) |
Предполагаемый нуклеотидный состав* * * соответствующего кодона |
Ожидаемая частота включения, основанная на условной частоте для Lys = 100 |
Аспарагин |
24 |
А2С |
20 |
Глутамин |
24 |
А2С |
20 |
Гистидин |
6 |
АС2 |
4 |
Лизин |
100 |
ААА |
100 |
Пролин |
7 |
АС2, ССС |
4,8 |
Треонин |
26 |
А2С, АС2 |
24 |
Примечание. Представленные данные получены в одном из первых экспериментов по расшифровке генетического кода. Полипептид синтезировали на матрице синтетической РНК, содержащей только остатки А и С в соотношении 5:1, после чего определяли количественный и качественный состав аминокислот в составе полипептида. Далее, исходя из относительной частоты встречаемости остатков А и С в составе синтетической РНК и условно принимая частоту встречаемости кодона ААА (самый распространенный кодон) за 100, было подсчитано, что должно быть три варианта кодонов состава А2С, каждый с частотой встречаемости 20; три варианта кодонов состава АС2, каждый с частотой встречаемости 4, а относительная частота встречаемости кодона ССС должна составлять 0,8. Смысл кодона ССС установлен в предыдущих экспериментах с использованием последовательности поли(С)
* Эти данные ничего не говорят о последовательности нуклеотидов в составе кодона (конечно, за исключением кодонов ААА и ССС).
Ключевые договоренности.
Далее в нашем изложении мы многократно будем встречаться с тРНК. Специфичность каждой тРНК к аминокислоте обозначается в виде верхнего индекса, например, тРНКАlа, а аминоацилированная тРНК пишется через дефис: аланил-тРНКАlа или Аlа-тРНКАlа. ■
В 1964 г. Ниренберг и Филипп Ледер сделали другое важное открытие. Изолированные рибосомы Е. coli могут связывать специфическую аминоацил-тРНК в присутствии соответствующей синтетической полинуклеотидной матрицы. Например, рибосомы, инкубированные с поли(U) и фенилаланил-тРНКРhе(Рhе-тРНКPhe), связывают молекулы РНК обоих типов, но, если рибосомы инкубируют с поли(U) и некоторыми другими аминоацил-тРНК, молекулы аминоацил-тРНК не связываются, поскольку не распознают триплеты в поли (U) (табл. 27-2). Даже последовательности из трех нуклеотидов могут специфически связываться с соответствующими молекулами тРНК, поэтому такие эксперименты можно проводить даже с короткими синтетическими молекулами олигонуклеотидов. С помощью данного метода удалось определить, какие аминоацил-тРНК связываются примерно с 50 из 64 возможных триплетных кодонов. Некоторым кодонам не соответствуют никакие молекулы аминоацил-тРНК или соответствует несколько. Для завершения расшифровки и подтверждения генетического кода требовался другой метод.
Таблица 27-2. Тринуклеотиды, способные индуцировать специфическое связывание молекул аминоацил-тРНК с рибосомамии
Относительное увеличение количества меченой аминоацил-тРНК, связанной с рибосомой* |
|||
Тринуклеотиды |
Рhе-тРНКРhе |
Lys-TPHKLys |
Рrо-тРНКРrо |
UUU |
4.6 |
0 |
0 |
AAA |
0 |
7,7 |
0 |
CCC |
0 |
0 |
3,1 |
* Числа указывают, во сколько раз возросло количество связанного 14С в присутствии соответствующего тринуклеотида по сравнению с контролем (без тринуклеотида).
Примерно в то же время дополнительный метод анализа предложил X. Гобинд Корана, который придумал химические способы синтеза полирибонуклеотидов с определенными повторяющимися последовательностями от двух до четырех оснований. Полипептиды, состоящие из этих молекул мРНК, содержат повторяющиеся последовательности из небольшого числа аминокислот. Эти последовательности в сочетании с информацией о случайных полимерах. синтезированных Ниренбергом с коллегами, позволяли точно определить соответствие кодонов и аминокислот. Например, в сополимере (АС)n повторяются кодоны АСА и САС: АСАСАСАСАСАСАСА. Полипептид, синтезированный на такой матрице, содержит равные количества треонина и гистидина. Поскольку установлено, что кодон гистидина содержит один А и два С (табл. 27-1), САС должен кодировать гистидин, а АСА — треонин.

Результаты многочисленных экспериментов позволили установить природу 61 из 64 возможных кодонов. Оставшиеся три кодона оказались стоп-кодонами — они прерывали синтез белка на основе синтетической полимерной РНК- матрицы (рис. 27-6). Назначение каждого триплетного кодона (рис. 27-7) было установлено к 1966 г. и подтверждено различными методами. Расшифровка генетического кода оценивается как одно из самых значимых открытий XX в.
Рис. 27-6. Роль стоп-кодона в повторяющемся тетрануклеотиде. Стоп-кодоны (розовый цвет) располагаются после каждого четвертого кодона в трех разных рамках считывания (показаны разными цветами). В зависимости от первоначального места связывания рибосомы происходит синтез дипептидов или трипептидов.
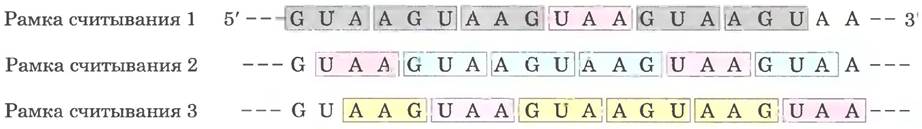
Рис. 27-7. «Словарь» аминокислотного кода в молекулах мРНК. Кодоны записывают в направлении 5' —> 3'. Третье основание каждого кодона (выделено жирным шрифтом) играет менее важную роль в спецификации аминокислоты, чем первые два. Три стоп-кодона изображены на розовом фоне, инициаторный кодон AUG — на зеленом. Всем аминокислотам, за исключением метионина и триптофана, соответствует более одного кодона. Как правило, кодоны, определяющие одну и ту же аминокислоту, отличаются только третьим основанием.
Кодоны играют ключевую роль в трансляции генетической информации и определяют синтез специфических белков. Рамка считывания устанавливается на первом этапе трансляции мРНК и сохраняется на всем протяжении процесса при переходе от одного триплета к следующему. Если исходная рамка считывания теряет одно или два основания, или если трансляция каким-то образом перескакивает через нуклеотид в мРНК, нарушается порядок считывания всех последующих кодонов; в результате обычно образуется «бессмысленный» белок с искаженной аминокислотной последовательностью.
Несколько кодонов выполняют особые функции (рис. 27-7). Инициаторный кодонAUG — самый распространенный сигнал начала синтеза полипептида во всех клетках, а внутри последовательности он же кодирует метионин. Стоп-кодоны (UAA, UAG и UGA), иначе называемые терминирующими кодонами или нонсенс- кодонами, дают сигнал окончания синтеза полипептида и не кодируют никаких аминокислот. Некоторые исключения из этого правила обсуждаются в доп. 27-1.
Как описано в разд. 27.2, инициация синтеза белка в клетке — сложный процесс, зависящий от инициаторных кодонов и других сигналов в мРНК. Теперь понятно, что эксперименты Ниренберга, Кораны и их коллег по выявлению функции кодонов не были бы успешными без инициаторных кодонов. К счастью, условия экспериментов были не очень строгими. В истории биохимии достаточно часто революционные прорывы в исследованиях происходили благодаря старанию людей и счастливому случаю.
В случайной последовательности нуклеотидов в среднем один из 20 кодонов в каждой рамке считывания оказывается концевым колоном. Рамку считывания из 50 и более кодонов, не прерывающуюся стоп-кодоном, называют открытой рамкой считывания (ОРС). Длинные открытые рамки считывания обычно соответствуют генам, кодирующим белки. Для анализа баз данных нуклеотидных последовательностей с целью поиска открытых рамок считывания среди гигантского объема некодирующей информации существуют сложные компьютерные программы. Для считывания непрерывного гена, кодирующего типичный белок с молекулярной массой 60 000, нужна открытая рамка из 500 или большего числа кодонов.
Удивительное свойство генетического кода заключается в том. что одной аминокислоте может соответствовать более одного кодона, поэтому генетический код называют вырожденным. Это не означает, что код некорректен: хотя одна аминокислота может записываться с помощью двух или нескольких кодонов, каждый кодон обозначает только одну аминокислоту. Вырожденность кодона неоднородна. Метионин и триптофан имеют по одному кодону, три аминокислоты (Leu, Ser, Arg) кодируются шестью кодонами каждая, у пяти аминокислот по четыре кодона, изолейцин имеет три кодона и девять аминокислот - два кодона (табл. 27-3).
Таблица 27-3. Вырожденность генетического кода
Аминокислота |
Число кодонов |
Аминокислота |
Число кодонов |
Met |
1 |
Туr |
2 |
Тrр |
1 |
llе |
3 |
Asn |
2 |
Ala |
4 |
Asp |
2 |
Gly |
4 |
Cys |
2 |
Pro |
4 |
Gln |
2 |
Thr |
4 |
Glu |
2 |
Val |
4 |
His |
2 |
Arg |
6 |
Lys |
2 |
Leu |
6 |
Phe |
2 |
Ser |
6 |
Генетический код почти универсален. За исключением некоторых минорных вариаций в митохондриях, некоторых бактериях и некоторых одноклеточных эукариотах (доп. 27-1), кодоны аминокислот идентичны у всех известных на сегодняшний день видов организмов. Человек, кишечная палочка, табак, земноводные и вирусы используют один и тот же генетический код. Это позволяет предположить, что все живые существа имеют общего предка, чей генетический код сохранился на протяжении биологической эволюции. Даже исключения подтверждают общее правило.
Дополнение 27-1. Исключение, подтверждающее правило: природные вариации генетического кода
В биохимии, как и в других дисциплинах, исключения из общих правил затрудняют преподавание и расстраивают студентов. В то же время исключения из правил учат нас, что жизнь сложна, и вдохновляют на удивительные открытия. Кроме того, понимание сути исключений может неожиданным образом подтвердить правило.
Казалось бы, в генетическом коде немного возможностей для вариаций. Даже замена одной аминокислоты может оказать разрушительное действие на структуру белка. Тем не менее вариации кода действительно наблюдаются у некоторых организмов, и эти вариации интересны и поучительны. Типы вариаций и их исключительность являются убедительным подтверждением общего эволюционного происхождения всех живых существ.
Для изменения кода модификации должны затронуть гены одной или нескольких тРНК, причем таким образом, чтобы изменился антикодон. В результате такого изменения специфическая аминокислота встраивается в аминокислотную последовательность всякий раз, когда в последовательности мРНК встречается данный кодон, который в норме (см. рис. 27-7) не кодирует эту аминокислоту. Генетический код определяется двумя элементами: (1) антикодонами тРНК, которые указывают, где в растущем полипептиде размещается конкретная аминокислота, и (2) специфичностью аминоацил-тРНК- синтетаз, подбирающих аминокислоты для каждой молекулы тРНК.
Большинство внезапных изменений кода может иметь катастрофические последствия для клеточных белков, поэтому модификации наиболее вероятны там, где их эффект минимален, например, в маленьких геномах, кодирующих лишь несколько белков. Кроме того, биологические последствия изменения кола сравнительно невелики, если они происходят в трех стоп-кодонах, которые обычно не встречаются внутри генов (см. доп. 27-4 по поводу исключений из этого правила). Именно такая картина и наблюдается в действительности.
Среди немногих известных вариаций генетического кода большинство наблюдается в митохондриальной ДНК (мтДНК). в которой закодировано всего от 10 до 20 белков. Митохондрии содержат собственные молекулы тРНК, поэтому вариации их генетического кода не оказывают существенного влияния на геном клетки. Большинство известных изменений в митохондриях (и единственные изменения кода, обнаруженные в клеточных геномах) затрагивает стоп-кодоны. Эти изменения влияют на синтез продуктов только некоторых генов, а иногда их действие сведено к минимуму из-за наличия в генах большого (избыточного) количества стоп-кодонов.
У позвоночных мтДНК содержат гены 13 белков, двух рРНК и 22 тРНК (см. рис. 19-38 в т. 2). Редкие случаи изменения кода и необычный набор качающихся оснований в кодонах позволяют считывать митохондриальные гены с помощью лишь 22 тРНК, в отличие от нормального кода, для которого требуется 32 тРНК. Эти изменения в митохондриях можно воспринимать как оптимизацию генома, поскольку уменьшение размера генома дает органелле преимущества в репликации. Для четырех семейств кодонов, в которых аминокислота полностью определяется первыми двумя нуклеотидами, достаточно по одной тРНК с остатком U в первом (качающемся) положении в антикодоне: либо U спаривается каким-то образом с любым из четырех возможных оснований в третьем положении кодона, либо реализуется механизм «два из трех», когда спаривание в третьем положении не требуется. Другая группа тРНК распознает кодоны либо с А, либо с G в третьем положении, а третья группа распознает U или С. таким образом, практически все тРНК распознают или два, или четыре кодона.
В нормальном коде только двум аминокислотам соответствует по одному кодону: метионину и триптофану (см. табл. 27-3). Если все митохондриальные тРНК распознают два кодона, следует предположить, что в митохондриях для Met и Тrр существуют дополнительные кодоны. И действительно, одна наиболее распространенная вариация кода касается изменения смысла обычного стоп-кодона UGA, который в данном случае кодирует триптофан. Молекула тРНКТrp встраивает остаток Тrр как на месте UGA, так и на месте стандартного кодона Тrр, а именно, ITGG. Второе наиболее распространенное изменение касается кодона AUA, который в данном случае означает не llе, a Met; нормальный кодон метионина AUG тоже действует, и одна тРНК распознает оба варианта. Известные вариации кода в митохондриях обобщены в табл. 1.
Таблица 1. Известные варианты кодонов в митохондриях
Кодоны* |
|||||
UGA |
AUA |
AGA AGG |
CUN |
CGG |
|
Нормальное назначение кодона |
Стоп |
Ile |
Arg |
Leu |
Arg |
Животные |
|||||
Позвоночные |
Тrр |
Met |
Стоп |
+ |
+ |
Drosophila |
Trp |
Met |
Ser |
+ |
+ |
Дрожжи |
|||||
Saccharomyces cerevisiae |
Trp |
Met |
+ |
Thr |
+ |
Torulopsis glabrata |
Trp |
Met |
+ |
Thr |
? |
Schizosaccharomyces pomhe |
Trp |
+ |
+ |
+ |
+ |
Мицелиальные грибы |
Trp |
+ |
+ |
+ |
+ |
Трипаносомы |
Trp |
+ |
+ |
+ |
+ |
Высшие растения |
+ |
+ |
+ |
+ |
Trp |
Clamydomonas reinhardtii |
? |
+ |
+ |
+ |
? |
* N обозначает любой нуклеотид; + - кодон имеет то же назначение, что и в нормальном коде;
? кодон не встречается в данном митохондриальном геноме.
Если обратить внимание на наиболее редкие изменения кода клеточных геномов (отличающиеся от митохондриальных), мы обнаружим, что у бактерий единственная известная вариация опять заключается в использовании UGA для кодирования остатков Тrр. Это изменение встречается в самых простых свободноживущих клетках — в бактерии Mycoplasma capricolum. Среди эукариот вариации кода вне митохондрий наблюдаются у немногочисленных видов ресничных простейших, у которых оба стоп-кодона UAA и UAG могут кодировать глутамин. Известны также редкие, но интересные случаи, когда стоп-кодоны используются для кодирования аминокислот, не входящих в число 20 стандартных аминокислот (см. доп. 27-3).
Изменения не обязательно касаются всех специфических кодонов в данном геноме; кодон не всегда кодирует одну и ту же аминокислоту. Например, у большинства бактерий, включая Е. coli, кодон GTTG (Val) иногда используется в качестве инициаторного кодона, означающего метионин. Это происходит только в тех генах, в которых кодон GUG расположен надлежащим образом по отношению к инициирующим трансляцию последовательностям мРНК (разд. 27.2).
Эти вариации свидетельствуют о том, что код не столь универсален, как считалось ранее, но его вариабельность строго ограничивается. Вариации являются очевидными производными обычного кода, и примеров совсем другого кода пока не обнаружено. Ограниченное число вариантов кода подтверждает идею, что вся жизнь на нашей планете эволюционировала из единого (мало вариабельного) генетического кода.
«Качание» позволяет некоторым молекулам тРНК распознавать более одного кодона
Если несколько разных кодонов определяют одну аминокислоту, они обычно различаются только третьим основанием (расположенным на 3'-конце). Например, аланин кодируется триплетами GCU, GCC, GCA и GCG. Кодоны для большинства аминокислот можно обозначить условной формулой XYAg или XYUC. Именно две первые буквы в каждом кодоне определяют аминокислоту, и эта особенность имеет ряд интересных последствий.
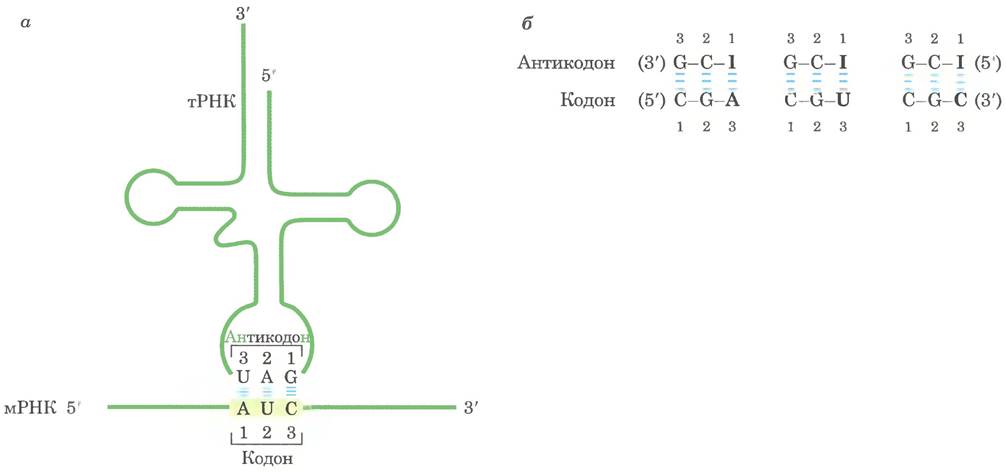
Спаривание транспортных РНК с кодонами мРНК осуществляется через последовательность трех оснований тРНК, называемую антикодоном. Первое основание кодона в мРНК (в направлении 5' -—> 3') образует пару с третьим основанием антикодона (рис. 27-8, а). Если триплет антикодона тРНК распознает только один кодон в мРНК, который по всем трем позициям удовлетворяет уотсон-криковскому принципу соответствия оснований, клетки должны иметь разные молекулы тРНК для каждого кодона. Однако это не так, поскольку в некоторых тРНК антикодоны содержат нуклеотид инозинат (I), имеющий необычное основание гипоксантин (см. рис. 8-5, б в т. 1). Инозинат может образовывать водородные связи с тремя нуклеотидами (U, С и А; рис. 27-8, б), хотя связи в таких парах намного слабее, чем водородные связи в уотсон-криковских парах (G = C и A = U). У дрожжей одна молекула тРНКАrg имеет антикодон (5')-ICG, который распознает три кодона аргинина: (5')-CGA, (5')-CGU, (5')-CGC. Первые два основания в этих кодонах идентичны (CG) и образуют пары с соответствующими основаниями антикодона строго по правилу Уотсона- Крика, но третье основание (A, U или С) образует слабые водородные связи с остатком I в первой позиции антикодона.
Рис. 27-8. Связывание кодона с антикодоном, а — молекулы РНК имеют противоположную направленность. Молекула тРНК изображена традиционным образом в конфигурации клеверного листа, б — три варианта спаривания кодона с антикодоном при наличии инозината в составе антикодона в тРНК.
Изучение спаривания этих и других кодонов с антикодонами привело Крика к выводу, что третье основание в большинстве кодонов часто достаточно слабо связано с соответствующим основанием антикодона; иными словами, третье основание таких кодонов и первое основание соответствующих антикодонов проявляют нестрогое соответствие, или «качаются». Крик сформулировал четыре положения, названных гипотезой качания:
1. Первые два основания кодона мРНК всегда формируют канонические пары (пары Уотсона-Крика) с основаниями антикодона в тРНК и в основном определяют соответствующую аминокислоту.
2. Первое основание антикодона (при считывании в направлении 5' —> 3'; это основание спаривается с третьим основанием кодона) определяет число кодонов, распознаваемых молекулой тРНК. Если первое основание антикодона С или А, спаривание оснований специфично, и такая тРНК распознает только один кодон. Если первое основание U или G, связывание менее специфичное, и тРНК может узнавать два разных кодона. Если первым (качающимся) нуклеотидом антикодона является инозин (I), тРНК может распознать три разных кодона — максимальное число для любой тРНК. Эти принципы обобщены в табл. 27-4.
Таблица 27-4. Как качающиеся основания антикодона определяют число кодонов, которые может распознать тРНК

Примечание. X и У основания, комплементарные основаниям X' и У' соответственно; образуют с ними уотсон- криковские пары. Качающиеся пары оснований в 3'-положении кодонов и в 5'-положении антикодонов выделены розовым цветом.
3. Если аминокислота определяется несколькими кодонами и если эти кодоны различаются первым или вторым основанием, то для каждого кодона нужна своя тРНК.
4. Для трансляции всех кодонов (их 61) нужно как минимум 32 тРНК (31 для кодирования аминокислот и 1 для инициации).
Качающееся (третье) основание кодона вносит определенный вклад в специфичность связывания, но, поскольку связывается с соответствующим основанием антикодона достаточно слабо, это позволяет тРНК быстро диссоциировать из комплекса с кодоном в ходе синтеза белка. Если бы все три основания кодона образовывали с тремя основаниями антикодона правильные уотсон-криковские пары, тРНК слишком медленно покидала бы комплекс и это могло значительно ограничить скорость синтеза белка. При взаимодействии кодона и антикодона соблюдается баланс между точностью и скоростью синтеза.
Генетический код позволяет понять, каким образом информация о последовательности белка сохраняется в нуклеиновых кислотах, и дает ключ к разгадке того, как эта информация транслируется в белок. Теперь обратимся к молекулярным механизмам процесса трансляции.
Считывание последовательности зависит от сдвига рамки и редактирования РНК
После того как в процессе синтеза белка устанавливается рамка считывания, кодоны начинают транслироваться без перекрывания и пропусков до момента, пока рибосомный комплекс не встречает стоп-кодон. Две другие возможные рамки считывания обычно не содержат полезной генетической информации, однако некоторые гены, их немного, устроены таким образом, что на определенной стадии трансляции мРНК рибосомы ошибаются, что приводит к сдвигу рамки считывания, начиная с этой точки. Возможно, этот механизм позволяет синтезировать с одного транскрипта несколько родственных, но не полностью идентичных белков или регулировать синтез белка.
Один из наиболее хорошо изученных случаев сдвига рамки считывания — трансляция мРНК перекрывающихся генов gag и pul вируса саркомы Рауса (см. рис. 26-35). Рамка считывания гена pol отстоит на одну пару оснований влево по сравнению с рамкой считывания гена gag (рис. 27-9).
Рис. 27-9. Сдвиг рамки считывания в транскриптах у ретровирусов. Представлен участок перекрывания генов gag-роl в РНК вируса саркомы Рауса.
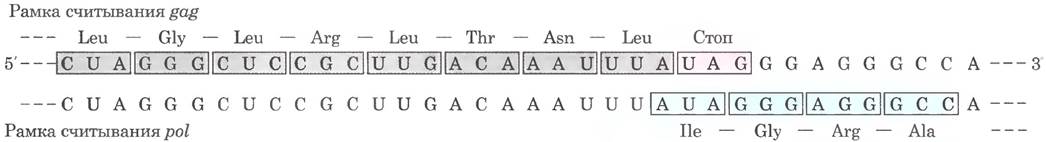
Продукт гена pol (обратная транскриптаза) образуется на основе той же мРНК, что используется для синтеза продукта гена gag (см. рнс. 26-34). Образующийся длинный полииротеин, или белок gag-pol, затем подвергается протеолитическому расщеплению, укорачивается. превращаясь в зрелый белок — обратную транскриптазу. Для образования полипротеина необходим сдвиг рамки считывания в области перекрывания генов, поскольку это позволяет рибосоме миновать стоп-кодон UAG на конце гена gag (выделен розовым цветом на рис. 27-9).
Сдвиг рамки происходит приблизительно в 5% случаев трансляции на этой мРНК, так что полипротеин gag-pol (в итоге — обратная транскриптаза) синтезируется в 20 раз реже продукта гена gag, но этого вполне достаточно для эффективной репродукции вируса. У некоторых ретровирусов сдвиг рамки считывания позволяет транслировать еще более длинный полипротеин, в состав которого входит продукт гена env, слитый с продуктами генов gag и pol (см. рис. 26-34). Аналогичный механизм позволяет синтезировать субъединицы Շ и y ДНК-полимеразы III Е. coli на основе одного транскрипта гена dnaX (см. табл. 25-2).
Иногда перед трансляцией происходит редактирование мРНК. Редактирование РНК может заключаться в добавлении, удалении или замене нуклеотидов, в результате чего изменяется смысл транскрипта. Удаление или добавление нуклеотидов чаще всего наблюдается в РНК из геномов митохондрий и хлоропластов эукариот. В этом механизме задействован особый тип молекул РНК, кодируемых в тех же органеллах. Последовательности этих РНК комплементарны последовательностям модифицируемых мРНК. Эти руководящие (гидовые) молекулы РНК (рис. 27-10) служат матрицей при редактировании.
Примером редактирования путем введения дополнительных нуклеотидов могут служить первичные транскрипты генов, кодирующих субъединицу II цитохромоксидазы в митохондриях некоторых протестов. Эти транскрипты не соответствуют полностью той последовательности, которая должна быть на С-конце белкового продукта. В ходе посттранскрипционной модификации в последовательность встраиваются четыре остатка урацила, что сдвигает рамку считывания. На рис. 27-10 изображены встроенные остатки U в небольшом фрагменте транскрипта, подвергающемся редактированию. Заметьте, что при спаривании оснований первичного транскрипта и руководящей РНК образуется несколько пар G = U (синие точки), которые часто встречаются в молекулах РНК.
Рис. 27-10. Редактирование транскрипта гена субъединицы II цитохромоксидазы из митохондрий Trypanosoma brucei. а — встраивание четырех остатков урацила (розовые) приводит к изменению рамки считывания. б — направляющие (гидовые или адаптерные) РНК. комплементарные модифицированному продукту, служат матрицей в ходе редактирования. Обратите внимание на присутствие не уотсон-криковских пар G = U (синие).
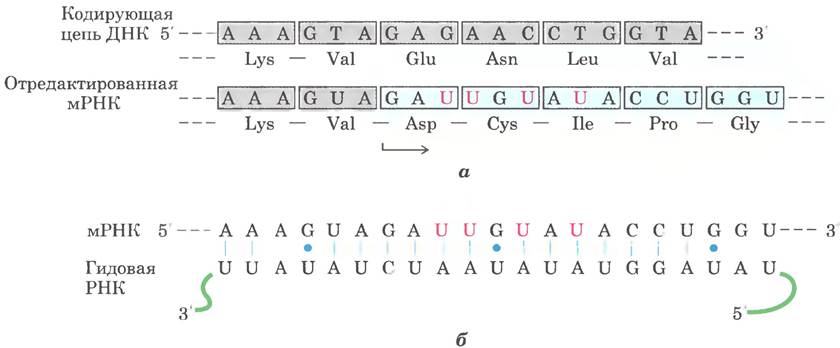
Рис. 27-11. Реакции дезаминирования в редактировании РНК. а — превращение аденозиннуклеотидов в инозиннуклеотиды катализируют ферменты ADAR, б — превращение цитидина в уридин катализируют ферменты семейства АРОВЕС.
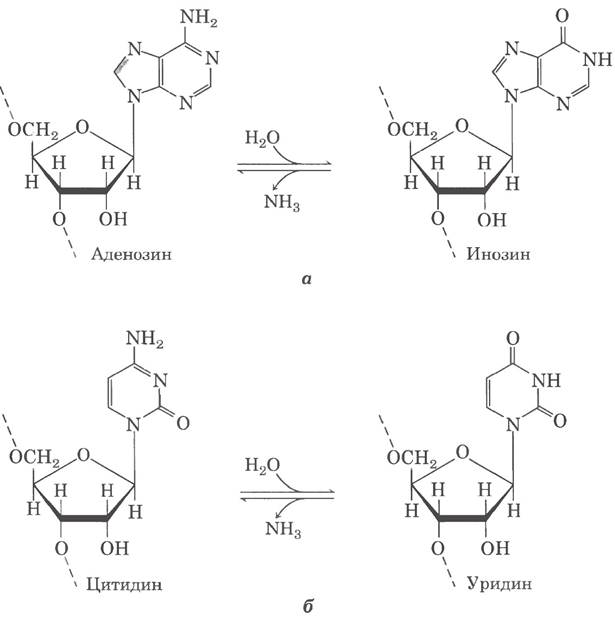
Редактирование РНК путем замены нуклеотидов чаще всего состоит в ферментативном дезаминировании остатков аденозина или цитидина, в результате чего образуются инозин или уридин соответственно (рис. 27-11), хотя встречаются замены и других оснований. В ходе трансляции инозин воспринимается как G. Реакции дезаминирования аденозина катализируют ферменты семейства ADAR (от англ. adenosine deaminases that act on RNA). Дезаминирование цитидина происходит под действием семейства пептидов АРОВЕС (ароВ mRNA editing catalytic peptide), к которому относятся также родственные дезаминазы AID (activation-induced deaminase). Эти две группы дезаминирующих ферментов содержат гомологичные каталитические домены, координирующие атом цинка.
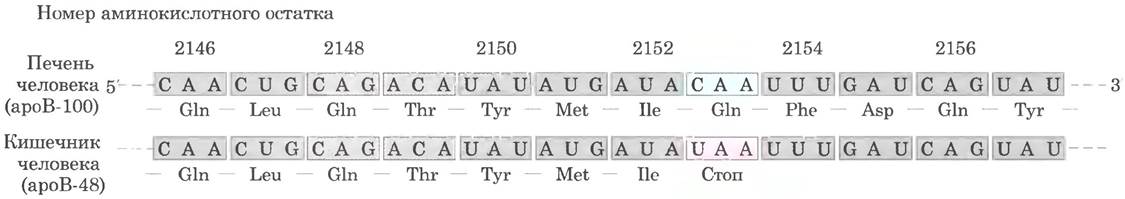
Хорошо изученным примером такого рода реакции является дезаминирование гена аполипопротеина В, входящего в состав липопротеина низкой плотности у позвоночных. Одна форма аполипопротеина В, ароВ-100 (Мr = 513 000), синтезируется в печени, вторая форма, ароВ-48 (Мr = 250 000), — в кишечнике; мРНК обеих форм синтезируется на основе гена ароВ-100. Цитидин- дезаминаза АРОВЕС, обнаруженная только в кишечнике, связывается с мРНК на уровне кодона для аминокислотного остатка 2153 (САА = Gln) и превращает С в U, в результате чего образуется стоп-кодон UАА. Итак, в кишечнике на основе этой модифицированной мРНК образуется белок ароВ-48 — укороченная (N-концевая) форма белка ароВ-100 (рис. 27-12). Эта реакция — пример тканеспецифичного синтеза двух разных белков с одного гена.
Рис. 27-12. Редактирование транскрипта гена ароВ-100 — компонента ЛПНП. Дезаминирование, которое происходит только в кишечнике, приводит к превращению специфического цитидина в уридин, что влечет за собой замену кодона Gin на стоп-кодон и синтез укороченного белка.
Замена основания А на I при участии белков ADAR чаще всего встречается в транскриптах генов приматов, причем свыше 90% замен происходит в коротких диспергированных повторах (short interspersed elements, SINE), называемых Alu- элементами (см. рис. 24-8). В ДНК человека насчитывается свыше миллиона Alu-элементов длиной 300 п. н., что составляет около 10% всего генома. Они концентрируются вблизи генов белков, например, в нитронах и нетранслируемых участках
на 3'- и 5'-концах транскриптов. В только что синтезированной (до процессинга) мРНК человека в среднем содержится от 10 до 20 Alu-элементов. Ферменты ADAR связываются только с двухцепочечной РНК и осуществляют замену А на I. Наличие множества Alu-элементов предоставляет большие возможности для внутримолекулярного спаривания оснований в транскриптах, обеспечивая необходимые для действия ADAR дуплексы. Иногда модификации изменяют кодирующие последовательности генов. Нарушения функции ADAR бывают связаны с различными неврологическими состояниями, включая латеральный амиотрофический склероз (болезнь Шарко), эпилепсию и клиническую депрессию.
Геномы позвоночных содержат множество SINE-элементов, причем у большинства организмов много разных типов SINE. Alu-элементы преобладают только у приматов. Детальный анализ генов и транскриптов показывает, что у людей замена А на I происходит в 30-40 раз чаще, чем у мышей, в значительной степени благодаря присутствию многочисленных Alu-элементов. Сравнительно частые замены А на I, а также распространенность альтернативного сплайсинга (см. рис. 26-22) — две особенности, отличающие геномы приматов от геномов других млекопитающих. Пока неясно, случайно ли произошли эти изменения или они играли важную роль в эволюции приматов и, в итоге, в появлении человека.
Краткое содержание раздела 27.1 Генетический код
■ Специфическая аминокислотная последовательность белка создается путем трансляции информации, закодированной в мРНК. Этот процесс происходит на рибосомах.
■ Аминокислоты определяются кодонами мРНК, которые представляют собой нуклеотидные триплеты. Для трансляции нужны адаптерные молекулы тРНК, которые распознают кодоны и встраивают аминокислоты в соответствующем порядке в синтезируемый полипептид.
■ Последовательности оснований в кодонах были установлены с помощью синтетических мРНК с известным составом и последовательностью.
■ Кодон AUG указывает начало трансляции, кодоны UAA, UAG и UGA являются сигналами окончания синтеза белка.
■ Генетический код вырожден: почти все аминокислоты кодируются несколькими кодонами.
■ Стандартный генетический код одинаков у всех организмов, за исключением некоторых минорных вариаций в митохондриях и в некоторых одноклеточных организмах.
■ Третье положение в каждом кодоне гораздо менее специфичное, чем первое и второе; нуклеотиды в этом положении называют качающимися нуклеотидами.
■ Сдвиг рамки считывания и редактирование РНК влияют на считывание генетического кода при трансляции.