ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 3. ПУТИ ПЕРЕДАЧИ ИНФОРМАЦИИ - 2017
ЧАСТЬ III. ПУТИ ПЕРЕДАЧИ ИНФОРМАЦИИ
27. МЕТАБОЛИЗМ БЕЛКА
27.2. Синтез белков
Ранее, описывая синтез ДНК и РНК (гл. 25 и 26), мы показали, что в синтезе полимерных биомолекул можно выделить стадии инициации, элонгации и терминации. Обычно эти основные процессы дополняются еще двумя стадиями: активация предшественников перед синтезом и постсинтетический процессинг собранных полимеров. Синтез белка следует тем же путем. Активация аминокислот перед их включением в полипептиды и посттрансляционный процессинг собранного полипептида играют очень важную роль, гарантируя как точность синтеза, так и нормальное функционирование готового продукта. Клеточные компоненты, участвующие в этих пяти стадиях синтеза белка у Е. coli и других бактерий, перечислены в табл. 27-5; потребности эукариотических клеток примерно такие же, хотя иногда эукариотам требуются дополнительные компоненты. Сначала рассмотрим стадии синтеза белка в целом, что поможет нам в последующей дискуссии.
Таблица 27-5. Клеточные компоненты, участвующие в пяти основных стадиях синтеза белка у E. Coli
Стадия |
Основные компоненты |
1. Активация аминокислот |
20 аминокислот, 20 аминоацил-тРНК-синтетаз, 32 или более типов тРНК, АТР, Mg2+ |
2. Инициация |
мРНК, N-формилметионил-тРНКfМeт, Инициаторный кодон в мРНК (AUG), 30S - субъединицa рибосомы, 50S-субъединица рибосомы, Факторы инициации (IF-1, IF-2, IF-3), GTP, Mg2+ |
3. Элонгация |
Функциональная 70S-рибосома (инициаторный комплекс), Специфические аминоацил-тРНК, Факторы элонгации (EF-Tu, F-Ts, EF-G), GTP, Mg2+ |
4. Терминация и высвобождение |
Стоп-кодон в мРНК, Факторы терминации (RF-1, RF-2, RF-3), EF-G, IF-3 |
5. Укладка и посттрансляционный процессинг |
Специфические ферменты, кофакторы и другие компоненты для удаления инициаторного остатка и сигнальных последовательностей, дополнительный протеолитический процессинг, модификация концевых остатков и присоединение ацетильной, фосфорильной, метильной, карбоксильной, углеводной или простетической группы. |
Синтез белка происходит в пять стадий
Стадия 1: активация аминокислот. Для синтеза полипептида со специфической последовательностью необходимо соблюдение двух условий: (1) карбоксильная группа каждой аминокислоты должна быть активирована для облегчения формирования пептидной связи; (2) необходимо однозначное соответствие между каждой новой аминокислотой и кодирующей ее мРНК. Оба эти требования удовлетворяются путем присоединения аминокислоты к тРНК на первой стадии синтеза белка. Принципиально важно соединить правильную аминокислоту с правильной тРНК. Эта реакция происходит в цитоплазме, а не на рибосоме. Каждая из 20 аминокислот ковалентно связывается со специфической тРНК с затратой энергии АТР с помощью активирующих Mg2+ -зависимых ферментов, называемых аминоацил-тРНК-синтетазами. Связанную с соответствующей аминокислотой (аминоацетилированную) тРНК называют «нагруженной».
Стадия 2: инициация. Кодирующая полипептид мРНК связывается с меньшей из двух субъединиц рибосомы и с инициаторной аминоацил-тРНК. Затем к ним присоединяется большая субъединица рибосомы, и формируется инициаторный комплекс. Инициаторная аминоацил-тРНК спаривается с кодоном AUG в мРНК, который обозначает начало полипептида. Этот процесс требует затраты GTP и запускается белками цитоплазмы, называемыми факторами инициации.
Стадия 3: элонгация. Полипептид удлиняется путем последовательного ковалентного связывания аминокислот, которые доставляются к рибосоме и точно размещаются специфическими молекулами тРНК путем спаривания с основаниями соответствующих кодонов в мРНК. Элонгация требует участия цитоплазматических белков, называемых факторами элонгации. Связыванию каждой поступающей молекулы аминоацил- тРНК и продвижению рибосом вдоль мРНК способствует гидролиз GТР.
Стадия 4: терминация и высвобождение. Сигналом окончания синтеза полипептидной цепи является стоп-кодон в мРНК. Новый полипептид высвобождается из комплекса с рибосомой с помощью факторов высвобождения, а рибосома готовится для синтеза следующего белка.
Стадия 5: укладка и посттрансляционный процессинг. Для перехода в активную форму новый полипептид должен принять свою специфическую трехмерную конформацию. До или после соответствующей упаковки полипептид может подвергаться ферментативным превращениям, таким как удаление одной или нескольких аминокислот (обычно с N-конца), присоединение ацетильной, фосфорильной, метальной, карбоксильной или других групп к определенным аминокислотным остаткам, протеолитическое расщепление и или присоединение олигосахаридов, или простетических групп.
Прежде чем перейти к детальному обсуждению этих пяти стадий, следует обратить внимание на два ключевых элемента в биосинтезе белка: рибосомы и молекулы тРНК.
Рибосома — сложная надмолекулярная машина
Каждая клетка Е. соli имеет 15 000 или более рибосом, на них приходится до четверти сухой массы клетки. Бактериальные рибосомы содержат около 65% рРНК и 35% белка: их диаметр примерно 18 нм, они состоят из двух неравных субъединиц с коэффициентами седиментации 30S и 50S (общий коэффициент седиментации 70S). Обе субъединицы содержат десятки рибосомных белков и, как минимум, одну крупную молекулу рРНК (табл. 27-6).
Таблица 27-6. РНК и белковые компоненты рибосомы Е. coli
Субъединица |
Число различных белков |
Общее число белков |
Обозначение белков |
Число и тип молекул рРНК |
30S |
21 |
21 |
S1-S21 |
1 (16S рРНК) |
50S |
33 |
36 |
L1-L36* |
2 (5S и 23S рРНК) |
* Обозначения белков от L1 до L36 не соответствуют 36 разным белкам. Белок, первоначально обозначенный L7. на самом деле является модифицированной формой L12, а L8 - это комплекс трех других белков. Установлено также, что L26 и S20 один и тот же белок, и он не входит в состав 508-субъединицы. В большой субъединице 33 разных белка. Белок L7/L12 содержится в четырех копиях, и вместе с тремя дополнительными копиями общее количество белков равно 36.
Рибосомы стали активно изучать после установления Замечником их роли в синтезе белка и после расшифровки генетического кода. В конце 1960-х гг. Масаясу Номура с коллегами показали, что обе субъединицы рибосомы можно разъединить на составляющие их РНК и белок и вновь собрать in vitro. При определенных условиях эксперимента происходит самопроизвольная сборка РНК и белка с образованием 30S- и 50S-субъединиц, практически идентичных по структуре и активности нативным субъединицам. Это открытие открыло дорогу исследованиям в области функции и структуры рибосомных РНК и белков, которые продолжаются уже несколько десятилетий. Одновременно были достигнуты успехи в развитии структурных методов исследования, благодаря чему строение рибосом было изучено в деталях.

Дополнение 27-2 Из мира РНК в мир белка
Известные в настоящее время рибозимы обычно запускают реакцию одного из двух типов: гидролитическое расщепление фосфодиэфирных связей или трансфосфорилирование (гл. 26). И в том и другом случаях субстраты этих реакций тоже молекулы РНК Рибосомные РНК значительно расширяют диапазон каталитических возможностей рибозимов. По мере продвижения лабораторных исследований каталитических функций РНК (см. доп. 26-3) идея мира РНК как предшественника современных форм жизни становится все более популярной.
Жизнеспособный мир РНК должен иметь возможность независимо реплицироваться, обладать примитивным метаболизмом для синтеза необходимых рибонуклеотидных предшественников и иметь клеточные границы, чтобы накапливать субстраты и изолировать их от окружающей среды. Для осуществления реакций между разнообразными метаболитами и макромолекулами могли возникнуть более крупные и более сложные РНК-катализаторы. Большое количество отрицательно заряженных фосфорильных групп в каркасе молекулы РНК понижает ее стабильность и тем самым ограничивает размер молекул РНК. В мире РНК для поддержания стабильности крупных молекул в их состав могли включаться двухвалентные катионы или другие положительно заряженные группы.
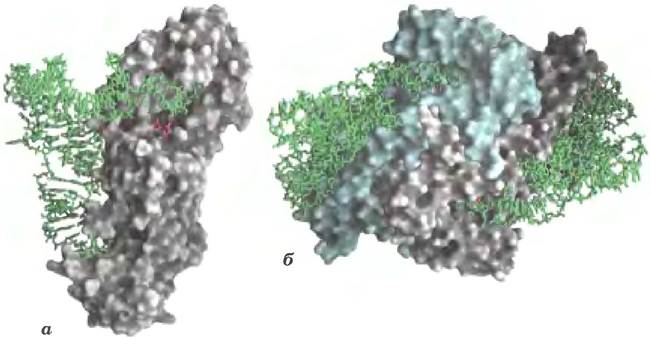
Способствовать стабилизации крупных молекул РНК могут некоторые пептиды. Например, многие рибосомные белки в клетках современных эукариот — это длинные молекулы, не формирующие вторичной структуры; вытягиваясь вдоль молекул рРНК, они вызывают их стабилизацию (рис. 1). Весьма вероятно, что появление катализируемого рибозимами синтеза пептидов исходно имело своей целью стабилизацию структуры больших молекул РНК. Возможно, синтез пептидов помогал стабилизовать крупные рибозимы, но это усовершенствование стало началом конца мира РНК. Как только стал возможен синтез пептидов, более высокий каталитический потенциал белков обеспечил необратимый переход к метаболизму, основанному на функциях белков.
Рис. 1. 50S-субъединица бактериальной рибосомы (РDВ ID 1NKW). Синие нити — молекулы белка; структурные элементы рРНК — прозрачные. Неструктурированные протяженные участки многих рибосомных белков вплетаются в структуры рРНК, помогая их стабилизировать
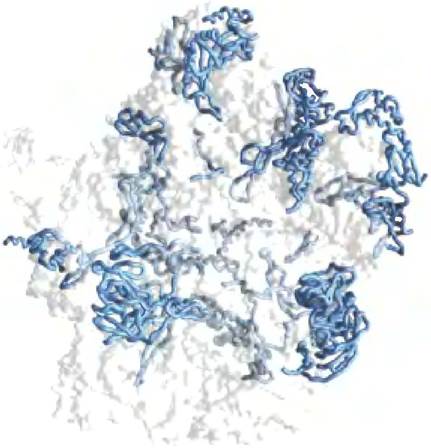
В конце концов в ведение белков перешло большинство каталитических функций, но не все. У всех современных организмов важная задача синтеза белков решена с помощью рибозимов. По-видимому, в активном центре рибозима существует единственная оптимальная комбинация нуклеотидов (или этих комбинаций совсем не много), которая может участвовать в катализе синтеза пептидов. У всех видов организмов остатки рРНК больших субъединиц, которые, как предполагается, вовлечены в пептидилтрансферазную активность рибосом, высококонсервативны. Используя метод «эволюции in vitro» (SELEX; см. доп. 26-3), исследователи выделили искусственные рибозимы для осуществления синтеза пептидов. Интересно, что в большинстве этих биополимеров имеется высококонсервативная последовательность из восьми рубонуклеотидов (5') AUAACAGG (3'), которая также обнаружена в пептидилтрансферазном центре рибосом всех клеток. По-видимому, есть только одно оптимальное решение общей задачи химического синтеза белков со специфической последовательностью с помощью рибозимов. Эволюция однажды нашла это решение, и ни в каких формах жизни оно не было улучшено.
В начале нового тысячелетия структура субъединиц бактериальных рибосом была исследована с очень высоким разрешением, и это принесло много «сюрпризов» (рис. 27-13). Во- первых, изменилось традиционное мнение о ведущей роли белковых компонентов рибосом. Субъединицы рибосом представлены очень большими (гигантскими) молекулами РНК. Сердцевину 50S-субъединицы формируют 5S- и 23S-рРНК. В этом комплексе белки как бы вторичны — они покрывают его поверхность. Во- вторых, и это самое важное, на расстоянии 18 А от активного центра отсутствует белок, который мог бы сформировать пептидную связь. Структурные исследования с высоким разрешением подтвердили то, о чем высказывались предположения более 10 лет назад: рибосома это и есть рибозим. Кроме того, понимание механизма синтеза белка (описанного ниже) и определение детального строения рибосомы и ее субъединиц породили новые взгляды на эволюцию жизни (доп. 27-2).
Рис. 27-13. Бактериальная рибосома. Мы сильно продвинулись в понимании строения рибосом благодаря множеству изображений выского разрешения бактериальной рибосомы и ее субъединиц получены несколькими группами исследователей. Некоторые из этих структур приведены здесь, а — субъединицы 50S и 30S бактериальной рибосомы разъединены, чтобы показать поверхности, которые взаимодействуют в активной рибосоме. Слева показано строение 50S-субъединицы (по PDB ID 20W8, 1VSA и 1GIX) с молекулами тРНК (зеленые), связанными с сайтами Е, Р и А (описаны далее в тексте); антикодоны тРНК выделены красным цветом. Белки изображены в виде синих спиралей; рРНК изображена серым цветом, видна структура ее поверхности. Справа представлено строение 30S-субъединицы (по PDB ID 20W8). Белки изображены в виде коричневых спиралей; рРНК бежевая, виден рельеф ее поверхности. Часть мРНК, взаимодействующая с антикодонами тРНК, окрашена в красный цвет. Остальная мРНК (не показано) протягивается через бороздки или каналы на поверхности 30S-субъединицы. б — активная бактериальная рибосома; вид снизу на бороздку, разделяющую субъединицы (по PDB ID 20W8,1VSA и 1GIX). Все элементы окрашены, как и на рис. а. в — рибосома показана в том же ракурсе, как на рис. б, но все составляющие показаны в объеме. Справа (рис. е) отсутствуют молекулы тРНК, так что видна полость, где и происходит синтез белка, г — 50S-субъединица бактериальной рибосомы (PDB ID 1Q7Y). Она показана со стороны, которая присоединяется к 30S-субъединице. Активный центр, в котором происходит образование пептидной связи (в результате активности пептидил- трансферазы), располагается глубоко в бороздке и далеко от всех белков; с активным центром связан ингибитор пуромицин (красный).
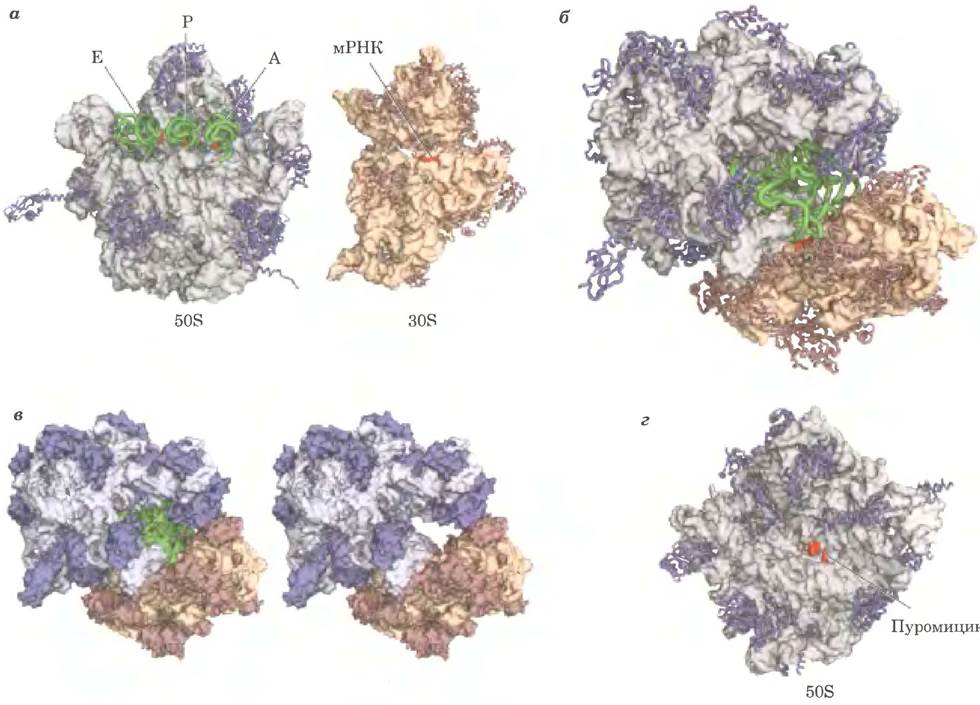
Бактериальная рибосома имеет сложное строение; ее общая молекулярная масса ≈2,7 млн Д. Две рибосомные субъединицы неправильной формы объединены таким образом, что между ними образуется щель, через которую при трансляции проходит молекула мРНК (рис. 27-13, б). В бактериальных рибосомах 57 белков, которые очень сильно различаются по размеру и структуре: молекулярная масса этих белков от 6000 до 75 000. Большинство белков имеет глобулярные домены на поверхности рибосомы. У некоторых белков есть также протяженные неструктурированные хвосты, которые проникают в состоящую из рРНК сердцевину рибосомы, стабилизируя ее структуру. Назначение некоторых из этих белков до настоящего времени неясно, но многие, судя по всему, выполняют структурную функцию.
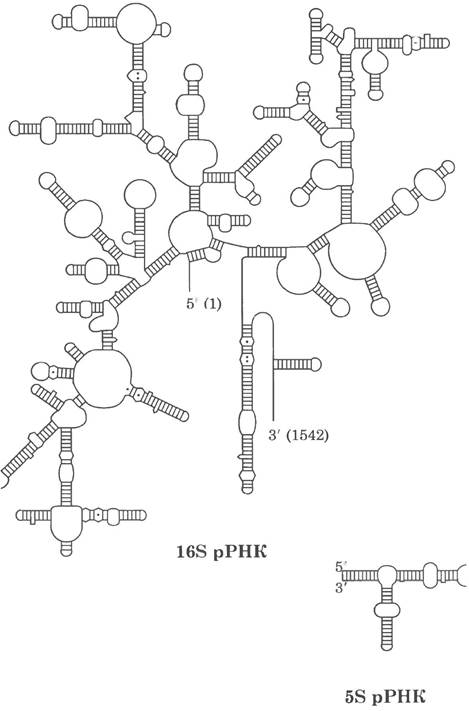
У многих организмов последовательности молекул рРНК установлены. Каждая из трех одноцепочечных рРНК Е. coli имеет специфическую трехмерную конформацию с протяженными участками спаренных оснований внутри цепи. Предсказанная вторичная структура молекул рРНК (рис. 27-14) в значительной степени была подтверждена на моделях, но она не может объяснить сложные взаимодействия в третичной структуре.
Рис. 27-14. Бактериальные рРНК. Вторичная структура 16S- и 5S-pPHK Е. coli. Отмечены (и в 16S рРНК оцифрованы — цифры в скобках) первый (на 5'-конце) и последний (на 3'-конце) остатки рибонуклеотидов.
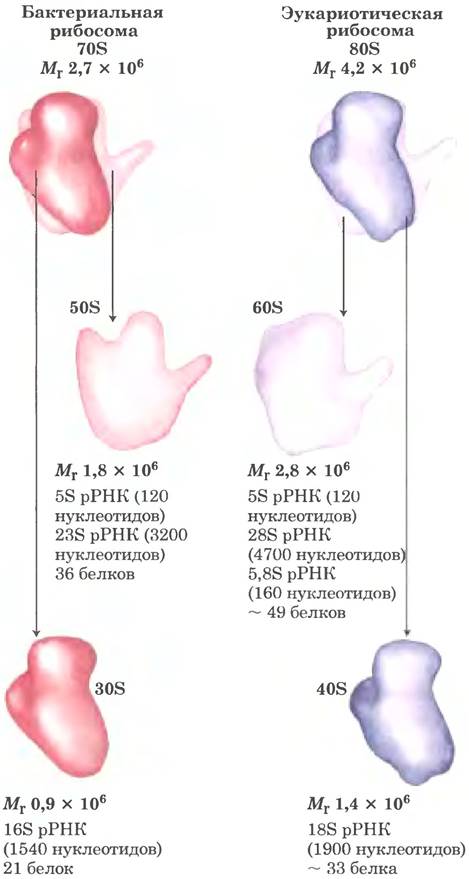
Рибосомы эукариотических клеток (которые отличаются от рибосом митохондрий и хлоропластов) крупнее и сложнее бактериальных рибосом (рис. 27-15), их диаметр ~23 нм, а коэффициент седиментации -80S. Они также состоят из двух субъединиц, которые отличаются по размеру у разных видов, но в среднем 60S и 40S. В сумме рибосомы эукариот содержат более 80 различных белков. Рибосомы митохондрий и хлоропластов меньше и проще бактериальных рибосом. Однако у всех организмов и во всех органеллах структура и функции рибосом поразительно похожи.
Рис. 27-15. Масса и состав рибосом бактерий и эукариот. Субъединицы рибосом характеризуются коэффициентами седиментации в единицах Сведберга S, которые отражают скорость их осаждения при центрифугировании. Значения S для рибосом не всегда аддитивны, поскольку скорость осаждения определяется не только их массой, но и формой.
Транспортные РНК имеют специфическую структуру
Для того чтобы понять, каким образом молекулы тРНК могут переводить информацию с языка нуклеиновых кислот на язык белков, нужно подробнее проанализировать их структуру. Молекулы транспортной РНК относительно малы и состоят из одной цепи РНК со строго определенной трехмерной структурой (см. рис. 8-25, а). тРНК бактерий и в цитозоле эукариот содержат от 73 до 93 нуклеотидных остатков; общая молекулярная масса от 24 000 до 31 000. тРНК митохондрий и хлоропластов меньше по размеру. В клетке для каждой аминокислоты присутствует хотя бы один тип тРНК. Для распознавания кодонов всех аминокислот требуются различные РНК не менее 32 типов (некоторые распознают более одного кодона), но нередко в клетке задействовано более 32 типов тРНК.

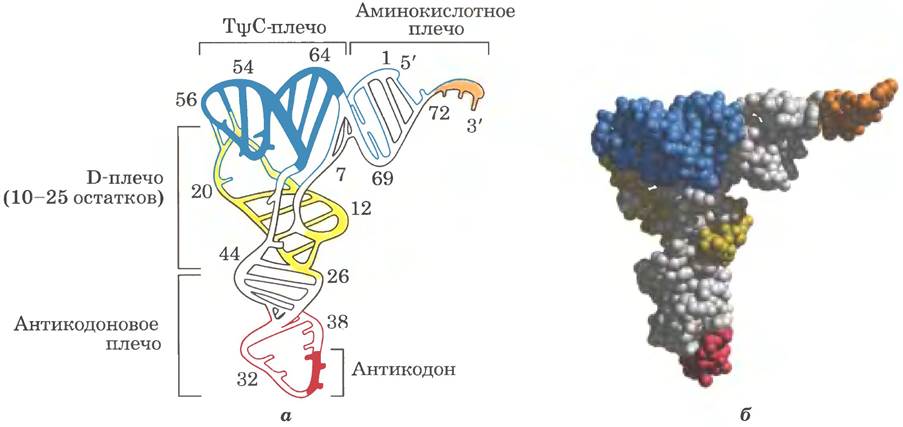
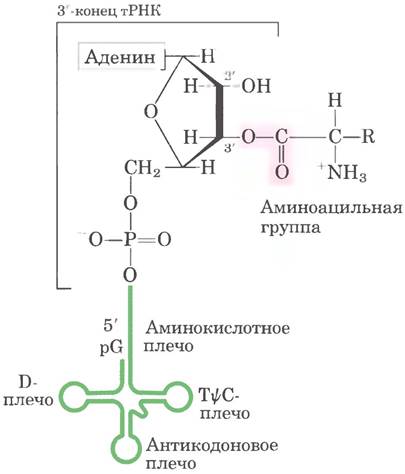
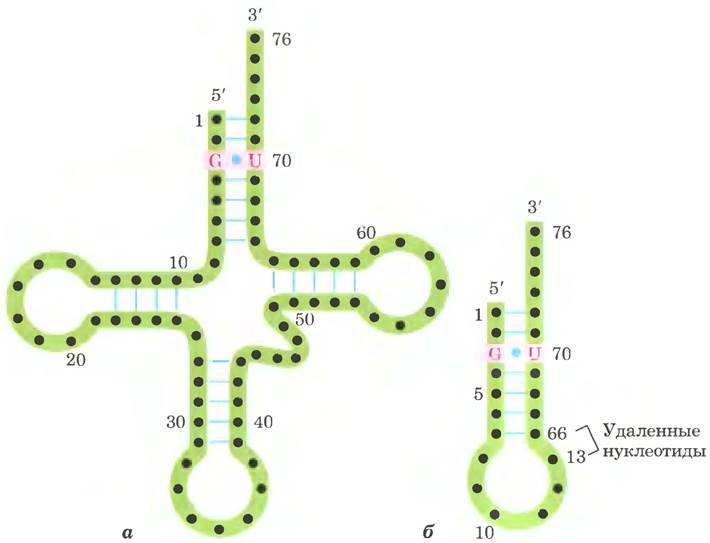
Дрожжевая тРНК для аланина (тРНКАlа; первая нуклеиновая кислота, последовательность которой была полностью секвенирована; рис. 27-16) состоит из 76 нуклеотидных остатков, из которых 10 имеют модифицированные основания. Сопоставление тРНК разных видов выявило много общих структурных особенностей (рис. 27-17). Не менее восьми нуклеотидных остатков содержат модифицированные основания и сахара, многие нуклеотиды представлены метилированными производными обычных нуклеотидов. Большинство молекул тРНК несет на 5'-конце остаток гуанилата (рG), а на 3'-конце все РНК имеют последовательность ССА (3'). На плоскости структура всех тРНК с водородными связями изображается в виде клеверного листа с четырьмя плечами, более длинные молекулы тРНК имеют короткое дополнительное пятое плечо (рис. 27-17). В трехмерном изображении тРНК имеет форму скрученной буквы L (рис. 27-18).
Рис. 27-16. Нуклеотидная последовательность дрожжевой тРНКАlа. Эта структура была определена в 1965 г. Робертом Холли с коллегами; молекула изображена в конформации клеверного листа, при которой достигается максимальное спаривание оснований. В модифицированных нуклеотидах (на розовом фоне) использованы следующие обозначения: Ψ — псевдоуридин; I — инозин; Т — риботимидин; D — 5,6-дигидроуридин; m1I — 1-метилинозин; m1G — 1-метилгуанозин; m2G — N2-диметилгуанозин (см. рис. 26-23). Голубые линии между параллельными фрагментами обозначают уотсон-криковские пары оснований. В молекулах РНК гуанозин часто спаривается с уридином, хотя пара G = U не так стабильна, как пара G = C (гл. 8 в т. 1). Антикодон может распознать три кодона аланина (GCA, GCU и GCC). Другие структурные элементы тРНК показаны на рис. 27-17 и 27-18.
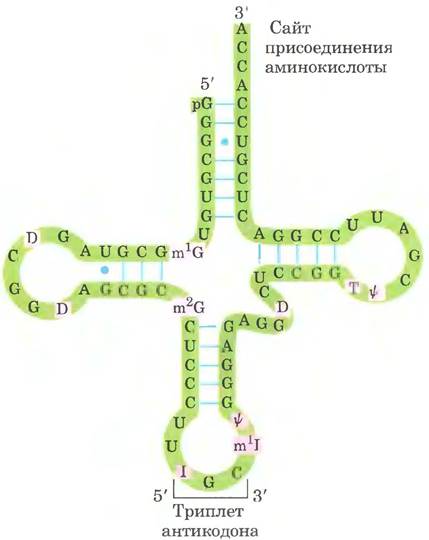
Рис. 27-17. Схема вторичной структуры тРНК в форме клеверного листа. Точками внутри последовательности обозначены нуклеотидные остатки; голубые линии обозначают пары оснований. Нуклеотиды на розовом фоне характерны и/или инвариантны во всех тРНК. Транспортные РНК имеют длину от 73 до 93 нуклеотидов. Дополнительные нуклеотиды образуют D-плечо. В конце антикодонового плеча формируется петля, в которой всегда содержится семь неспаренных нуклеотидов. Плечо D в разных тРНК содержит два или три остатка D (5,6-дигидроуридин). В некоторых тРНК только три пары оснований плеча D связаны водородными связями. Основные символы расшифрованы на рис. 27-16; Рu — пуриновый нуклеотид; Ру — пиримидиновый нуклеотид; G* — гуанилат или 2'-O-метилгуанилат.
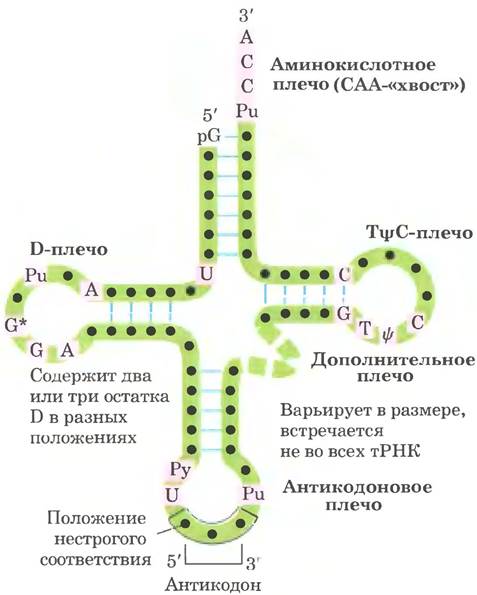
Рис. 27-18. Трехмерная структура дрожжевой TPHKPhe, установленная методом рентгеноструктурного анализа. Форма молекулы напоминает перевернутую и скрученную букву L. а — схема молекулы; плечи (рис. 27-17) выделены разными цветами, б — объемная модель с теми же цветовыми обозначениями (PDB ID 4TRA). Последовательность GСА на 3'-конце (оранжевая) — место присоединения аминокислоты.
Для выполнения адаптерной функции принципиальное значение имеют два плеча тРНК. Аминокислотное плечо может нести специфическую аминокислоту, карбоксильная группа которой соединена эфирной связью с 2'- или 3'-гидроксильной группой остатка А на 3'-конце тРНК. Антикодоновое плечо содержит антикодон. Другие крупные плечи — это плечо D, которое содержит необычный нуклеотид дигидроуридин D, и плечо ТΨС, содержащие риботимидин Т, которого в молекулах РНК, как правило, нет, и псевдоуридин Ψ с необычной углерод-углеродной связью между основанием и рибозой (см. рис. 26-23). Плечи D и ТΨС обеспечивают важные взаимодействия при укладке молекул тРНК, а плечо ТΨС взаимодействует с более тяжелой субъединицей рРНК.
Ознакомившись со структурой рибосом и тРНК, начнем подробное обсуждение пяти стадий синтеза белка.
Стадия 1: аминоацил-тРНК-синтетазы присоединяют определенные аминокислоты к соответствующим молекулам тРНК
На первой стадии синтеза белка, происходящей в цитоплазме, аминоацил-тРНК-синтетазы осуществляют реакцию этерификации 20 аминокислот и соответствующими им тРНК. Фермент проявляет специфичность к одной или нескольким аминокислотам и одной или нескольким тРНК. У большинства организмов одна аминоацил- тРНК-синтетаза работает с каждой аминокислотой. Если аминокислоте соответствуют две или несколько тРНК, обычно их аминоацилирование осуществляет один и тот же фермент.
Определена структура всех аминоацил- тРНК-синтетаз Е. coli. На основании существенных различий в их первичной и третичной структурах и в механизме действия предложено говорить о двух синтетазах (табл. 27-7; рис. 27-19); эти два фермента есть у всех организмов. Пока нет доказательств общего эволюционного предшественника, и биологические, химические и эволюционные причины существования этих двух разных ферментов-катализаторов практически идентичных процессов остаются непонятны.
Аминоацил-тРНК-синтетаза катализирует следующую реакцию:
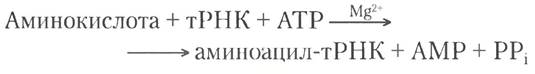
Реакция происходит в активном центре фермента в две стадии. На стадии ① (рис. 27-19) образуется связанный с ферментом промежуточный продукт аминоациладенилат (аминоацил-АМР). На второй стадии аминоацильная группа переносится со связанного с ферментом аминоацил-АМР на соответствующую специфическую тРНК. Протекание второй стадии зависит от синтетазы I или II (реакции (2a) и (2b) на рис. 27-19). Гидролиз образовавшейся эфирной связи между аминокислотой и тРНК (рис. 27-20) характеризуется большим отрицательным значением изменения стандартной свободной энергии (∆G°′ = - 29 кДж/моль). Получившийся в результате реакции активации пирофосфат гидролизуется до фосфата под действием неорганической пирофосфатазы. Таким образом, на активацию каждой аминокислоты расходуются две высокоэнергетические фосфатные связи, и суммарная реакция активации аминокислоты необратима:

Таблица 27-7. Две аминоацил-тРНК-синтетазы
Класс I |
Класс II |
||
Arg |
Leu |
Ala |
Lys |
Cys |
Met |
Asn |
Phe |
Gin |
Trp |
Asp |
Pro |
Glu |
Tyr |
Gly |
Ser |
Ile |
Val |
His |
Thr |
Примечание. Обозначения: Arg — аргинил-тРНК-синтетаза, и т. д. Эти два фермента были обнаружены во всех изученных организмах; они имеют разные структуры и разные механизмы действия (см. рис. 27-19).
Рис. 27-19. Механизм реакции. Амино- ацилирование тРНК аминоацил-тРНК- синтетазами. На стадии ① образуется аминоациладенилат, который сохраняет связь с активным центром. На второй стадии аминоацильная группа переносится на тРНК. Механизм этой реакции несколько отличается для двух аминоацил-тРНК- синтетаз (см. табл. 27-7). Аминоацилсинтетаза I (2а) сначала переносит аминоацильную группу на 2'-гидроксил аденина на 3'-конце РНК, затем (3а) на 3'-гидроксил того же остатка (трансэтерификация). Аминоацилсинтетаза II (2b) переносит аминоацильную группу прямо на 3'-гидроксильную группу концевого аденилата.
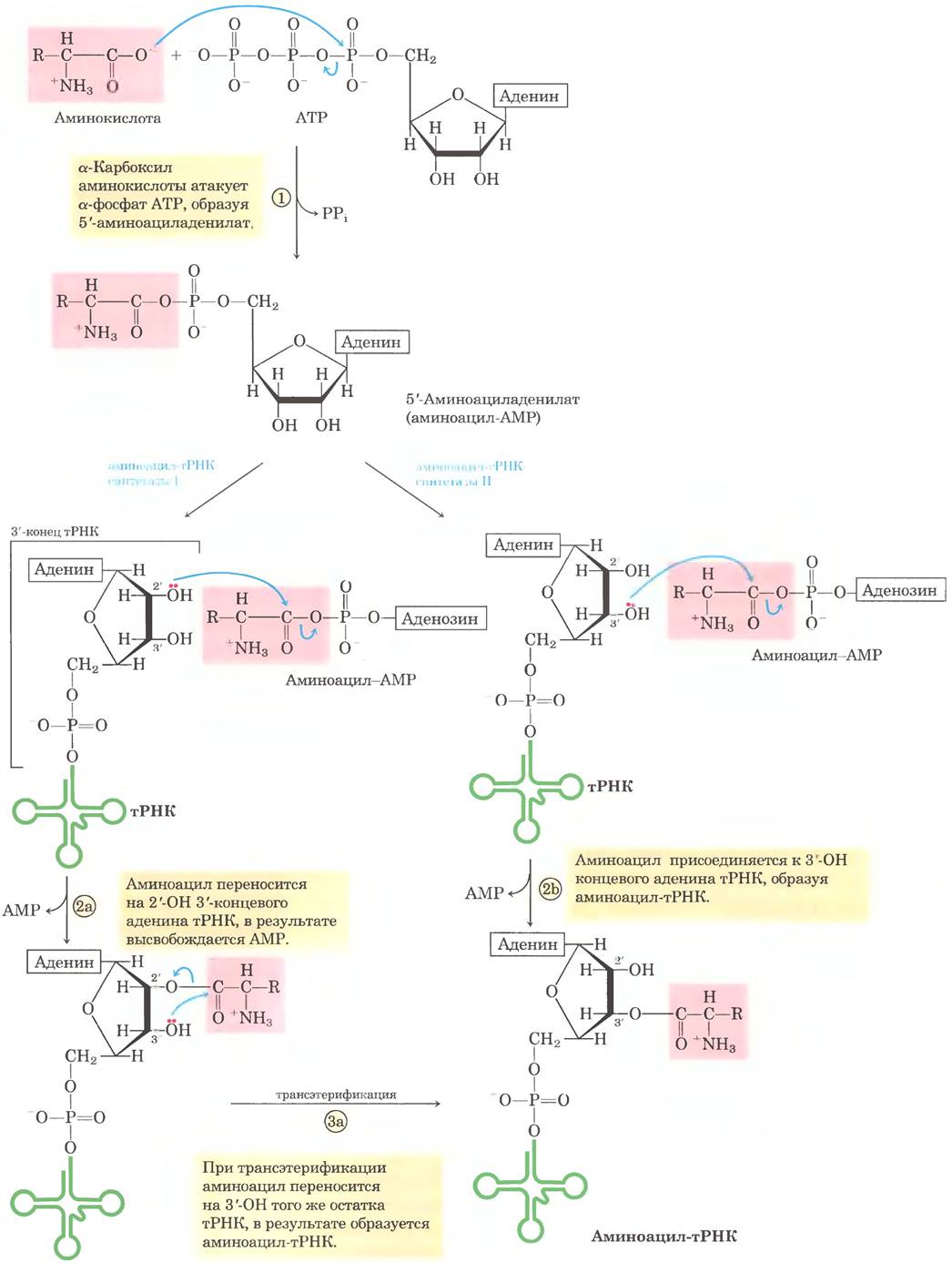
Рис. 27-20. Общая структура молекул аминоацил-тРНК. Аминоацильная группа присоединяется по 3'-положению концевого остатка А. Сложноэфирная связь, которая активирует аминокислоту и связывает ее с тРНК, отмечена розовым цветом.
Корректирующая функция аминоацил-тРНК- синтетаз. Аминоацилирование тРНК приводит к двум результатам: (1) происходит активация аминокислоты для формирования пептидной связи и (2) аминокислота присоединяется к адаптерной тРНК, что обеспечивает правильное положение аминокислоты в растущем полипептиде. На рибосоме присоединяемая аминокислота не идентифицируется, поэтому для синтеза определенной последовательности важно контролировать связывание тРНК с правильной аминокислотой.
В гл. 6 (т. 1) мы говорили о том, что специфичность фермента определяется энергией связывания фермента с субстратом. Способность различать две похожие аминокислоты была подробно изучена на примере Ilе-тРНК-синтетазы, которая узнает валин и изолейцин, различие между которыми — всего одна метиленовая группа (-СН2-).
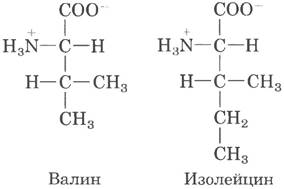
По-видимому, метиленовая группа (в Ilе) способна усилить связывание субстрата (с образованием Ilе-АМР), поэтому изолейцин связывается в активном центре фермента, давая Ilе-тРНК- синтетазу в 200 раз чаще, чем валин. Однако в действительности валин по ошибке встраивается на место изолейцина не чаще одного раза из 3000. Что повышает точность работы фермента более чем в 10 раз? Дело в том, что подобно некоторым другим аминоацил-тРНК-синтетазам Ilе-тРНК-синтетаза проявляет корректирующую активность.
Вспомним общий принцип, который мы обсуждали при оценке корректирующей активности ДНК-полимераз (табл. 25-1): если взаимодействия фермента с двумя разными субстратами не приводят к тому, что фермент достоверно дифференцирует эти субстраты, необходимой специфичности можно достичь путем двухступенчатого взаимодействия. Усиление эффекта от использования двух последовательных фильтров оказывается мультипликативным. В случае Ilе- тРНК-синтетазы первым таким фильтром служит исходное связывание аминокислоты с ферментом и ее активация до аминоацил-АМР. Второй фильтр — это связывание любых неправильных активированных аминокислот с другим активным центром фермента; субстрат, связывающийся со вторым активным центром, подвергается гидролизу. У валина размер R-группы немного меньше, чем у изолейцина, поэтому Val-АМР помещается в гидролитическом (корректирующем) центре Ile-тРНК-синтетазы, а Ilе-АМР нет. Благодаря этому Val-АМР в корректирующем центре расщепляется на валин и АМР, а связанная с ферментом тРНК не подвергается аминоацилированию неправильной аминокислотой.
Кроме корректирующей активности большинство аминоацил-тРНК-синтетаз после образования аминоацил-АМР могут расщеплять сложноэфирную связь между аминокислотой и тРНК в аминоацил-тРНК. Такой гидролиз особенно быстро происходит в случае неправильно нагруженных молекул тРНК. что обеспечивает третий фильтр для повышения точности всего процесса. Немногочисленные аминоацил-тРНК- синтетазы (например, Cys-тРНК-синтетаза), которые активируют аминокислоты, не имеющие близких структурных аналогов, практически не имеют корректирующей активности; в таких случаях активный центр аминоацилирования достаточно точно различает истинный субстрат и любую неправильную аминокислоту.
Общее число ошибок при синтезе белка (~1 ошибка на 104 встроенных аминокислот) значительно больше, чем при репликации ДНК. Это объясняется тем, что повреждения исчезают при расщеплении белка и не передаются следующим поколениям. Точность синтеза белка достаточна для того, чтобы обеспечить правильность сборки большинства белков, и потерь большого количества энергии, как это требуется при синтезе белка, обычно не происходит. Одна дефектная копия во множестве нормальных копий белка обычно не играет никакой роли.
Взаимодействие аминоацил-тРНКсинтетазы и тРНК: «второй генетический код».
Каждая аминоацил-тРНК-синтетаза специфична не только к определенной аминокислоте, но также к определенным тРНК. Найти правильную тРНК среди десятков других так же важно для точности синтеза белка, как и найти свою аминокислоту. Взаимодействия между аминоацил-тРНК-синтетазами и тРНК называют «вторым генетическим кодом», подчеркивая их важную роль в обеспечении точности синтеза белка. Правила этого «второго» кода сложнее правил «первого» кода.
На рис. 27-21 собрана информация о нуклеотидах, важных для распознавания некоторыми аминоацил-тРНК-синтетазами. Некоторые нуклеотиды консервативны во всех тРНК и, следовательно, не участвуют в выборе правильных последовательностей. Проанализировав вариации нуклеотидов в тРНК, которые определяют субстратную специфичность аминоацил-тРНК- синтетаз, исследователи выявили те позиции, которые отвечают за дискриминацию субстратов. Предполагается, что эти позиции сосредоточены в аминокислотном и антикодоновом плечах, включая последовательность самого антикодона, но важные позиции есть и в других частях молекулы тРНК. Расшифровка кристаллических структур аминоацил-тРНК-синтетаз — неоценимый вклад в наше понимание взаимодействий при образовании косплекса тРНК и АТР (рис. 27-22).
Рис. 27-21. Положения нуклеотидов в молекулах тРНК, которые распознаются аминоацил-тРНК-синтетазами. Некоторые положения (голубые точки) консервативны во всех молекулах тРНК и поэтому не являются их отличительными признаками. Другие положения распознаются одной (желтые) или несколькими (зеленые) аминоацил-тРНК-синтетазами. Для некоторых синтетаз при распознавании важна не последовательность тРНК, а другие особенности строения.
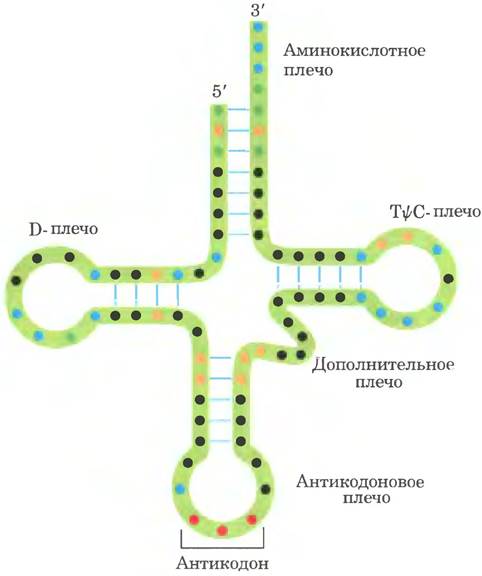
Рис. 27-22. Аминоацил-тРНК-синтетазы. Для обеих синтетаз приведены комплексы с соответствующими тРНК (зеленые стержневые структуры). Связанный АТР (красный) находится в активном центре в аминоацильном плече, а — Gln-тРНК-синтетаза из Е. coli, типичный пример мономерной синтетазы I (PDB ID 1QRT). б — Asp-тРНК-синтетаза из дрожжей, типичный пример димерной синтетазы II (PDB ID 1ASZ).
В распознавании тРНК ее аминоацил-тРНК- синтетазой задействовано 10 или более специфических нуклеотидов. Но в некоторых случаях механизм распознавания очень простой. У всех организмов от бактерий до человека в распознавании тРНК Аlа-тРНК-синтетазами главную роль играет одна-единственная пара оснований G = U в аминокислотном плече тРНКАlа (рис. 27-23, а). Короткая РНК всего из 7 п. н., образующих простую миниспираль в виде шпильки, успешно аминоацилируется Аlа-тРНК-синтетазой при наличии в РНК ключевой пары G = U (рис. 27-23, б). Такая простая система распознавания аланина, возможно, сохранилась с того времени, когда олигонуклеотиды-предшественники РНК, подвергались аминоацилированию для синтеза белка в примитивной системе.
Взаимодействие аминоацил-тРНК-синтетаз с соответствующими тРНК играет важную роль в правильном считывании генетического кода. Любое расширение кода с включением новой аминокислоты неизбежно потребовало бы образования новой пары аминоацил-тРНК- синтетаза/тРНК. В природе расширение генетического кода наблюдается редко, чаще зтот случай может быть реализован в лабораторных условиях (доп. 27-3).
Рис. 27-23. Структурные элементы тРНКАlа, необходимые для распознавания Аlа-тРНК-син- тетазой. а — структурные элементы тРНКАlа, распознаваемые Аlа-тРНК-синтетазой. Пара оснований G = U (выделена розовым цветом) — единственный элемент, необходимый для специфического связывания и аминоацилирования. б — короткая миниспираль РНК, содержащая ключевую пару оснований G = U, но без большой части структуры тРНК. Эта спираль специфически взаимодействует с Аlа-тРНК-синтетазой почти так же эффективно, как целая молекула тРНКАlа.
Дополнение 27-3, Естественное и искусственное расширение генетического кода
Как мы видели, 20 аминокислот, которые обычно встречаются в белках, обладают лишь ограниченной химической функциональностью. Живые системы обычно преодолевают эти ограничения, используя кофакторы ферментов или модифицируя отдельные аминокислоты после их включения в белки. Расширение генетического кода для включения в белки новых аминокислот предлагает принципиально другой путь изменения функциональности, однако реализовать этот путь достаточно сложно. Подобное изменение может инактивировать тысячи клеточных белков.
Расширение генетического кода для включения новой аминокислоты требует ряда изменений в клетке В частности, необходима новая аминоацил-тРНК- синтетаза, а также соответствующая тРНК. Оба эти компонента должны быть высокоспецифичными и взаимодействовать исключительно между собой и с новой аминокислотой. В клетке должно присутствовать достаточное количество новой аминокислоты, что может привести к появлению новых метаболических путей. Как подчеркивается в доп. 27-1, антикодон на тРHК с большей вероятностью спаривался бы с кодоном, который в норме вызывает терминацию трансляции. Выполнение всех этих условий в живой клетке кажется маловероятным, однако такие ситуации все же встречаются в природе и могут быть созданы искусственным путем в лабораторной практике.
В настоящее время известно уже не 20, а 22 аминокислоты, которым соответствует определенный генетический код. Две дополнительные аминокислоты селеноцистеин и пирролизин; обе встречаются лишь в нескольких белках, но позволяют узнать кое-что новое об эволюции генетического кода.
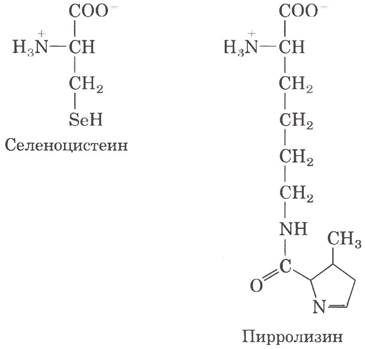
Во всех известных клетках лишь немногим белкам (таким как формиатдегидрогеназа бактерий и глутатионпероксидаза млекопитающих) для проявления каталитической (ферментативной) активности требуется селеноцистеин. В клетках Е. coli селеноцистеин встраивается в формиатдегидрогеназу в процессе трансляции на место находящегося в рамке считывания кодона UGA. Особая Ser-тРНК, количество которой в клетке меньше, чем других Ser-тРНК, распознает исключительно кодон UGA. Эта тРНК нагружается серином при помощи обычной сериновой аминоацил-тРНК-синтетазы, а под действием другого фермента серин превращается в селеноцистеин до синтеза пептидной связи на рибосоме. Нагруженная тРНК узнает далеко не все кодоны UGA; какие-то еще не до конца изученные сигналы в мРНК отвечают за то, что эта тРНК лишь в некоторых генах распознает некоторые кодоны UGA, которые воспринимаются как селеноцистеин. На самом деле UGA играет роль одновременно стоп-кодона и (очень редко) кодона селеноцистеина. Такое расширение генетического кода потребовало появления соответствующей тРНК, но не специфической аминоацил-тРНК-синтетазы. Итак, образуется селеноцистеин, теперь можно предположить, что весь этот процесс является промежуточным этапом образования совершенно нового кодона.
Пирролизин содержится в группе анаэробных архей, называемых метаногенами (см. доп. 22-1). Продуктом метаболизма этих микроорганизмов является метан, а некоторые из них, относящиеся к группе метаносарцин, в качестве субстрата для метаногенеза используют метиламины. Для образования метана из монометиламина необходима специфическая метил- трансфераза. В рамке считывания гена этого фермента содержится стоп-кодон UAG. Структура данной метил- трансферазы была установлена в 2002 г., при этом выяснилось, что в ней содержится новая аминокислота пирролизин, соответствующая этому кодону UAG. Последующие эксперименты показали, что в отличие от селеноцистеина пирролизин прямо присоединяется к соответствующей тРНК с помощью пирролизил-тРНК- синтетазы. Метаболический путь синтеза пирролизина в этих клетках еще предстоит исследовать. В данном случае имеются все признаки, необходимые для присвоения кодону UAG новой функции, однако кодон UAG транслируется в пирролизин лишь в одном конкретном гене. Как и в случае селеноцистеина. возможно, существуют определенные сигналы, направляющие данную тРНК к правильному кодону UAG.
Могут ли ученые воссоздать этот эволюционный путь искусственным путем? Модификации белков с различными функциональными группами могут значительно расширить наши представления об их активности и структуре. Однако модификация белков часто представляет собой достаточно сложную проблему. Например, если требуется присоединить новую группу к определенному остатку цистеина, нужно каким-то образом защитить все остальные остатки Cys в этом белке. Но если бы удалось адаптировать генетический код таким образом, чтобы заставить клетку вводить модифицированное основание в конкретное положение в белке, работать с такой системой стало бы гораздо удобнее. Питер Шульц с коллегами действовали именно так.
Чтобы создать кодон для новой аминокислоты, требуется новая аминоацил-тРНК-синтетаза и соответствующая новая тРНК, которые предназначены для работы исключительно с новой аминокислотой. Ученые пытались создать такой «искусственный код» в клетках Е. coli. Для кодирования новой аминокислоты был выбран кодон UAG. Этот кодон в качестве стон-кодона используется реже двух других, и штаммы с тРНК к этому кодону (см. дон. 27-4) нормально растут. Для создания новой тРНК и новой тРНК-синтетазы из архей Methanococcus jannaschii были взяты гены тирозил- тРНК и соответствующей тирозил-тРНК-синтетазы (MjтРНКТyr и MjTyr-тРHК-синтетаза). Ai/Tyr-тРПК- синтетаза не связывается с антикодоновой петлей MjтРНКТyr. что позволило изменить антикодон на CUA (комплементарен UAG), не нарушая взаимодействия. Системы трансляции архей и бактерий ортологичны, поэтому модифицированные компоненты системы архей можно перенести в клетки Е. coli без нарушения собственной системы трансляции бактериальных клеток.
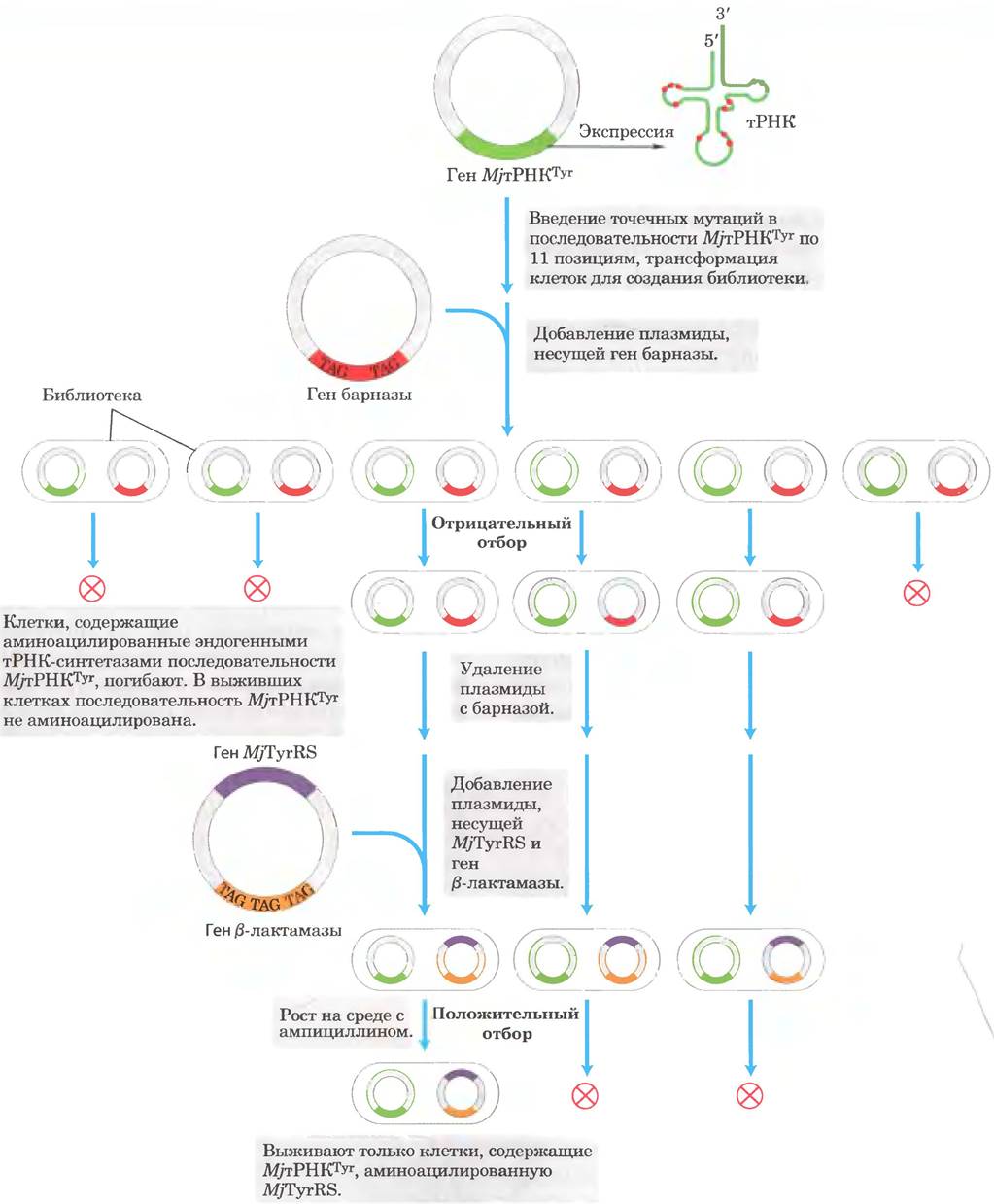
Во-первых, нужно было модифицировать ген MjтРНКTyr таким образом, чтобы создать идеальную тРНК. которую не распознавали бы эндогенные аминоацил-тРНК-синтетазы Е. coli, но которая подвергалась бы аминоацилированию под действием MjтTyr- тРНК-синтетазы. Для поиска такого варианта была предпринята серия циклов положительного и отрицательного отбора, что позволило провести эффективный скрининг вариантов генов тРНК (рис. 1). Ген MjтРНКТуr был подвергнут случайному мутагенезу, что позволило создать библиотеку клонов, экспрессирующих различные версии тРНК. Кроме того, был сконструирован ген барназы (токсичной для Е. coli рибонуклеазы), мРНК которого содержал несколько кодонов UAG, и этот геи также был введен в клетки бактерии на плазмиде. Если вариант МjтРНКТуr, экспрессирующийся в определенных клетках из библиотеки, подвергался аминоацилированию эндогенной тРНК-синтетазой, он также экспрессировал ген барпазы, и такие клетки погибали (отрицательный отбор). Выжившие клетки должны были содержать варианты тРHК, которые не подвергались аминоацилированию эндогенной тРНК-синтетазой, но, в принципе, могли подвергаться аминоацилированию МjТуr-тРНК-синтетазой. Для положительного отбора (рис. 1) был использован генно-инженерный вариант гена β-лактамазы (сообщает клеткам устойчивость к антибиотику ампициллину), транскрипт которого содержал несколько кодонов UAG. Этот ген был введен в клетки вместе с геном MjТуг-тРНК- синтетазы. Те варианты МjтРНКТуr, которые могли подвергаться аминоацилированию под действием МjТуr-тРНК-синтетазы, росли на среде с ампициллином только в том случае, если в них также экспрессировалась МjТуr-тРНК-синтетаза. Несколько циклов отрицательного и положительного отбора позволили идентифицировать новый вариант Мjт PHКTуr, на который не действовали эндогенные ферменты, но который подвергался аминоацилированию под действием МjТуr-тPHК-синтетазы и нормально функционировал при трансляции.
Рис. 1. Отбор вариантов MjтРНКТуr, которые взаимодействуют только со специфической тирозил-тРНК-синтетазой (MjTyr-тРНК-синтетазой). В последовательность гена МjтРНКТyr, встроенного в плазмиду, внесено 11 точечных мутаций в тех местах, которые не влияют на взаимодействие с MjTyr-тРНК-синтетазой (красные точки). Плазмиды с мутантным геном вводили в клетки Е. coli для создания библиотеки, содержащей миллионы вариантов MjтРНКTyr, которые здесь представлены шестью клетками. Для отрицательного отбора на другой плазмиде в клетки был введен токсичный для клеток ген барназы. В этот ген была встроена последовательность TAG, так что транскрипт гена приобрел кодон UAG. Если ген барназы экспрессируется, клетки погибают. Ген мог экспрессироваться лишь в том случае, если вариант MjтРНКТуr, экспрессируемый определенной клеткой, подвергался аминоацилированию под действием эндогенных (т. е. принадлежащих Е. coli) аминоацил-тРНК-синтетаз, что приводило к встраиванию аминокислоты, а не к остановке трансляции. Кроме того, в клетки был введен еще на одной плазмиде модифицированный ген β-лактамазы, также с последовательностью TAG, образующей при транскрипции стоп-кодон UAG. На той же плазмиде содержался ген MjTyr-тРНК-синтетазы. Эта система использовалась для положительного отбора среди оставшихся вариантов MjтРНКТyr. Те варианты, которые подвергались аминоацилированию под действием MjTyr-тРНК-синтетазы. экспрессировали ген β-лактамазы, что позволяло клеткам расти на среде с ампициллином. Через несколько циклов положительного и отрицательного отбора были выделены лучшие варианты MjтРНКТyr, которые подвергались аминоацилированию исключительно под действием MjTyr-тРНК-синтетазы и эффективно использовались для трансляции.
Во-вторых, нужно было модифицировать МjТуr- тРНК-синтетазу, чтобы она распознавала новую аминокислоту. Для создания большой библиотеки вариантов ген МjТуr-тРНК-синтетазы подвергли мутагенезу. Те варианты, которые аминоацилировали новый вариант МjтРНКТуr с помощью эндогенных аминокислот, были исключены методом отбора с использованием гена барназы. Был проведен второй вариант положительного отбора (аналогичный отбору с помощью ампициллина), в результате клетки могли выживать лишь при условии, что новый вариант МjтРНКТуr подвергался аминоацилированию только в присутствии неприродной аминокислоты. После нескольких циклов отрицательного и положительного отбора была найдена пара тРНК-синтетаза/тРHК, которая узнавала только неприродную аминокислоту. Эти молекулы были переименованы, чтобы указать на неприродное происхождение аминокислоты, которая была использована для отбора.
С помощью данного подхода было сконструировано много штаммов Е. coli, каждый из которых воспринимал кодон UAG как сигнал к встраиванию только одной неприродной аминокислоты. Тот же подход применяли для искусственного расширения генетического кода дрожжей и даже клеток млекопитающих. В определенные положения в последовательности клонированных белков удалось ввести свыше 30 различных аминокислот (рис. 2). Полученные результаты предоставили очень полезный и гибкий инструмент для углубленного изучения структуры и функций белка.
Рис. 2. Стримеры неприродных аминокислот, кодоны для которых добавлены в генетический этих неприродных аминокислотах содержатся не совсем обычные химические кетогруппа; б — азидная группа; в — функциональная группа, способная образования крестные сшивки с соседними группами под действием света; г —- аминорафисцентными свойствами; д — аминокислота с тяжелым атомом Вr для кристаллообразования исследований; е — длинноцепочечный аналог цистеина, способный образовывать протяженые дисульфидные мостики.
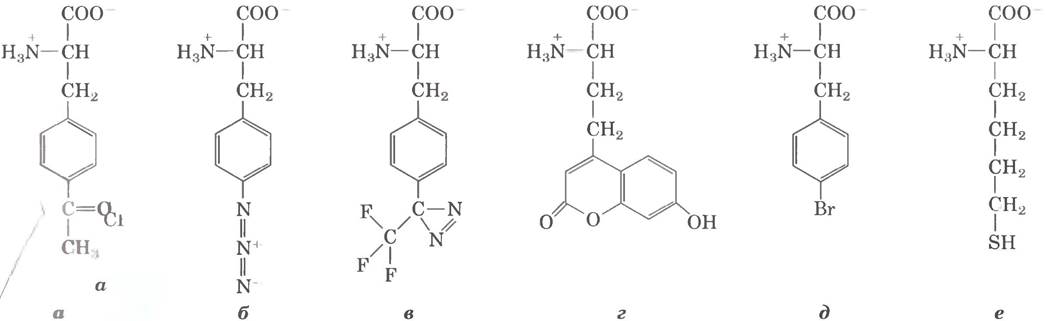
Стадия 2: синтез белка инициирует определенная аминокислота
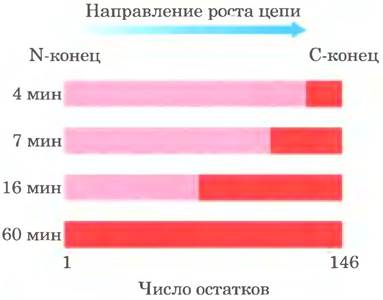
Синтез белка начинается с N-конца и происходит путем последовательного присоединения аминокислот к С-концу растущего полипептида, что было установлено Говардом Динцисом в 1961 г. (рис. 27-24). Инициаторный кодон AUG соответствует N-концевому остатку метионина. Хотя для метионина существует лишь один кодон - (5') AUG, все организмы имеют для метионина две тРНК. Одна используется только для инициаторного кодона (5') AUG, другая — для встраивания остатка Met во внутреннее положение полипептидной цепи.
Рис. 27-24. Доказательство того, что рост полипептидной цепи происходит путем присоединения остатков аминокислот к С-концу: эксперимент Динциса. Ретикулоциты (незрелые эритроциты) — клетки, в которых происходит синтез гемоглобина, инкубировали с радиоактивно меченным лейцином (эта аминокислота была выбрана по той причине, что она часто встречается как в α-, так и β-глобине). Через определенные промежутки времени из препарата ретикулоцитов отбирали сформированные α-цепи и определяли в них распределение радиоактивности. Темно-красные зоны показывают долю полностью сформированных α-глобиновых цепей, содержащих остатки Leu с радиоактивной меткой. На четвертой минуте метка содержится лишь в нескольких остатках со стороны С-конца цепи α-глобина, ведь через 4 мин могли сформироваться α-глобины только из тех последовательностей, синтез которых был закончен на момент добавления метки. При увеличении времени инкубации появились более длинные полипептиды, содержавшие меченые остатки, всегда на участке со стороны С-конца цепи. Так было показано, что немеченый конец полипептида (N-конец) — это инициаторный конец, и полипептидная цепь растет путем последовательного присоединения аминокислот к С-концу.
Различить инициаторный и внутренний кодоны AUG нетрудно. У бактерий есть два типа тРНК, специфичных для метионина, которые обозначаются как тРНКМеt и тPНKfMet. Инициаторному кодону (5') AUG соответствует аминокислота N-формилметионин (fMet). Она поступает на рибосому в виде N-формилметионил- тРНКfMet — формируется в ходе двух последовательных реакций. Сначала метионин присоединяется к тРMet ферментом Met-тРНК- синтетазой (в клетках Е. coli этот фермент осуществляет аминоацилирование и тРНКМеt, и тРHKfMet):
Метионин + тРНКfМеt + ATP —> Met-TPHKfMet + AMP + PPi
Затем трансформилаза переносит формильную группу от N10-формилтетрагидрофолата на аминогруппу остатка Met:
N10-формилтетрагидрофолат + Меt-тРНКfMet —> тетрагидрофолат + fMet-тРНКfMet
Трансформилаза более избирательна, чем Met- тРНК-синтетаза; этот фермент специфичен для остатков метионина, присоединенных к тРНКfMet по-видимому, он распознает особенности строения этой тРНК. Met-TPHKMet же вставляет метионин внутри последовательностей полипептидов.
Присоединение N-формильной группы к аминогруппе метионина под действием трансформилазы предотвращает встраивание fMet во внутренние положения в молекулах полипептидов, однако fMet-тPHKfMet может связываться со специфическим инициаторным сайтом рибосомы, который не присоединяет ни Met-тPHKMet, ни какие-либо другие аминоацил-тРНК.
В клетках эукариот все полипептиды, синтезируемые цитоплазматическими рибосомами, начинаются с остатка Met (а не с fMet), но и в этом случае клетки используют специализированную инициаторную тРНК, которая отличается от тРНКMet для кодонов AUG во внутренних положениях мРНК. Полипептиды, синтезируемые на рибосомах митохондрий и хлоропластов, начинаются с N-формилметионина. Это весьма убедительно подтверждает теорию, что митохондрии и хлоропласта произошли от бактериальных предков, которые на ранней стадии эволюции были включены в клетки-предшественницы современных эукариотических клеток (см. рис. 1-36 в т. 1).
Каким образом единственный кодон (5') AUG может определять, встроится в данной позиции стартовый N-формилметионин (или метионин у эукариот) или внутренний остаток метионина? Ответ кроется в механизме процесса инициации.
Три стадии инициации.
Для инициации синтеза полипептида у бактерий требуется (1) 30S-субъединица рибосомы, (2) мРНК синтезируемого пептида. (3) инициаторная fMet-TPHKfMet. (4) набор из трех белков, называемых факторами инициации (IF-1, IF-2 и IF-3), (5) GTP, (6) 50S-субъединица рибосомы и (7) ионы Mg2+. Формирование инициаторного комплекса происходит в три стадии (рис. 27-25).
Рис. 27-25. Образование инициаторного комплекса у бактерий. Комплекс формируется в три стадии (описаны в тексте) за счет энергии гидролиза GTP с образованием GDP и Pi. Факторы IF-1, IF-2 и IF-3 — факторы инициации. Р — пептидильный сайт. А — аминоацильный сайт, Е — сайт выхода. Антикодон тРНК ориентирован в направлении 3' —> 5' (слева направо), как на рис. 27-8, но в противоположном направлении по сравнению с ориентацией на рис. 27-21 и 27-23.
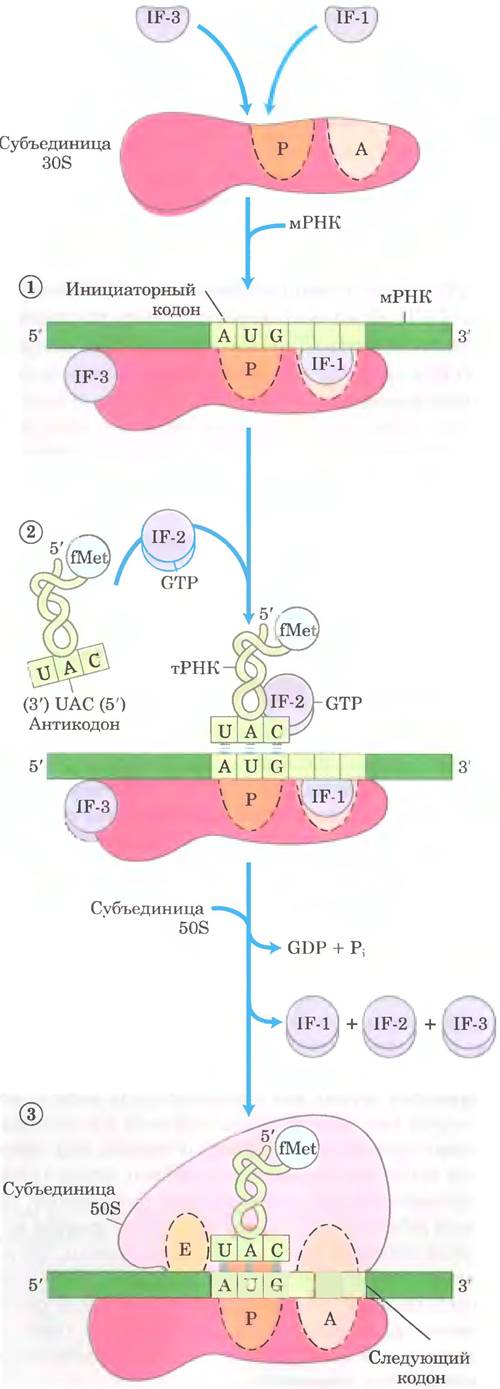
На стадии ① 30S-субъединица рибосомы связывает два фактора инициации. IF-1 и IF- 2. Фактор IF-3 предупреждает преждевременное соединение субъединиц 30S и 50S. Затем с 30S-субъединицей связывается мРНК. Инициаторный кодон (5') AUG попадает в правильную позицию благодаря последовательности Шайна-Дальгарно (в честь идентифицировавших ее австралийских исследователей Джона Шайна и Линн Дальгарпо) в мРНК. Эта консенсусная последовательность из 4-9 пуриновых оснований расположена на расстоянии 8 13 п. н. в сторону 5'-конца от инициаторного кодона (рис. 27-26, а). Эта последовательность спаривается с комплементарной ей обогащенной пиримидинами последовательностью, находящейся вблизи 3'-конца 16S рРНК 30S-субъединицы рибосомы (рис. 27-26, б). Взаимодействие между мРНК и рРНК позволяет расположить инициаторную (5') АUG-последовательность мРНК в строго определенном участке 30S-субъединицы. От других кодонов метионина последовательность (5') AUG, с которой должна связаться fMet- TPHKtMet, отличается своей близостью к последовательности Шайна-Дальгарно в мРНК.
Рис. 27-26. Последовательности мРНК, которые служат сигналами инициации синтеза белка у бактерий, а — правильное расположение инициаторного кодона AUG (на зеленом фоне) в 30S-субъединице рибосомы отчасти зависит от расположенной выше последовательности Шайна-Дальгарно (на розовом фоне). Показаны фрагменты транскриптов мРНК пяти бактериальных генов. Обратите внимание на белок LacI Е. coli, который начинается с кодона GUG (Val) (см. доп. 27-1). б — последовательность Шайна-Дальгарно в мРНК спаривается с последовательностью вблизи 3'-конца 16S рРНК.
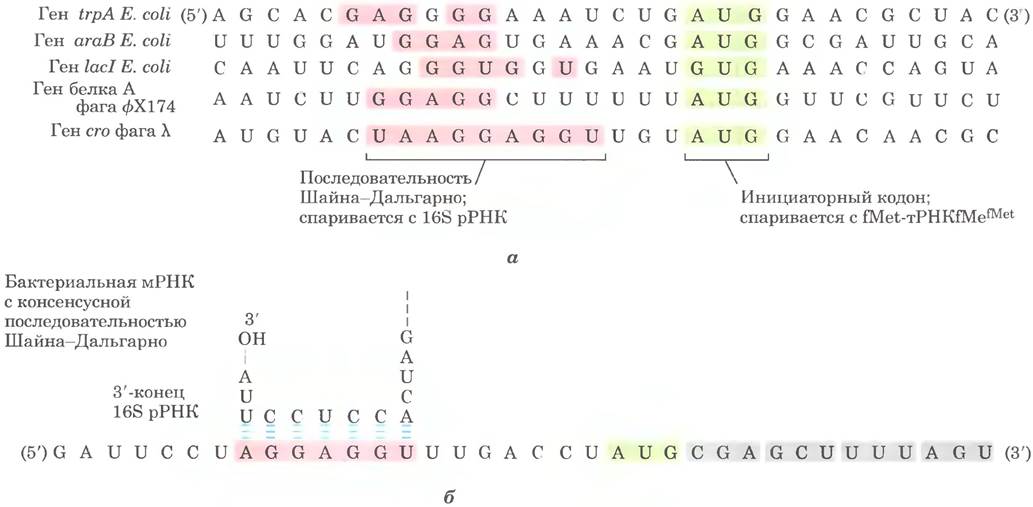
Бактериальные рибосомы имеют три сайта связывания аминоацил-тРНК - аминоацильный (А) и пептидильный (Р), а также сайт выхода (Е). С сайтами А и Р связываются молекулы аминоацил-тРНК, тогда как с сайтом Е связывается исключительно ненагруженная тРНК. Сайты А и Р образованы обеими субъединицами рибосомы (30S и 50S), а сайт Е локализован в основном в 50S-субъединице. Инициаторный кодон (5') AUG располагается в пептидильном участке — только здесь может связаться fMet-TPHKfMet (рис. 27-25). Единственная аминоацил-тРНК, которая сначала связывается с Р-сайтом, — это fMet-TPHKfMet. В процессе элонгации все другие поступающие молекулы аминоацил-тРНК (включая Met-TPHKMet, которая связывается только с внутренними кодонами AUG) сначала связываются с сайтом А и только затем с сайтами Р и Е. Из сайта Е «разгруженные» тРНК высвобождаются на стадии элонгации. Фактор IF-1 связывается с сайтом А и предотвращает связывание тРНК с этим сайтом на стадии инициации.
К комплексу, состоящему из 30S-субъединицы рибосомы, IF-3 и мРНК, на стадии инициации ② присоединяются GTP и инициаторная fMet-тPHKfMet (рис. 27-25). Теперь антикодон этой тРНК спаривается с инициаторным кодоном мРНК.
На стадии ③ этот крупный комплекс объединяется с 50S-субъединицей рибосомы; в это же время GTP, связанный с IF-2, гидролизируется до GDP и Pi, которые высвобождаются из комплекса. В этот момент все три фактора инициации отделяются от рибосомы.
Завершение стадий (рис. 27-25) приводит к образованию функциональной 70S-рибосомы, называемой инициаторным комплексом, которая содержит мРНК и инициаторную fMet- тРНКfMet. Правильное связывание fMet-TPHKfMet на P-сайте в инициаторном 70S-комплексе обеспечивается, как минимум, тремя точками распознавания: взаимодействием кодона и антикодона, включающим фиксирование инициатор- ного кодона AUG на P-сайте; взаимодействием между последовательностью Шайна Дальгарно в мРНК и 16S рРНК; и связыванием P-сайта рибосомы и fMet-TPHKfMet. Теперь инициаторный комплекс готов к элонгации.
Инициация в эукариотических клетках.
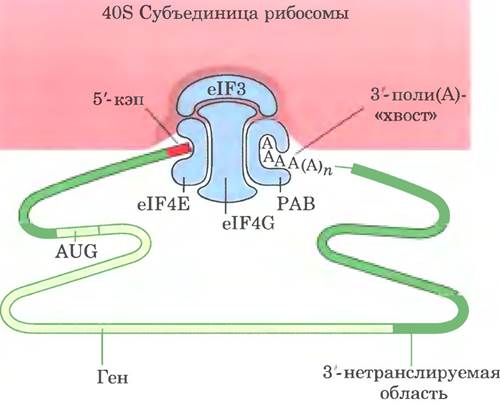
Трансляция в эукариотических и бактериальных клетках происходит похожим образом; большинство различий касаются механизма инициации. Эукариотические мРНК взаимодействуют с рибосомой в виде комплекса с несколькими специфическими связывающими белками. Некоторые из них подтягивают друг к другу 5'- и3'-концы матрицы РНК. С 3'-конца мРНК связывается поли(А)-связывающим белком (РАВ от англ. poly (A) binding protein). Эукариотические клетки содержат, как минимум, девять факторов инициации. Комплекс eIF4F, который включает в себя белки elF4E, elF4G и eIF4A, связывается с 5'-кэпом (см. рис. 26-13) через eIF4E. Белок eIF4G взаимодействует и с eIF4E, и с РАВ, эффективно соединяя их между собой (рис. 27-27). Белок eIF4A обладает активностью РНК-хеликазы. Комплекс eIF4F соединяется с другим фактором, eIF3, и с 40S-субединицей рибосомы. Эффективность трансляции зависит от многих свойств мРНК и белков данного комплекса, включая длину 3'-поли(А)-хвоста (в большинстве случаев чем он длиннее, тем лучше). Сближение концов эукариотической мРНК облегчает регуляцию трансляции экспрессии генов (см. гл. 28).
Рис. 27-27. Роль белков в формировании инициаторного комплекса у эукариот. 3'- и 5'-концы эукариотической мРНК связаны с комплексом белков, состоящим из нескольких факторов инициации и поли(А)-связывающего белка (РАВ). Факторы eIF4E и eIF4G входят в состав более крупного комплекса eIF4F. Этот комплекс связывается с 40S-субъединицей рибосомы.
Инициаторный кодон (5') AUG в мРНК определяется не по его близости к последовательности Шайна-Дальгарно, а путем сканирования мРНК, начиная от 5'-конца до первого встреченного кодона AUG, который указывает начало рамки считывания. Возможно, в этом процессе участвует комплекс elFiF, который использует PFIK-хеликазную активность elF4 для удаления вторичной структуры в 5'-нетраяслируемой области мРНК. Белок eIF4B тоже облегчает сканирование.
Функции различных бактериальных и эукариотических факторов инициации отражены в табл. 27-8. Механизм действия этих белков активно изучается.
Таблица 27-8. Белковые факторы, необходимые для инициации трансляции в бактериальных и эукариотических клетках
Фактор |
Функция |
Бактерии |
|
IF1 |
Препятствует преждевременному связыванию молекул тРНК с сайтом А |
IF2 |
Облегчает связывание fMet-TPHKfMet с 30S-субъединицей рибосомы |
IF3 |
Связывается с 30S-субъединицей рибосомы; предупреждает преждевременное связывание 50S-субъединицы; усиливает специфичность P-сайта к fMet-TPHKfMet |
Эукариоты |
|
eIF2 |
Облегчает связывание инициаторной Met-TPHKMet с 40S - субъединицей рибосомы |
eIF2B, eIF3 |
Первыми связываются с 40S-субъединицей рибосомы; облегчают последующие стадии |
eIF4A |
РНК-хеликазная активность изменяет вторичную структуру мРНК, позволяя связаться с 408-субъединицей рибосомы; часть комплекса elFiF |
eIF4B |
Связывается с мРНК; облегчает сканирование мРНК для поиска первого кодона AUG |
eIF4E |
Связывается с 5'-кэпом мРНК; часть комплекса eIF4F |
eIF4G |
Связывается с eIF4E и поли(А)-связывающим белком (РАВ); часть комплекса eIF4F |
eIF5 |
Способствует диссоциации нескольких факторов инициации из комплекса с 40S-субъединицей перед присоединением 60S-субъединицы для формирования 80S-инициаторного комплекса |
eIF6 |
Облегчает диссоциацию неактивной 80S-рибосомы на субъединицы 40S и 60S |
Стадия 3: пептидные связи образуются на стадии элонгации
Третья стадия синтеза белка - элонгация. Для начала мы опять сосредоточим внимание на бактериальных клетках. Для элонгации требуется (1) описанный выше инициаторный комплекс, (2) аминоацил-тРНК, (3) три растворимых цитоплазматических белка, называемых факторами элонгации(EF-Tu, EF-Ts и EE-G у бактерий) и (4) GTP. В клетке присоединение каждой аминокислоты происходит в три стадии, и эти стадии повторяются столько раз, сколько аминокислотных остатков нужно присоединить.
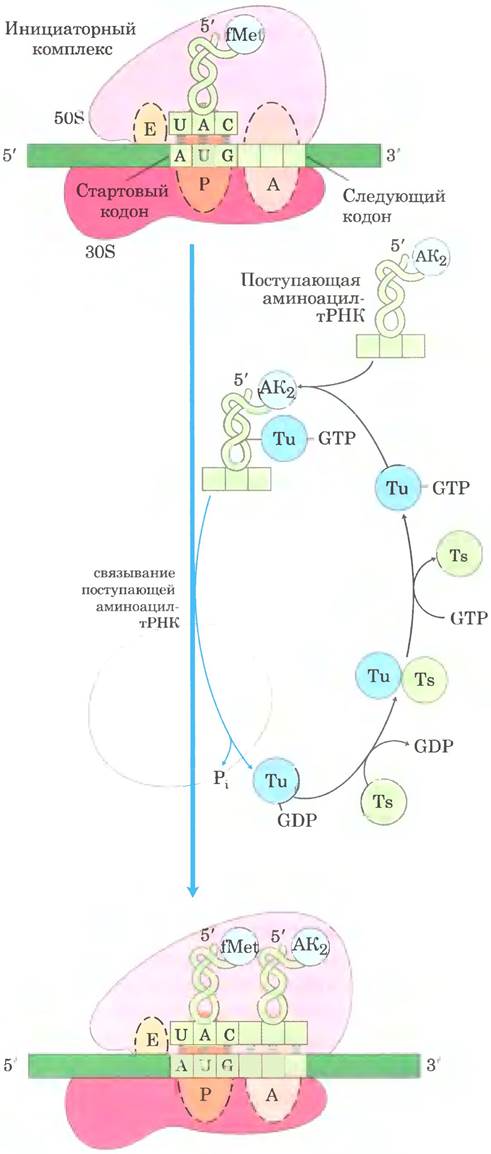
Первая стадия элонгации: связывание аминоацил-тРНК.
На первой стадии цикла элонгации (рис. 27-28) соответствующая аминоацил-тРНК взаимодействует с фактором EF-Tu, связанным с GTP. Комплекс аминоацил-тРНК-EF-Tu-GTP связывается на сайте А 70S-инициаторного комплекса. Молекула GTP гидролизуется, и комплекс EF-Tu-GDP высвобождается из 70S-рибосомы. Далее при участии фактора EF-Ts и GTP комплекс EF-Tu-GTP регенерирует.
Рис. 27-28. Первая стадия элонгации у бактерий: связывание второй аминоацил-тРНК. Вторая аминоацил-тРНК связывается на A-сайте рибосомы, присоединяясь к EF-Tu (здесь просто Тu), который связан с GTP. Связывание второй аминоацил-тРНК на A-сайте сопровождается гидролизом GTP до GDP и Pi, а также отделением комплекса EF-Tu-GDP от рибосомы. Связанный GDP высвобождается, когда комплекс EF-Tu-GDP присоединяется к EF-Ts, a EF-Ts высвобождается, когда другая молекула GTP связывается с EF-Tu. В результате фактор EF-Tu готов к очередному циклу элонгации.
Вторая стадия элонгации: формирование пептидных связей.
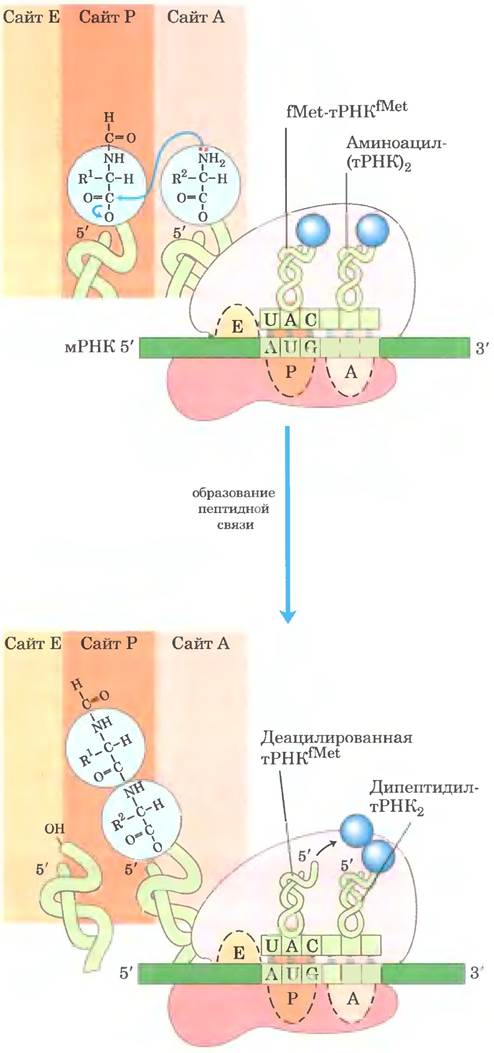
Ela этой стадии формируется пептидная связь между двумя аминокислотами, связанными через соответствующие тРНК с А- и Р-сайтами рибосомы. Инициаторная N-формилметионильная группа переносится от своей тРНК на аминогруппу второй аминокислоты, находящейся в сайте А (рис. 27-29). При этом α-аминогруппа аминокислоты в сайте А выступает в роли нуклеофила, вытесняя тРНК, находящуюся в сайте Р, и образуя пептидную связь. В результате на сайте А образуется дипептидил-тРНК, а «разгруженная» (деацилированная) тРНКfMet остается связанной с сайтом Р. Затем молекулы тРHК сдвигаются, занимая промежуточное положение, при котором каждая частично находится в двух сайтах рибосомы, как показано на рис. 27-29.
Рис. 27-29. Вторая стадия элонгации у бактерий: формирование первой пептидной связи. Пептидилтрансферазная активность, ответственная за осуществление этой реакции, принадлежит рибозиму 23S рРНК. В ходе реакции N-формилметионильная группа переносится на аминогруппу второй аминоацил-тРНК, образуя дипептидил- тРНК. При этом обе тРНК, оставаясь связанными с рибосомой, сдвигаются и занимают промежуточное положение на 50S-субъединице рибосомы. «Разгруженная» тРНК сдвигается таким образом, что ее 3'- и 5'-концы находятся на сайте Е. Аналогичным образом, 3'- и 5'-концы пептидил-тРНК перемещаются в сайт Р. Антикодоны остаются в сайтах А и Р.
Исторически сложилось так. что ферментативную активность, ответственную за образование пептидной связи, назвали пептидилтрансферазной и приписывали одному или нескольким белкам в большой субъединице рибосомы. Теперь мы знаем, что эту реакцию катализирует 23S рРНК (рис. 27-13, г) — еще один рибозим. Это открытие интересно тем, что позволяет проследить эволюционные связи (см. доп. 27-2).
Третья стадия элонгации: транслокация.
На заключительной стадии цикла элонгации, называемом транслокацией, рибосома передвигается на один кодон по направлению к 3'-концу мРНК (рис. 27-30, а). При этом антикодон дипептидил- тРНК, который все еще присоединен ко второму кодону мРНК, сдвигается из сайта А в сайт Р, а деацилированная тРНК смещается из сайта Р в сайт Е, откуда высвобождается в цитозоль. Теперь в сайте А расположен третий кодон мРНК, а в сайте Р — второй кодон. Для передвижения рибосомы вдоль мРНК необходим фактор EF-G (транслоказа) и энергия, которая выделяется в результате гидролиза следующей молекулы GТР. Изменение трехмерной конформации рибосомы приводит к ее перемещению вдоль молекулы мРНК. Поскольку структура ЕF-G напоминает структуру комплекса ЕF-Тu-тРНК (рис. 27-30, б), возможно, что ЕF-G связывается на сайте А и смещает пептидил-тРНК.
Рис. 27-30. Третья стадия элонгации у бактерий: транслокация. а — рибосома сдвигается на один кодон по направлению к 3'-концу мРНК, используя энергию гидролиза GTP, связанного с EF-G (транслоказой). Дипептидил- тРНК полностью смещается на сайт Р, а сайт А освобождается для следующей (третьей) аминоацил-тРНК. «Разгруженная» тРНК отщепляется от сайта Е, и цикл элонгации начинается снова, б — структура EF-G подобна структуре EF-Tu в комплексе с тРНК. Слева: EF-Tu, связанный с тРНК (зеленая) (PDF ID 1В23); справа: EF-G, связанный с GDP (красный) (PDFID 1DAR). С-конец EF-G (темно-серый) по форме и по распределению заряда напоминает антикодо- новое плечо тРНК.
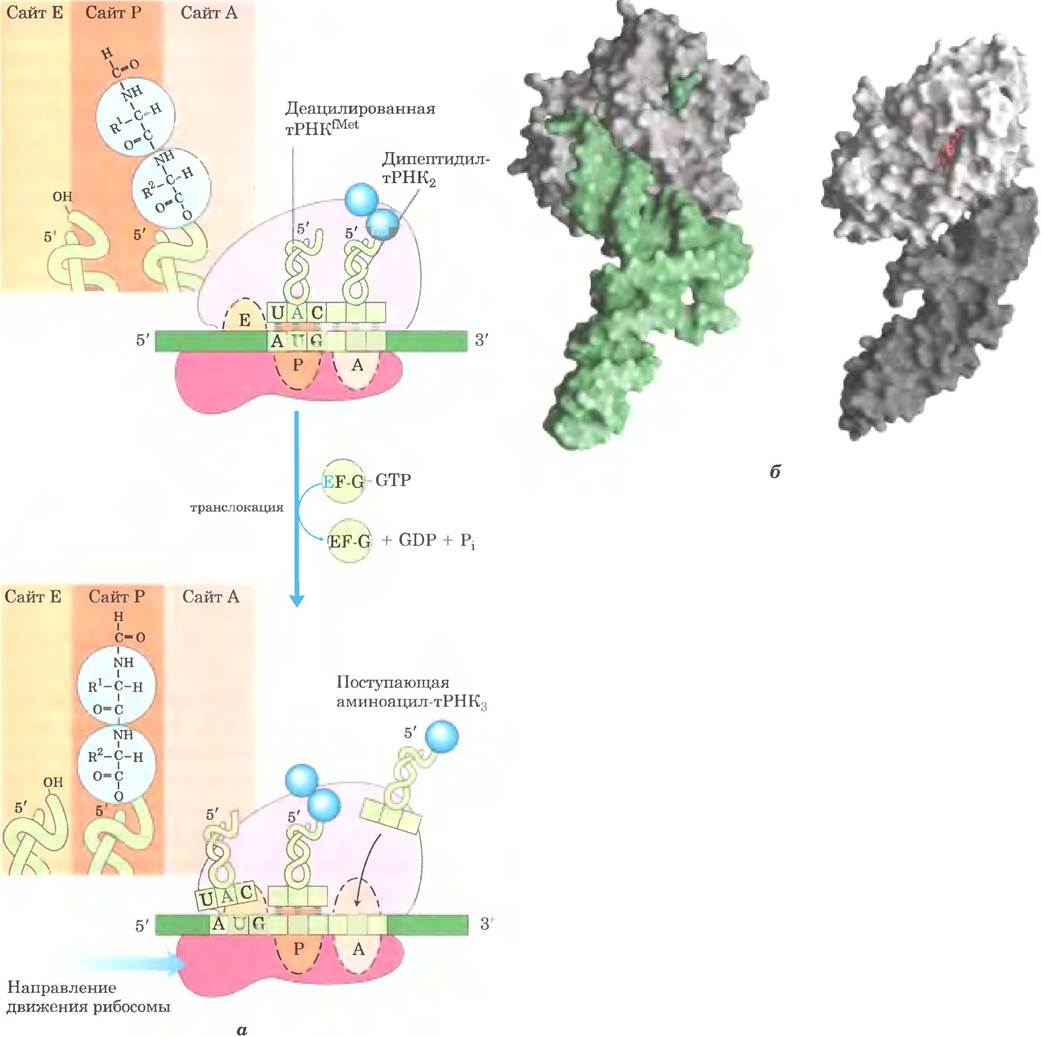
После транслокации рибосома с присоединенными к ней дипептидил-тРНК и мРНК готова к следующему циклу элонгации и связыванию третьего аминокислотного остатка. Этот процесс осуществляется таким же образом, как и присоединение второго остатка (рис. 27-28, 27-29 и 27-30), при продвижении рибосомы от кодона к кодону вдоль мРНК по направлению к 3'-концу. Присоединение каждого аминокислотного остатка к растущей полипептидной цепи сопровождается гидролизом двух молекул GTP до GDP и Рi.
Полипептид остается связанным с тРНК своей последней (присоединенной) аминокислотой. Таким образом сохраняется взаимосвязь между информацией в мРНК и синтезом полипептида. Сложноэфирная связь между тРНК и С-концом растущего полипептида готова к тому, что ее карбоксильная группа будет нуклеофильно атакована следующей аминокислотой, что приведет к образованию новой пептидной связи (рис. 27-29). При образовании новой пептидной связи сложноэфирная связь между полипептидом и тРНК разрывается, но взаимосвязь между полипептидом и информацией в мРНК сохраняется, так как каждая новая аминокислота присоединяется к своей тРНК.
Цикл элонгации у эукариот напоминает цикл элонгации у бактерий. По функциям три фактора элонгации эукариот еЕF1α, еЕF1βy и еЕF2 аналогичны факторам элонгации бактерий ЕF-Тu, ЕF-Тs и ЕF-G. В рибосомах эукариот нет сайта Е; разгруженные молекулы тРНК отщепляются от сайта Р.
Коррекция ошибок на рибосоме.
На первой стадии элонгации в бактериальных клетках (рис. 27-28) СТРазная активность ЕF-Тu во многом определяет скорость и точность всего процесса биосинтеза. Оба комплекса ЕF-Тu-GТР и ЕF-Тu-GDР существуют всего несколько миллисекунд, а потом распадаются; за это время дважды осуществляется проверка правильности взаимодействия кодона с антикодоном. Обычно в первый раз неправильная аминоацил- тРНК отщепляется от сайта А. Если вместо GТР используется его аналог гуанозин-5'-O-(3- тиотрифосфат) (GТРyS), гидролиз замедляется, точность синтеза повышается (благодаря более длительной проверке), но снижается скорость синтеза.
В ходе эволюции синтез белка (спаривание кодона и антикодона) достиг оптимального соотношения между скоростью и точностью (например, правильность аминокислотной последовательности или спаривания оснований). Точность может замедлять скорость, а скорость может ухудшить точность. Вспомните также, что механизм коррекции ошибок на рибосоме проверяет только правильность спаривания кодона с антикодоном, но не выбор присоединяемой к тРНК аминокислоты. Если тРНК связала неправильную аминокислоту (что можно сделать экспериментально), эта аминокислота успешно встроится в белковую последовательность в той позиции, где находится распознаваемый этой тРНК кодон.
Стадия 4: для прекращения синтеза полипептида нужен специальный сигнал
Элонгация продолжается до тех пор, пока рибосома не добавит последнюю аминокислоту, кодируемую мРНК. О переходе к заключительной стадии биосинтеза белка, терминации, сигнализирует один из трех стоп-кодонов (UAA, UAG, UGA). который располагается сразу после кодона последней аминокислоты. Мутации в антикодоне тРНК, которые позволяют встраивать аминокислоту в ответ на стоп-кодон, обычно губительны для клетки (доп. 27-4).
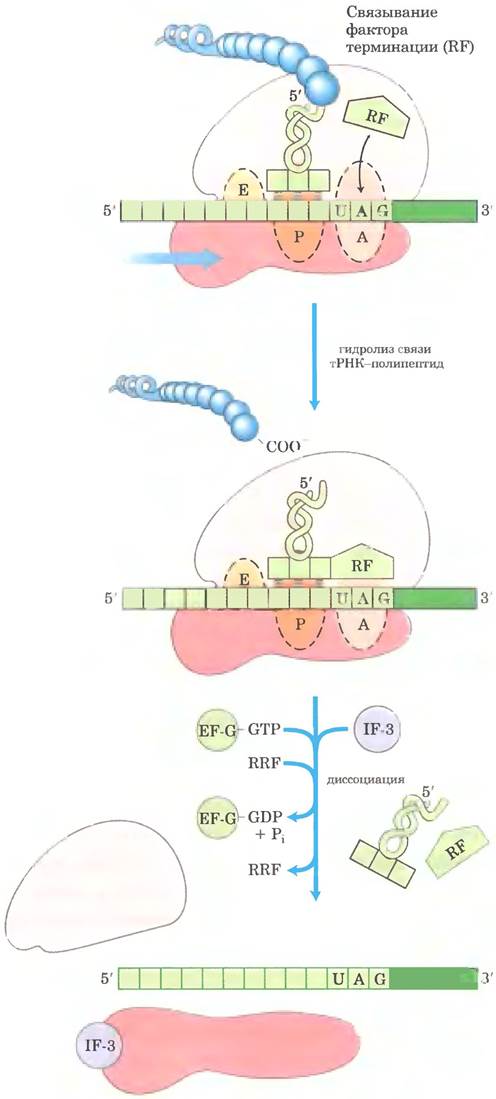
У бактерий, после того как стоп-кодон занимает A-сайт рибосомы, подключаются три фактора терминации, или фактора высвобождения, — белки RF-1. RF-2 и RF-3. Они участвуют (1) в гидролизе концевой связи пептидил-тРНК; (2) в высвобождении свободного полипептида и последней разгруженной молекулы тРНК из Р-сайта: и (3) в диссоциации 70S-рибосомы на субъединицы 30S и 50S, которые готовы к началу нового цикла синтеза полипептида (рис. 27-31). Фактор RF-1 распознает стоп-кодоны UAG и UAA, a RF-2 — UGA и UAA. Либо RF-1, либо RF-2 (в зависимости от стоп-кодона) связывается со стоп-кодоном; затем под действием пептидилтрансферазы растущий полипептид связывается с молекулой воды, а не с другой аминокислотой. По-видимому, факторы терминации содержат домены, имитирующие структуру тРНК, как показано на рис. 27-30, б для фактора элонгации EF-G. Специфическая функция RF-3 пока не установлена, но предполагается, что он участвует в высвобождении субъединицы рибосомы. У эукариот один фактор терминации eRF распознает все три стоп-кодона.
Высвобождение и распад рибосом на субъединицы приводит к диссоциации компонентов трансляционного комплекса Факторы терминации уходят из комплекса (с разгруженной тРНК в Р-сайте) и заменяются на ЕF-G и так называемый фактор рециклизации рибосом (RRF; Мr 20 300). Гидролиз GТР под действием EF-G приводит к уходу 50S-субъединицы из комплекса 30S-тРНК- мРНК. Факторы EF-G и RRF заменяются на IF-3, который способствует высвобождению тРНК. Затем отделяется мРНК. После этого комплекс IF-3 и 30S-субъединицы готов инициировать новый раунд синтеза белка (рис. 27-25).
Дополнение 27-4. Индуцированные вариации генетического кода: нонсенс-супрессия
Если в результате мутации внутри гена образуется стоп-кодон, трансляция преждевременно прекращается, а незавершенный полипептид обычно оказывается неактивным. Такие мутации называются нонсенс-мутациями (бессмысленными мутациями). Нормальная функция гена может быть восстановлена в результате второй мутации, которая (1) превращает ошибочный стон-кодон в кодон какой-нибудь аминокислоты, или (2) подавляет действие стоп-кодона. Такие восстановительные мутации называются нонсенс-супрессорами; они обычно происходят в генах тРНК и приводят к образованию измененных (супрессорных) молекул тРНК, способных распознавать стоп-кодон и встраивать на это место аминокислоту. В антикодонах большинства известных супрессорных молекул тРНК произошла замена одного основания.
Супрессорные тРНК создают экспериментально индуцированные вариации генетического кода, позволяя производить считывание со стоп-кодонов, по аналогии с природными вариациями кода, описанными в доп. 27-1. Нонсенс-супрессии не полностью блокируют нормальный процесс передачи информации в клетке, поскольку обычно в клетке содержится несколько копий гена каждой тРНК; некоторые из этих копий слабо экспрессируются и составляют незначительную часть клеточного пула конкретной тРНК. Супрессорные мутации обычно затрагивают эти «минорные» копии тРНК, а основная тРНК продолжает нормально считывать соответствующий кодон.
Например, Е. coli имеет три идентичных гена для тРНКТуr, с каждого из которых синтезируется тРНК с антикодоном (5’) GUА Один из этих генов экспрессируется относительно интенсивно, и его продукт представляет основной тип тРНКТyr; два других гена транскрибируются очень слабо. В антикодоне одного из этих двух продуктов происходит замена (5’) GUА на (5’) СUА, приводящая к синтезу минорной тРНКТyr, которая на месте стоп-кодонов UАG встраивает тирозин. Встраивание тирозина на месте кодона UАG происходит с низкой эффективностью, но это позволяет синтезировать достаточное количество полноразмерного белка с гена, несущего нонсенс-мутацию, что позволяет клетке выжить. Основная тРHКTуr продолжает нормально транслировать генетический код для синтеза большинства белков.
Мутация, приводящая к возникновению супрессорной тРНК, не всегда затрагивает антикодон. Супрессия нонсенс-кодонов UGА обычно происходит в тРНКТуr, которая в норме распознает UGG. Изменение, которое позволяет считывать UGА (и встраивать в это положение остатки Тrр), заключается в заменеG на А в позиции 24 (в отдаленном от антикодона плече тРНК); теперь эта тРНК может распознавать оба кодона — и UGG, и UGА. Похожее изменение обнаружено в тРНК, участвующих в наиболее распространенном природном изменении генетического кода (UGА = Тrр: см. доп. 27-1).
Супрессия может привести к образованию большого количества аномально длинных белков, но это происходит не всегда. Пока нам известны лишь некоторые подробности молекулярных событий, происходящих при терминации трансляции и нонсенс-супрессии.
Энергетическая стоимость точности (правильности) синтеза белка.
Синтез белка на основе закодированной в мРНК информации требует энергетических затрат. На формирование каждой аминоацил-тРНК затрачиваются две высокоэнергетические фосфатные группы. Каждый раз, когда ошибочно активированная аминокислота гидролизируется под действием деацилирующей способности аминоацил-тРНК-синтетазы, расходуется еще одна молекула АТР. Одна молекула GTP расщепляется на GDP и Рi во время первой стадии элонгации, и еще одна — при транслокации. Таким образом, для образования каждой пептидной связи в полипептиде требуется энергия гидролиза, как минимум, четырех молекул NTP до NDP.
Рис. 27-31. Терминация синтеза белка у бактерий. Терминация происходит в ответ на стоп-кодон в сайте А. Сначала фактор терминации RF (RF1-1 или RF-2, в зависимости от стоп-кодона) связывается с сайтом А. Это приводит к гидролизу эфирной связи между полипептидом и тРНК в сайте Р и высвобождению завершенного полипептида. В конце мРНК, деацилированная тРНК, и фактор терминации покидают рибосому, которая диссоциирует на 30S- и 50S-субъединицы при участии фактора рециклизации рибосом (RRF), фактора инициации IF-3 и за счет энергии, которая выделяется при гидролизе GТР, опосредованном фактором ЕF-G. Комплекс 30S-субъединицы с IF-3 готов к началу следующего цикла трансляции (см. рис. 27-25).
Это обеспечивает более чем достаточный термодинамический стимул для процесса синтеза: по меньшей мере энергия четырех фосфодиэфирных связей идет на образование одной пептидной связи, стандартная свободная энергия гидролиза которой составляет лишь около -21 кДж/моль: 4 • 30,5 кДж/моль = 122 кДж/ моль. Таким образом, суммарное изменение свободной энергии в реакции синтеза пептидной связи составляет -101 кДж/моль. Белки — это информационные биополимеры Биохимическая цель реакций пептидного синтеза заключается не просто в образовании любой пептидной связи, а связи между двумя определенными аминокислотами. Каждое из богатых энергией фосфатных соединений, затраченных в этом процессе, играет важную роль в обеспечении правильного соответствия между каждым новым кодоном в мРНК и соответствующей аминокислотой в растущем полипептиде. Затраченная энергия обеспечивает очень высокую точность трансляции генетической информации из мРНК в аминокислотную последовательность белка.
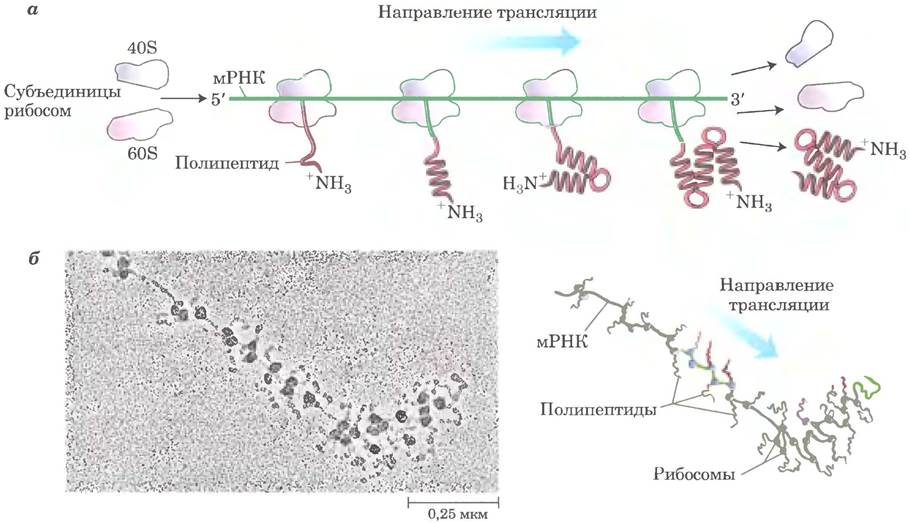
Быстрая трансляция одной матрицы полисомами.
Из бактериальных и эукариотических клеток можно выделить крупные кластеры из 10 100 рибосом, проявляющие высокую активность в синтезе белка. На электронных микрофотографиях видно, что рибосомы образуют кластеры — полисомы, в которых соседние рибосомы соединены между собой тонкими волокнами (рис. 27-32). Эти волокна представляют собой молекулы мРНК, с которых происходит трансляция белка одновременно многими близко расположенными рибосомами, что значительно повышает эффективность процесса.
Рис. 27-32. Полисома, а — четыре рибосомы, одновременно транслирующие одну эукариотическую молекулу мРНК, движутся от 5'- к 3'-концу и синтезируют полипептид с N-конца к С-концу. б — электронная микрофотография; схема поясняет строение полисомы из шелковой железы личинки шелковичного червя. Трансляцию мРНК одновременно осуществляет множество рибосом. Растущий полипептид удлиняется по мере передвижения рибосом в направлении к 3'-концу мРНК. Конечный продукт этого процесса — шелковое волокно.
У бактерий процессы транскрипции и трансляции тесно связаны между собой. Молекулы мРНК синтезируются и транслируются в одном и том же направлении (5' —> 3')- Рибосомы начинают трансляцию 5'-конна мРНК еще до завершения транскрипции (рис. 27-33). Совершенно иная ситуация наблюдается в клетках эукариот, где вновь синтезированные молекулы мРНК сначала покидают ядро и лишь затем используются для синтеза белка.
Рис. 27-33. Сопряжение транскрипции и трансляции у бактерий. Рибосомы уже начинают трансляцию мРНК, которая еще не закончила транскрибироваться РНК- полимеразой с матрицы ДНК. Это возможно по той причине, что для встречи с рибосомами бактериальная мРНК не должна транспортироваться из ядра в цитоплазму. На схеме рибосомы изображены более мелкими, чем РНК- полимераза. На самом деле рибосомы (Мr = 2,7 • 106) на порядок крупнее РНК-полимеразы (Мr = 3,9 • 105).
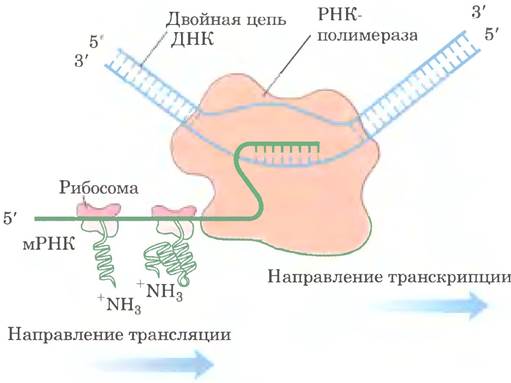
Молекулы бактериальной мРНК обычно существуют всего несколько минут (разд. 26.2), а потом разрушаются нуклеазами. Для поддержания высоких темпов синтеза белка каждая мРНК должна синтезироваться постоянно и транслироваться с максимальной эффективностью. Краткость существования мРНК у бактерий позволяет быстро прекратить синтез, если белок больше не нужен.
Стадия 5: вновь синтезированные полипептиды сворачиваются и процессируются
На заключительной стадии синтеза белка образующаяся цепь полипептида сворачивается в биологически активную форму. Во время синтеза или после него полипептид постепенно приобретает свою нативную конформацию, при этом образуются водородные связи, проявляются ван-дер-ваальсовы, ионные и гидрофобные взаимодействия. В результате линейная, т. е. одномерная, генетическая информация мРНК преобразуется в трехмерную структуру белка. Некоторые вновь синтезированные белки бактерии, архей и эукариот не принимают окончательной биологически активной конформации до тех нор, пока не подвергнутся некоторым реакциям процессинга, называемым посттрансляционными модификациями.
Модификации N-конца и С-конца.
Первый аминокислотный остаток во всех полипептидах - N-формилметиопин (у бактерий) или метионин (у эукариот). Однако в процессе образования функционального белка формильная группа, N-концевой остаток метионина и несколько других N-концевых остатков (а иногда и С-концевых остатков) могут удаляться ферментативным путем. Примерно у 50% эукариотических белков аминогруппа N-концевого остатка после трансляции подвергается N-ацилированию. С-концевыс остатки тоже иногда модифицируются.
Удаление сигнальной последовательности.
Как мы увидим в разд. 27.3, у некоторых белков N- концевая последовательность из 15-30 остатков нужна для доставки белка к месту его назначения в клетке. Такие сигнальные последовательности удаляются специфическими пептидазами.
Модификация некоторых аминокислот.
Гидроксильные группы некоторых остатков Ser, Thr и Туr в некоторых белках подвергаются ферментативному фосфорилированию под действием АТР (рис. 27-34, я); фосфатные группы сообщают полипептидам отрицательный заряд. Функциональное значение этих модификаций в разных белках различно. Например, молочный белок казеин содержит много фосфатных групп, которые связывают ионы Cа2+. Кальций, фосфат и аминокислоты — три важных компонента питания новорожденных. И, как мы видели на многочисленных примерах, циклы фосфорилирования - дефосфорилирования регулируют активность многих ферментов и регуляторных белков.
Рис. 27-34. Некоторые модифицированные аминокислотные остатки, а — фосфорилированные аминокислоты. б — карбоксилированная аминокислота, в — некоторые метилированные аминокислоты.
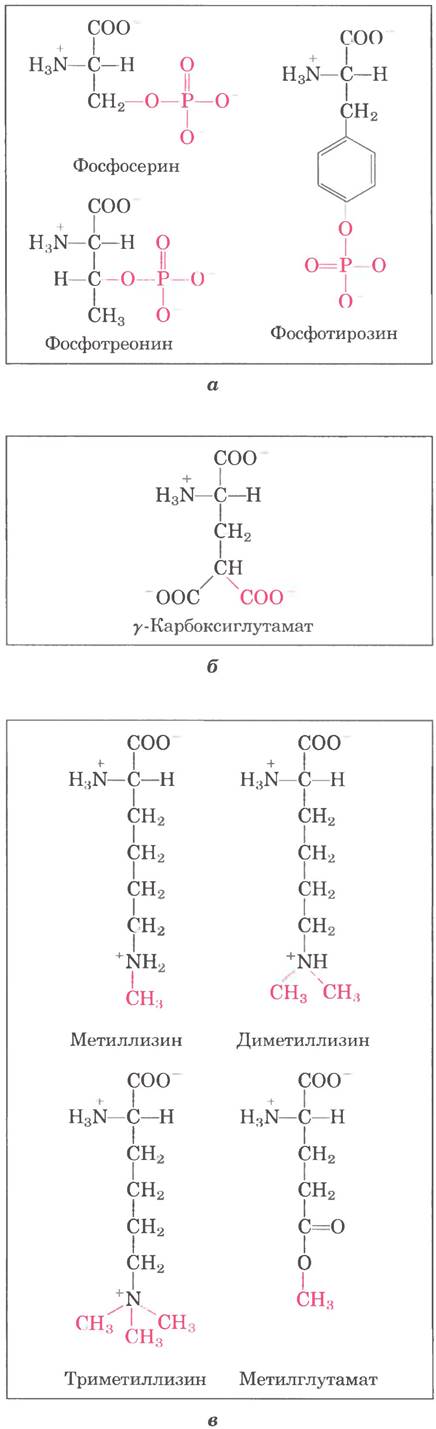
К остаткам Glu некоторых белков могут присоединяться дополнительные карбоксильные группы. Например, белок системы свертывания крови протромбин в N-концевой области содержит несколько остатков у-карбоксиглутамата (рис. 27-34, б), присоединенных витамин-К- зависимым ферментом. Эти карбоксильные группы связывают ионы Са2+, необходимые для инициации механизма свертывания.
В некоторых мышечных белках и в цитохроме г присутствуют остатки монометил- и ди- метиллизина (рис. 27-34, в). У большинства видов организмов белок кальмодулин содержит один остаток триметиллизина в определенной позиции полипептидной цепи. В других белках карбоксильные группы некоторых остатков Glu подвергаются метилированию, что нейтрализует отрицательный заряд белков.
Присоединение углеводных боковых цепей.
Углеводные боковые цепи гликопротеинов присоединяются ковалентной связью вовремя или после синтеза полипептида. В некоторых гликопротеинах углеводные боковые цепи присоединяются ферментативным путем к остаткам Asn (N-связанные олигосахариды), у других - к остаткам Ser или Thr (О-связанные олигосахариды) (см. рис. 7-29 в т. 1). Многие внеклеточные белки, а также протеогликаны мембран клеток слизистых оболочек, содержат олигосахаридные боковые цени (см. рис. 7-27).
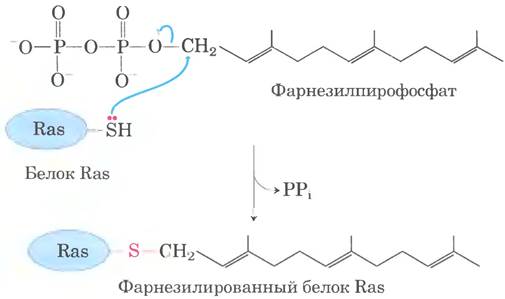
Присоединение изопренильных групп.
Некоторые эукариотические белки модифицируются путем присоединения изопренильных групп (производные изопрена). Между изопренильпой группой и остатком Cys в белке образуется тиоэфирная связь (см. рис. 11-14 в г. 1). Изопренильные группы образуются из пирофосфорилированных интермедиатов биосинтеза холестерина (см. рис. 21-35 в т. 2), таких как фарнезилпирофосфат (рис. 27-35). К таким белкам относятся Ras-белки - продукты онкогенов и протоонкогенов ras, и G-белки (и те, и другие обсуждаются в гл. 12 вт. 1), а также ламины — белки хромосомного остова. Изопренильная группа помогает заякорить белок на мембране. Трансформирующая (канцерогенная) активность онкогена ras исчезает при дефекте изопренилирования белка Ras; это открытие стимулировало поиск ингибиторов для применения в противоопухолевой химиотерапии.
Рис. 27-35. Фарнезилирование остатка Cys. Тиоэфирная связь выделена красным цветом. Белок Ras — продукт онкогена ras.
Присоединение простетических групп.
Активность многих белков бактерий и эукариот зависит от наличия присоединенных ковалентной связью простетических групп. Два характерных примера - молекула биотина в ацетил-СоА-карбоксилазе и гем в гемоглобине или цитохроме с.
Протеолитический процессинг.
Многие белки синтезируются в виде крупных неактивных предшественников, которые в результате протеолиза превращаются в более короткие активные формы. К таким белкам относятся проинсулин, некоторые вирусные белки и протеазы, включая химотрипсиноген и трипсиноген (см. рис. 6-38 в т. 1).
Образование дисульфидных мостиков.
В некоторых белках, находящихся в нативной конформации, образуются внутримолекулярные или межмолекулярные дисульфидные мостики между остатками Суs. У эукариот дисульфидные связи часто встречаются в белках, выступающих за пределы клетки. Сульфидные мостики защищают нативную конформацию белка от денатурации во внеклеточной среде, которая может существенно отличаться от внутриклеточной среды и обычно является окислительной.
Многие антибиотики и токсины ингибируют синтез белка
Синтез белка — самый важный клеточный процесс и мишень для действия многих природных антибиотиков и токсинов. За небольшими исключениями, антибиотики ингибируют синтез белков у бактерий. Несмотря на совсем незначительные различия путей белкового синтеза у бактерий и эукариот, только для клеток эукариот обсуждаемые ниже соединения неопасны, т. е. не оказывают токсического эффекта. Удивительно то, что синтезируемые одними микроорганизмами соединения оказываются токсичными для других микроорганизмов. Биосинтез белка на любой стадии может специфически подавляться каким-то антибиотиком, поэтому антибиотики могут предоставить нам ценный инструмент для изучения биосинтеза белка.
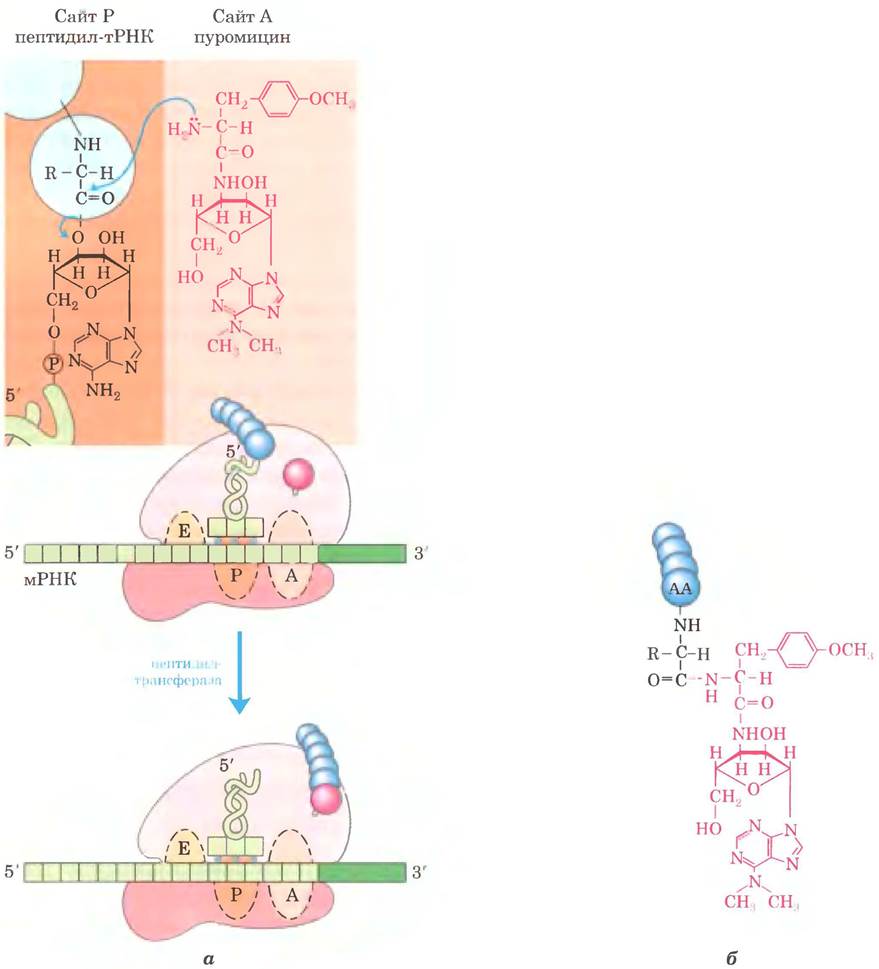
Пуромицин, продуцируемый актиномицетом Streptomyces alboniger, — один из самых из ученных антибиотиков-ингибиторов. Его структура очень напоминает 3'-конец аминоацил- тРНК, и поэтому он способен связываться на сайте А рибосомы и участвовать в образовании пептидной связи, превращаясь в пептидилпуромицин (рис. 27-36). Но так как пуромицин напоминает только 3'-конец тРНК, он не может участвовать в транслокации и выходит из рибосомы вскоре после связывания с С-концом пептида. Это приводит к преждевременному прекращению синтеза белка.
Рис. 27-36. Нарушение образования пептидной связи в присутствии пуромицина. а — структура антибиотика пуромицина напоминает структуру аминоацильного конца нагруженной тРНК, и поэтому он может связываться с А-сайтом рибосомы и принимать участие в образовании пептидной связи (см. рис. 27-13, г). Но продукт этой реакции не перемещается к сайту Р, а покидает рибосому, вызывая преждевременный обрыв цепи, б — пептидилпуромицин.
Тетрациклины ингибируют синтез белка в клетках бактерий, поскольку блокируют А-сайт рибосомы и препятствуют связыванию молекул аминоацил-тРНК. Хлорамфеникол ингибирует синтез белка рибосомами бактерий (а также митохондрий и хлоропластов), подавляя пептидилтрансферазную активность; он не влияет на синтез белка в цитоплазме эукариот. Циклогексимид блокирует пептидилтрансферазу эукариотических 805-рибосом, но не бактериальных 70S-рибосом (а также рибосом митохондрий и хлоропластов). Трисахарид стрептомицин в низкой концентрации нарушает считывание генетического кода (у бактерий), в более высокой концентрации подавляет инициацию.
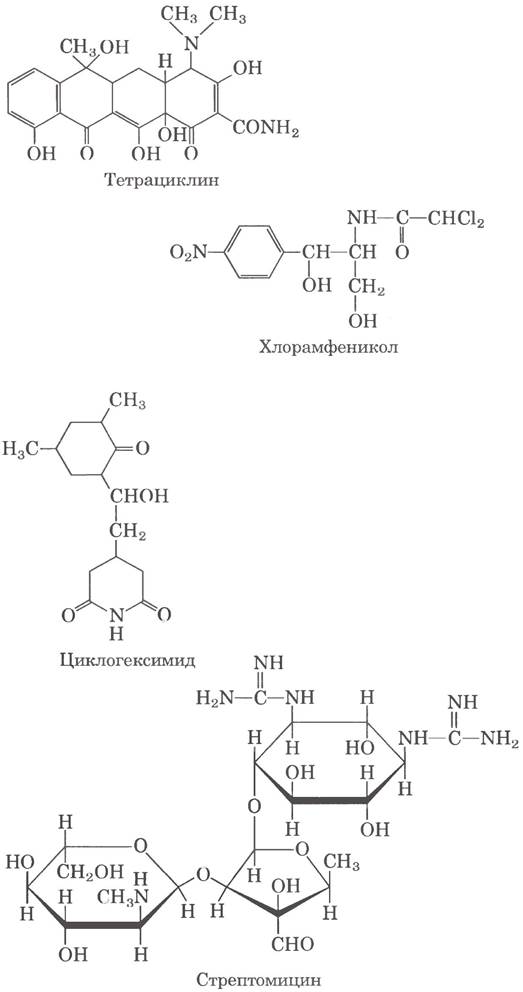
Некоторые ингибиторы синтеза белка токсичны для человека и других млекопитающих. Дифтерийный токсин (Мr = 58 330) катализирует ADP-рибозилирование остатка дифтамида (модифицированного гистидина) эукариотического фактора элонгации eEF2, тем самым его инактивируя. Рицин (Мr = 29 895) - очень токсичный белок из клещевины, он инактивирует 605-субъединицу эукариотических рибосом путем депуринизации специфического аденозина в 23S рРНК.
Краткое содержание раздела 27.2 Синтез белков
■ Синтез белков происходит на рибосомах, которые состоят из белка и рРНК. Бактерии содержат 705-рибосомы. состоящие из большой (50S) и малой (30S) субъединиц. Эукариотические рибосомы намного крупнее (80S) и содержат больше белков.
■ Транспортные РНК (тРНК) содержат от 73 до 93 нуклеотидных остатков, среди которых есть остатки с модифицированными основаниями. Каждая тРНК имеет аминокислотное плечо с концевой последовательностью ССА (3’), к которой в результате реакции этерификации присоединяется аминокислота, антикодоновое плечо, плечо ТΨС и плечо D; некоторые тРНК имеют пятое плечо. Антикодон отвечает за специфическое взаимодействие между аминоацил-тРНК и комплементарным кодоном мРНК.
■ Рост полипептидов на рибосомах начинается с N-концевой аминокислоты и происходит путем постепенного добавления новых остатков к С-концу.
■ Синтез белка происходит за пять стадий.
1. Аминокислоты активируются специфическими аминоацил-тРНК-синтетазами в цитоплазме. Эти ферменты катализируют образование аминоацил-тРНК с одновременным расщеплением АТР до АМР и PPi. Точность синтеза белка в целом зависит от точности этой реакции, и некоторые из этих
ферментов обладают независимыми центрами корректирующей активности.
2. Во всех белках бактерий инициаторная аминоацил-тРНК — N-формилметионил- тРНКfМеt. Инициация синтеза белка заключается в формировании комплекса между 30S-субъединицей рибосомы, мРНК, GTP, fMet-TPHKfMet, тремя факторами инициации и 50S-субъединицей; GTP расщепляется до GDP и Pi.
3. В процессе элонгации для связывания следующей аминоацил-тРНК на сайте А в рибосоме требуются GTP и факторы элонгации. В первой пептидилтрансферазной реакции остаток fMet переносится на аминогруппу следующей аминоацил-тРНК. Далее при перемещении рибосомы вдоль молекулы мРНК происходит перенос дипептидил-тРНК с сайта A нa сайт Р, что сопровождается гидролизом молекулы GTP. Деацилированные на сайте Е молекулы тРНК покидают рибосому.
4. После многократного повторения циклов элонгации синтез полипептида прекращается при участии факторов высвобождения. Для образования каждой пептидной связи требуется по меньшей мере четыре высокоэнергетических фосфатных эквивалента (в виде АТР и GTP); такие энергетические затраты необходимы для обеспечения высокой точности трансляции.
5. Синтезированные полипептиды переходят в активную трехмерную конформацию. Многие белки после синтеза подвергаются пост- трансляционым модификациям.
■ Многие хорошо изученные антибиотики и токсины ингибируют некоторые стадии синтеза белка.