ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 3. ПУТИ ПЕРЕДАЧИ ИНФОРМАЦИИ - 2017
ЧАСТЬ III. ПУТИ ПЕРЕДАЧИ ИНФОРМАЦИИ
27. МЕТАБОЛИЗМ БЕЛКА
27.3. Транспорт и расщепление белков
Эукариотическая клетка состоит из отделов и органелл, которые выполняют специфические функции, требующие разных наборов белков и ферментов. Эти белки (за исключением тех, которые образуются в митохондриях и пластидах) синтезируются на рибосомах в цитоплазме, откуда каким-то образом они должны попадать к местам своего целевого назначения.
Только теперь мы начинаем понимать этот сложный и удивительный процесс. Первые этапы метаболизма белков, предназначенных для секреции, интеграции в плазматическую мембрану или заключения в лизосомы, обычно происходят в эндоплазматическом ретикулуме. Белки митохондрий, хлоропластов и ядер используют три разных транспортных пути, а цитозольные белки просто остаются там, где были синтезированы.
Очень важную роль при доставке белков к месту их постоянной локализации играет короткая последовательность аминокислот, называемая сигнальной последовательностью. Ее функция была впервые определена Гюнтером Блобелом с коллегами в 1970 г. Сигнальная последовательность направляет белок к месту его локализации в клетке, и у многих белков она удаляется во время транспортировки или после того, как белок достигает места назначения. В белках, предназначенных для транспортировки в митохондрии, хлоропласты или эндоплазматическую сеть, сигнальная последовательность находится на N-конце только что синтезированного полипептида. Во многих случаях способность конкретной сигнальной последовательности доставлять белок была подтверждена экспериментально путем слияния сигнальной последовательности одного белка с другим белком. В результате сигнальная последовательность направляла второй белок к месту обычной локализации первого белка. Избирательное расщепление белков, которые больше не нужны клетке, тоже направляется набором молекулярных сигналов, заложенных в структуре каждого белка.

В этом заключительном разделе мы рассмотрим процессы транспорта и расщепления белков, уделяя особое внимание молекулярным сигналам и механизмам регуляции, которые играют столь важную роль в метаболизме клетки (если не оговаривается особо, речь пойдет об эукариотических клетках).
Посттрансляционная модификация многих эукариотических белков начинается в эндоплазматическом ретикулуме
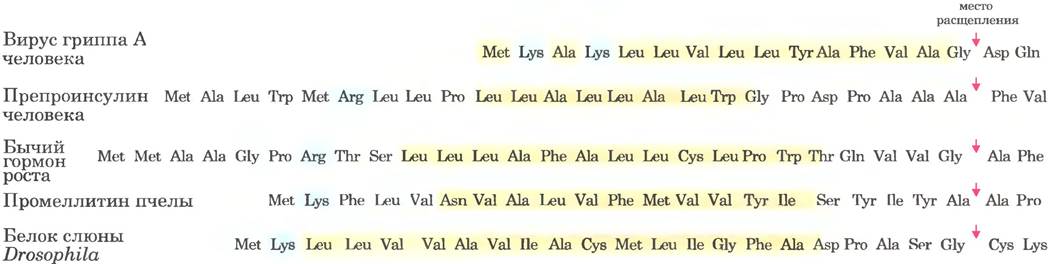
Вероятно, лучше всего изучены системы транспорта белков, которые начинаются в эндоплазматическом ретикулуме (ЭР). Большинство лизосомных, мембранных или секретируемых белков имеют М-концевую сигнальную последовательность (рис. 27-37), которая маркирует их для переноса в просвет ЭР; таких последовательностей обнаружены сотни. На С-конце сигнальной последовательности находится сайт расщепления протеазой, которая отделяет сигнальную последовательность от остального белка после того, как белок попадает в ЭР. Сигнальные последовательности составляют в длину от 13 до 36 аминокислотных остатков и имеют общие свойства: (1) они содержат 10-15 гидрофобных аминокислотных остатков; (2) один или несколько положительно заряженных остатков, обычно между N-концом и гидрофобной последовательностью; и (3) короткую сравнительно полярную последовательность на С-конце, обычно содержащую аминокислотные остатки
с короткими боковыми цепями (особенно Ala), вблизи сайта расщепления.
Рис. 27-37. N-концевые сигнальные последовательности некоторых эукариотических белков, направляющие их в ЭР. Гидрофобному участку (выделен желтым цветом) предшествует один или несколько остатков основных аминокислот (синие). Обратите внимание на наличие полярных остатков с короткими боковыми цепями, которые предшествуют сайтам расщепления (слева от сайтов расщепления, показанных красными стрелками).
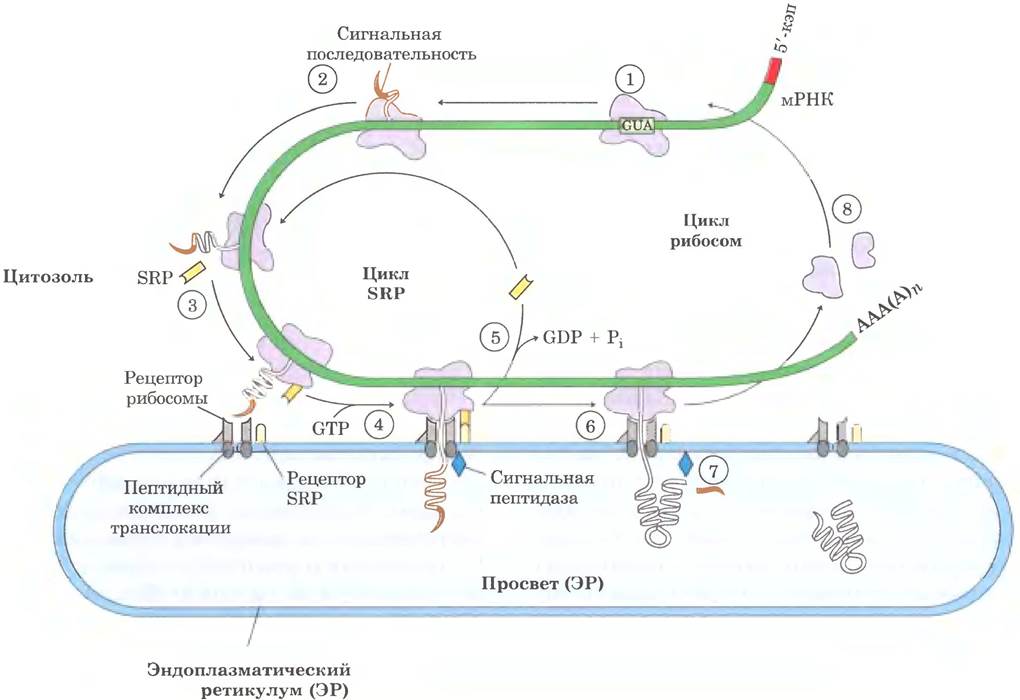
Джордж Паладе впервые показал, что белки с такими сигнальными последовательностями синтезируются на рибосомах, связанных с ЭР. Сигнальная последовательность помогает направить рибосому к ЭР (стадий ① -⑧ на рис. 27-38). ① Подготовка к доставке к месту назначения начинается на стадии инициации синтеза белка на свободных рибосомах. ② Сигнальная последовательность образуется в начале синтеза, поскольку она расположена на N-конце, который синтезируется первым. ③ Когда сигнальная последовательность выходит из рибосомы, она связана с ней крупной сигнал-распознающсй частицей (SRP от англ. signal recognition particle); затем SRP связывается с GTP и останавливает элонгацию полипептида, когда его длина достигает примерно 70 аминокислот, а сигнальная последовательность уже полностью вышла за пределы рибосомы. ④ Теперь GТР-связанный SRP направляет рибосому (все еще связанную с мРНК) и незаконченный полипептид к рецепторам GТР- связанного SRР на цитоплазматической поверхности ЭР; образованный полипептид доставляется к комплексу транслокации белка в ЭР, который может непосредственно взаимодействовать с рибосомой. ⑤ SRР отделяется от рибосомы, что сопровождается гидролизом GТР как в SRР, так и в рецепторе SRР. ⑥ Элонгация полипептида возобновляется при помощи АТР-зависимого комплекса транслокации, направляющего растущий полипептид в просвет ЭР до тех пор, пока не синтезируется весь белок. ⑦ Сигнальная последовательность удаляется сигнальной пептидазой в просвете ЭР; ⑧ рибосома диссоциирует и снова готова к работе.

Рис. 27-38. Доставка эукариотических белков с сигнальными последовательностями в эндоплазматический ретикулум. Этот процесс включает цикл SRP транслокацию и расщепление вновь образованного полипептида (см. текст). Комплекс SRP имеет форму палочки; он содержит РНК из 300 нуклеотидов (7 SL-РНК) и шесть разных белков (общая масса 325 000). Одна белковая субъединица SRP связывается непосредственно с сигнальной последовательностью и останавливает элонгацию, блокируя доступ молекул аминоацил-тРНК и ингибируя пептидилтрансферазу. Другая белковая субъединица связывает и гидролизирует GТР. Гетеродимерный рецептор SRP состоит из субъединиц α (Мr = 69 000) и β (Мr = 30 000), каждая связывает и гидролизирует большое количество молекул GТР.
Гликозилирование играет ключевую роль в транспорте белка
В просвете ЭР вновь синтезированные белки модифицируются различным образом. После удаления сигнальных последовательностей происходит укладка полипептидных цепей с возможным образованием дисульфидных связей, а многие белки гликозилируются с образованием гликопротеинов. Во многих гликопротеинах связь с соответствующими олигосахаридами осуществляется через остатки Аsn. Такие N-связанные олигосахариды достаточно разнообразны (гл. 7 в т. 1), но первая стадия гликозилирования белка всегда одинаковая. Сначала синтезируется олигосахаридное ядро из 14 остатков, которое затем переносится от донорной молекулы долихолфосфата на определенные остатки Аsn в белке (рис. 27-39).
Рис. 27-39. Синтез олигосахаридного фрагмента гликопротеинов. Олигосахарид синтезируется путем последовательного присоединения моносахаридных единиц. ①, ② Первые стадии происходят на цитоплазматической поверхности ЭР. ③ В результате транслокации незавершенный олигосахарид переносится через мембрану (механизм не показан), и ④ окончание синтеза происходит в просвете ЭР. Дополнительные остатки маннозы и глюкозы для растущего олигосахарида поставляют производные долихолфосфата. На первой стадии образования N-гликопротеина ⑤, ⑥ олигосахарид переносится с долихолфосфата на остаток Аsn белка в просвете ЭР. В дальнейшем олигосахаридная часть в зависимости от конкретного белка по-разному модифицируется в ЭР или в комплексе Гольджи. Однако пять сахарных остатков, изображенные на бежевом фоне (после стадии ⑦), сохраняются в структуре всех N-связанных олигосахаридов. ⑧ Высвободившийся долихолпирофосфат вновь переносится через мембрану, так что пирофосфат оказывается на цитоплазматической поверхности ЭР, где ⑨ гидролизуется с регенерацией долихолфосфата.
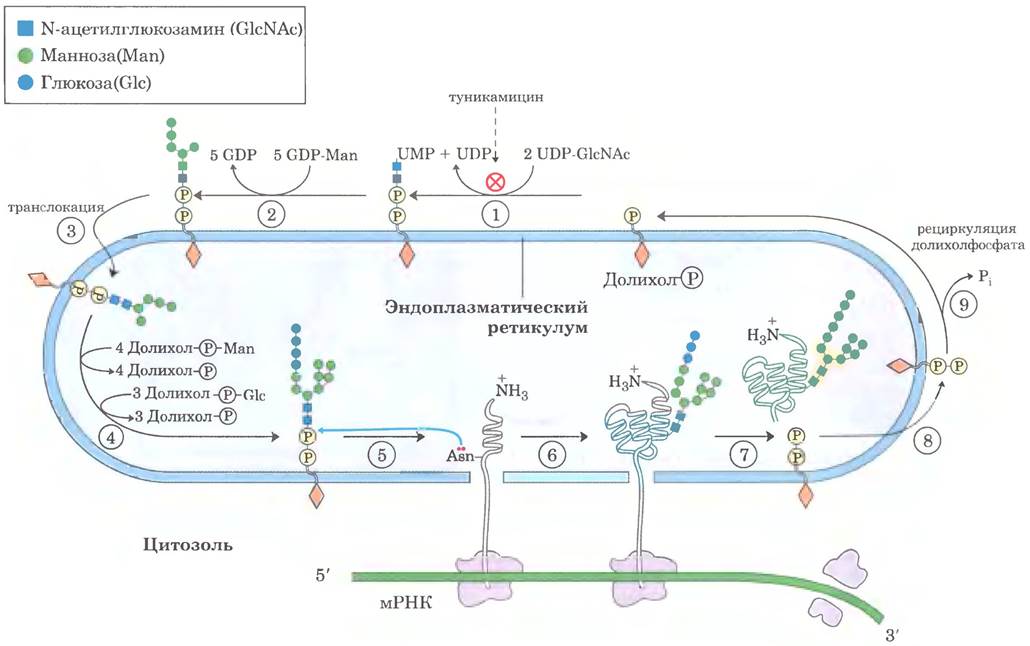
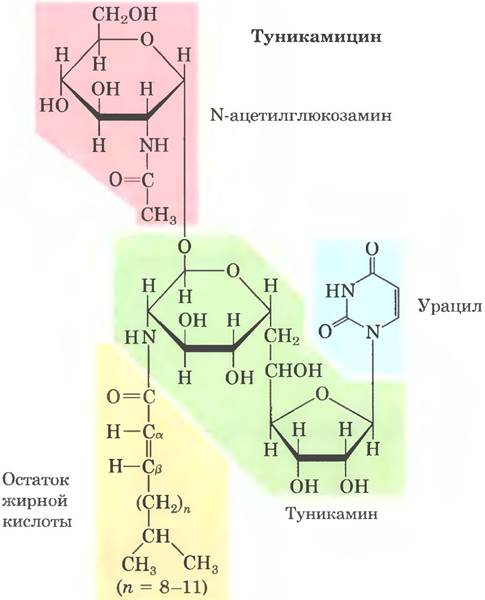
Трансфераза находится на люминальной поверхности ЭР и поэтому не может катализировать гликозилирование белков в цитоплазме. После переноса через мембрану олигосахариды в разных белках укорачиваются и модифицируются по-разному, но пентасахаридное ядро от исходного олигосахарида из 14 остатков сохраняется во всех N-олигосахаридах. Некоторые антибиотики блокируют одну или несколько стадий этого процесса, что позволило исследовать стадии гликозилирования белков. Лучше других изучен антибиотик туникамицин, который имитирует структуру UDР-N-ацетилглюкозамина и блокирует первую стадию (рис. 27-39, стадия ①). Некоторые белки в ЭР подвергаются О-гликозилированию, однако чаще О-гликозилирование осуществляется в комплексе Гольджи или в цитоплазме (для белков, которые не попадают в ЭР).
Далее модифицированные белки могут транспортироваться в различные клеточные отделы. Из ЭР в комплекс Гольджи белки поступают в транспортных пузырьках (везикулах) (рис. 27-40). В комплексе Гольлжи олигосахариды присоединяются к некоторым белкам О-гликозидной связью, а N-связанные олигосахариды подвергаются дальнейшим модификациям. С помощью механизма, суть которого еще полностью не установлена, аппарат 1ольджи сортирует белки и направляет их к месту назначения. Сортировка белков, предназначенных для секреции, и белков для плазматической мембраны или лизосом основана на структурных особенностях, которые не связаны с сигнальными последовательностями, поскольку последние удаляются в просвете ЭР.
Рис. 27-40. Транспорт белков в лизосомы, плазматическую мембрану или во внеклеточное пространство. Из ЭР белки в транспортных везикулах направляются к цис- стороне комплекса Гольджи. Сортировка преимущественно происходит на транс-стороне комплекса Гольджи.
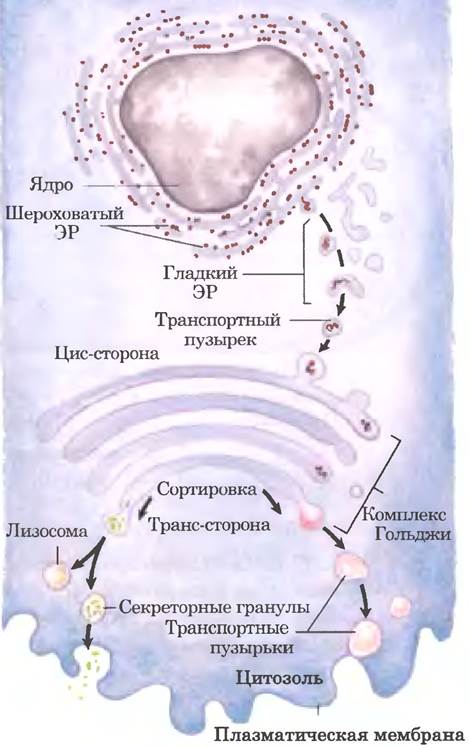
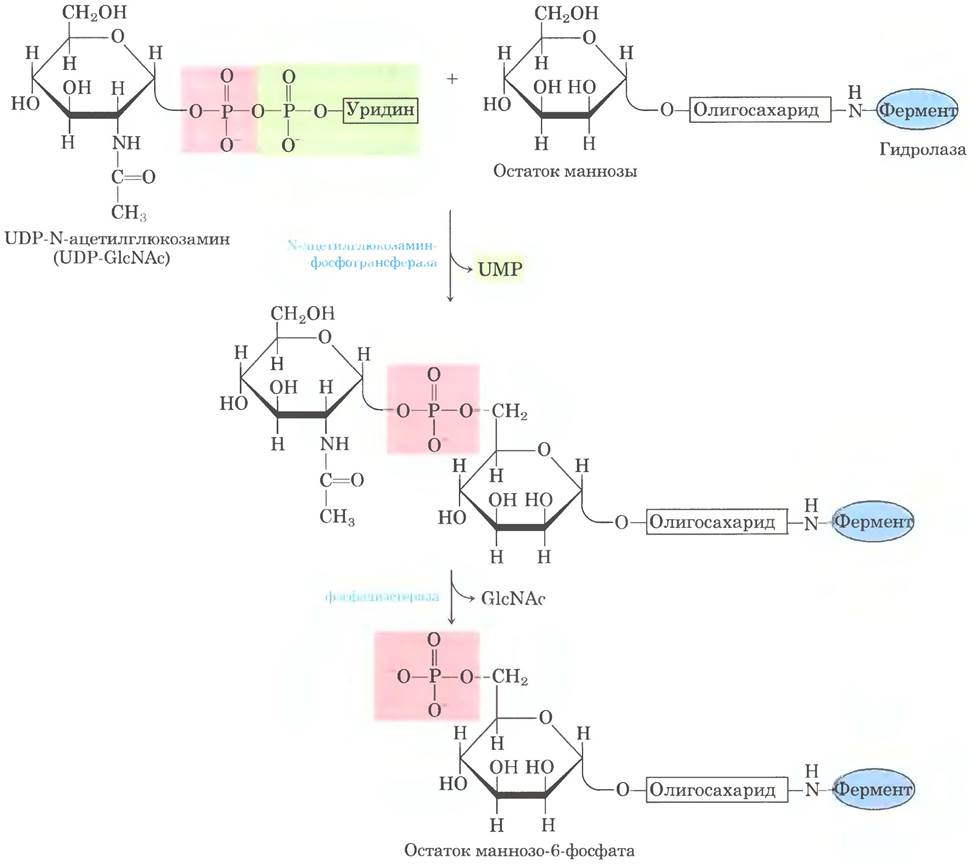
Лучше всего изучен процесс сортировки гидролаз, направляющихся в лизосомы. При попадании гидролазы в комплекс Гольджи некий еще не до конца исследованный элемент ее трехмерной структуры (иногда называемый сигнальным бугорком) распознается фосфотрансферазой, которая фосфорилирует определенные остатки маннозы в олигосахаридной части гликопротеина (рис. 27-41). Наличие одного или нескольких остатков маннозо-6-фосфата в олигосахаридной части гидролазы является сигналом для ее отправки в лизосому. Рецепторный белок в мембране комплекса Гольджи распознает маннозо-6-фосфат и связывает помеченную таким образом гидролазу. Везикулы, содержащие эти комплексы рецептора и гидролазы, отпочковываются от транс-стороны Гольджи и направляются к сортирующим везикулам. Здесь в условиях низкого значения pH и под действием фосфатазы, удаляющей фосфатные группы с остатков маннозо-6-фосфата, комплекс рецептора и гидролазы распадается. Затем рецептор возвращается к комплексу Гольджи, а везикулы с гидролазами отпочковываются от сортирующих везикул и направляются к лизосомам. В клетках, обработанных туникамицином (рис. 27-39. этан ①), гидролазы, которые должны оказаться в лизосомах, вместо этого секретируются, что подтверждает ключевую роль N-связанной олигосахаридной группы в доставке этих ферментов в лизосомы.
Рис. 27-41. Фосфорилирование остатков маннозы в ферментах, направляемых в лизосомы. N-ацетилглюкозаминфосфотрансфераза распознает некоторые неизвестные пока особенности структуры гидролаз, направляющихся в лизосомы.
Доставка белков в митохондрии и хлоропласты также связана с наличием в этих белках N-концевых сигнальных последовательностей. В митохондриях и хлоропластах есть своя ДНК, но большинство их белков закодировано в ядре и после синтеза доставляется в соответствующую органеллу. Однако в отличие от других путей направленного транспорта подготовка к транспортировке белков в митохондрии и хлоропласты начинается только после того, как белок-предшественник полностью синтезирован и отделен от рибосомы. Предшественники белков, предназначенных для митохондрий и хлоропластов, связываются с цитоплазматическими шаперонами и доставляются к рецепторам на внешней поверхности органеллы. Затем с помощью специализированных систем транслокации белок транспортируется к своему месту в органелле, после чего сигнальная последовательность удаляется.
Сигнальные последовательности ядерных белков не отщепляются
Между ядром и цитоплазмой макромолекулы должны проходить через ядерные поры. Молекулы РНК, синтезированные в ядре, переносятся в цитоплазму. Рибосомные белки, синтезированные на рибосомах в цитоплазме, переносятся в ядро и собираются в 60S- и 40S-субъединицы рибосом в ядрышке; затем собранные субъединицы экспортируются назад в цитоплазму. Разнообразные ядерные белки (РНК- и ДНК-полимеразы, гистоны, топоизомеразы, белки-регуляторы экспрессии генов и т. п.) синтезируются в цитоплазме и переносятся в ядро. Этот путь управляется сложной системой молекулярных сигналов и транспортных белков, действие которых постепенно стало более понятно.
У большинства многоклеточных эукариот ядерная оболочка разрывается при каждом клеточном делении, а по окончании деления восстанавливается, при этом рассеянные в цитоплазме ядерные белки снова импортируются в ядро. Ввиду необходимости возвращения в ядро сигнальная последовательность, которая направляет белок в ядро, сигнал ядерной локализации (NLS от англ. nuclear localization sequence), не удаляется после того, как белок достигает своего места назначения. В отличие от других сигнальных последовательностей, NLS может находиться почти в любом месте первичной последовательности белка. Последовательности NLS могут существенно различаться, но многие состоят из четырех-восьми аминокислотных остатков и содержат последовательность из нескольких остатков основных аминокислот (Arg или Lys).
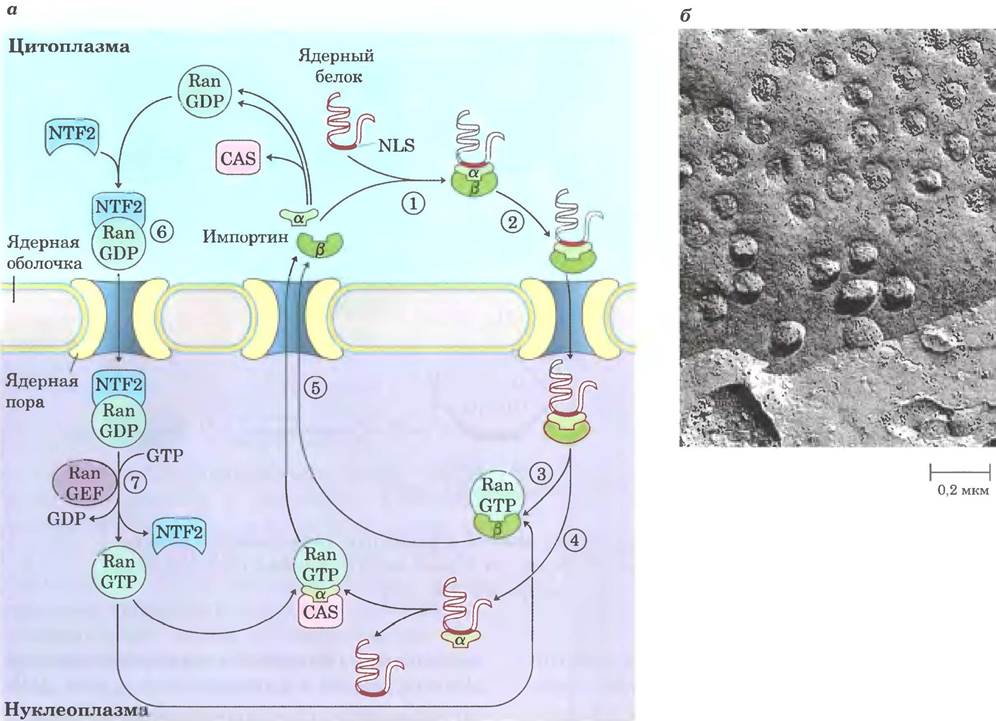
Транспорт в ядро опосредован несколькими белками, курсирующими между цитоплазмой и ядром (рис. 27-42), включая импортины α и β и небольшую GТРазу Ran (Ras-related nuclear protein). Гетеродимер импортииов α и β действует в качестве растворимого рецептора транспортируемых в ядро белков, причем α-субъединица служит для связывания NLS-содержащих белков в цитоплазме. Комплекс NLS-содержащего белка и импортина подходит к ядерной поре и проходит через нее, причем это сопровождается затратой энергии. В ядре импортин β связывается с GТРазой Ran и высвобождает доставленный белок. Импортин а связывается с Ran и CAS (cellular apoptosis susceptibility protein) и отщепляется от NLS-со-держащего белка. Затем импортины α и β в комплексах с Ran и CAS экспортируются из ядра. В цитоплазме белок Ran гидролизует GTP, высвобождая импортины, которые могут начинать новый цикл переноса. Сам Ran также переносится обратно в ядро за счет связывания Ran-GDP с ядерным транспортным фактором 2 (NTF2). В ядре связанный с Ran GDP под действием фактора обмена гуанозиновых нуклеотидов RanGEF замещается па GTP (см. доп. 12-2 в т. 1).
Рис. 27-42. Транспорт ядерных белков, а — ① Белок с сигналом ядерной локализации (NLS) связывается комплексом импортинов α и β. ② Образующийся комплекс связывается с ядерной порой и переносится в ядро. ③ В ядре отщеплению импортина β способствует связывание Ran-GTP. ④ Импортин α связывается с Ran-GTP и CAS (cellular apoptosis susceptibility protein), высвобождая ядерный белок. ⑤ Импортины α и β и CAS выводятся из ядра и готовы к новому циклу переноса. Выход в цитоплазму сопровождается гидролизом связанного с Ran GTP. ⑥ Ran-GDP связывается с NTF2 и возвращается в ядро. ⑦ В ядре RanGEF облегчает обмен GDP на GTP, и Ran-GTP готов к переносу следующего комплекса импортинов с NLS- содержащим белком. б — микрофотография поверхности ядерной оболочки, полученная методом сканирующей электронной микроскопии; видны многочисленные ядерные поры.
Бактерии тоже используют сигнальные последовательности для транспорта белков
У бактерий белки направляются во внутренние или внешние мембраны, в периплазматическое пространство или во внеклеточную среду. Бактериальные белки имеют N-концевые сигнальные последовательности (рис. 27-43), во многом напоминающие аналогичные последовательности эукариотических белков, направляющихся в ЭР, митохондрии и хлоропласты.
Рис. 27-43. Сигнальные последовательности, направляющие бактериальные белки в разные места локализации. Голубым цветом выделены основные аминокислоты вблизи N-конца, желтым цветом обозначены гидрофобные аминокислоты в центральной части сигнальных пептидов. Сайты расщепления сигнальных последовательностей показаны красными стрелками. Обратите внимание, что белки оболочки и ДНК фага fd собираются в фаговые частицы на внутренней мембране бактериальной клетки (см. рис. 1-6 в т. 1). ОmрА — белок внешней мембраны; LаmВ — рецепторный белок на поверхности клетки бактериофага λ.

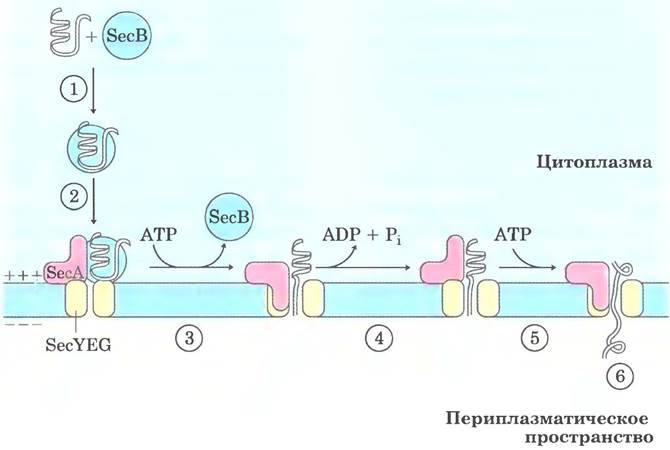
В большинстве случаев экспорт белков из клеток Е. coli осуществляется по механизму, изображенному на рис. 27-44. После трансляции предназначенный для экспорта белок сворачивается очень медленно, поскольку этому препятствует N-концевая сигнальная последовательность. Растворимый шаперон SecB связывается с сигнальной последовательностью или с другими участками частично свернутого белка. В таком виде белок доставляется к белку SecA внутренней мембраны. Белок SecA служит одновременно и рецептором, и трансло- цирующей АТРазой. Освободившись от SecB, связанный с SecA белок включается в комплекс трапслокации в мембране, состоящий из SecY. SecE и SecG, и проходит мембрану через комплекс SecYEG, длина которого составляет примерно 20 аминокислотных остатков. На каждой
стадии происходит гидролиз АТР, катализируемый SecA.
Рис. 27-44. Модель экспорта белка у бактерий. ① После завершения трансляции полипептид связывается в цитоплазме с шапероном SecB, который ② доставляет его к белку SecA, связанному с комплексом транслокации (SecYEG) в мембране бактериальной клетки. ③ SecB высвобождается, SecA встраивается в мембрану, проталкивая через комплекс транслокации примерно 20 аминокислотных остатков белка. ④ Гидролиз АТР белком SecA обеспечивает энергию для конформационных изменений, которые позволяют SecA высвободиться из мембраны, оставив полипептид в периплазматическом пространстве. ⑤ SecA связывает другую молекулу АТР и проталкивает через комплекс транслокации следующий фрагмент белка из 20 аминокислотных остатков. Стадии ④ и ⑤ повторяются до тех пор, пока ⑥ весь белок не пройдет через мембрану и не высвободится в периплазму. Электрохимический потенциал на мембране (обозначенный знаками «+» и «-») является дополнительной движущей силой, способствующей транслокации белка.
Таким образом, экспорт белка через мембрану опосредует белок SecA, локализованный на внутренней поверхности мембраны, а не белок периплазматического пространства. Этот механизм может быть обусловлен просто тем, что транслоцирующая АТРаза находится там, где есть АТР. Трансмембранный электрохимический потенциал также может способствовать транслокации белка (в этом вопросе еще много неясного).
Большинство бактериальных белков покидает клетку именно этим путем, но известны и такие белки, которые экспортируются по другому механизму, где принимают участие сигнальные последовательности и рецепторные белки, гомологичные компонентам белка SRP и его рецепторам у эукариот (рис. 27-38).
Белки проникают в клетки путем опосредованного рецепторами эндоцитоза
Некоторые белки поступают в клетки из окружающей среды; у эукариот это липопротеины низкой плотности (ЛПНП), переносчик железа трансферрин, пептидные гормоны и циркулирующие белки, направляющиеся на расщепление. Существует несколько механизмов проникновения белков в клетку (рис. 27-45). В одном из них белки связываются с рецепторами в углублениях мембраны, называемых окаймленными пузырьками, где содержится значительно больше рецепторов эндоцитоза, чем других белков клеточной поверхности. Эти углубления со стороны цитоплазмы покрыты сеткой из белка клатрина, который формирует замкнутые многогранные структуры (рис. 27-46). Клатриновая сеть расширяется по мере увеличения числа рецепторов, связанных с белками-мишенями, пока полностью окруженная мембраной везикула не отпочковывается от плазматической мембраны с помощью крупной GТРазы динамина и выходит в цитоплазму. Клатрин быстро удаляется ферментативным путем, и везикула сливается с эндосомой. АТРазная активность в мембранах эндосом понижает уровень pH, что облегчает диссоциацию комплексов рецепторов с белками-мишенями. В похожем процессе кавеолин вызывает инвагинацию участков мембраны, содержащих липидные рафты, связанные с определенными типами рецепторов (см. рис. 11-21 в т. 1). Затем образующиеся везикулы сливаются с содержащими кавеолин внутренними структурами — кавеосомами, в которых поглощенные вещества сортируются и перенаправляются к другим участкам клетки, а кавеолины готовятся к возвращению к поверхности мембраны. Кроме того, существуют пути, не связанные с действием клатрина или кавеолина; в каких-то из них участвует динамин, а в каких-то нет.
Рис. 27-45. Пути эндоцитоза в эукариотических клетках. В путях, зависимых от клатрина или кавеолина, везикулы отделяются от плазматической мембраны с помощью GТРазы динамина. В других путях не участвуют ни кавеолин, ни клатрин, а динамин может быть задействован или нет.
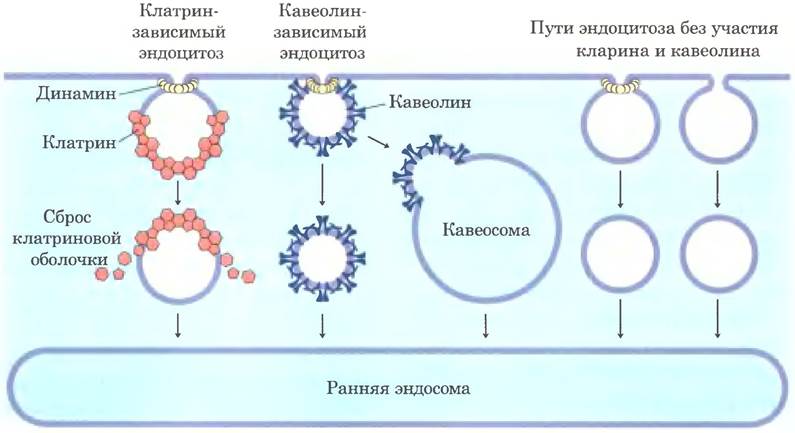
Далее импортируемые белки и их рецепторы претерпевают различные превращения, и их дальнейшая судьба зависит от типа клеток и типа белков. Трансферрин и его рецептор в конечном итоге используются вновь. Некоторые гормоны, факторы роста и иммунные комплексы после индукции соответствующего клеточного ответа разрушаются вместе со своими рецепторами. Липопротеины низкой плотности разрушаются после того, как связанный холестерин доставляется к месту назначения, но рецепторы ЛПНП используются многократно (см. рис. 21-42 в т. 2).
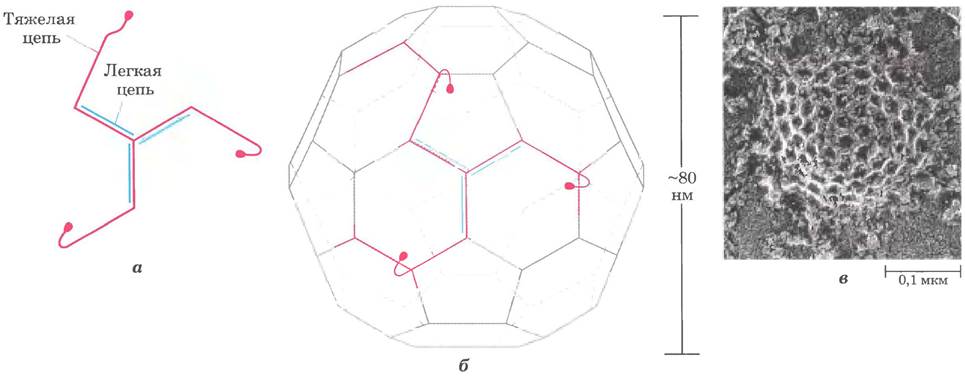
Рис. 27-46. Клатрин. а — три легкие (L) цепи (Мr = 35 000) и три тяжелые (Н) цепи (Мr = 180 000) образуют единицу клатрина (HL)3, имеющую трехлучевую структуру, называемую трискелионом. б — трискелионы собраны в многогранную сетчатую структуру. в — электронная микрофотография окаймленного пузырька на цитоплазматической поверхности плазматической мембраны фибробласта.
Расщепление белков во всех клетках осуществляется специализированными системами
Расщепление белков препятствует накоплению аномальных или ненужных белков и позволяет реутилизировать аминокислоты. Время полу- жизни эукариотических белков составляет от 30 секунд до многих суток. Оборот большинства белков происходит достаточно быстро по сравнению с продолжительностью жизни клетки, хотя некоторые белки (например, гемоглобин) могут сохраняться на протяжении всего времени существования клетки (например, эритроциты живут около 110 суток). Быстро разрушаются дефектные белки, которые были неправильно собраны или получили повреждения в процессе функционирования, а также регуляторные ферменты, катализирующие ключевые реакции метаболических путей.
Дефектные белки и белки с наиболее коротким временем полужизни обычно как в бактериальных, так и в эукариотических клетках разрушаются с помощью селективных АТР-зависимых цитоплазматических систем. Другая система, которая у позвоночных действует в лизосомах, высвобождает аминокислоты из мембранных
белков, внеклеточных белков и белков с большим временем полужизни.
У Е. coli многие белки расщепляются АТР- зависимой протеазой Lon (название происходит от «long form» — «длинных форм» белков, которые появляются в клетке только в отсутствие данной протеазы). Протеаза Lon активируется в присутствии дефектных белков или белков с коротким временем полужизни; на расщепление каждой пептидной связи расходуются две молекулы АТР. Детали этого процесса пока установить не удалось. Когда белок расщеплен на мелкие неактивные пептиды, завершают процесс другие ATP-независимые протеазы.
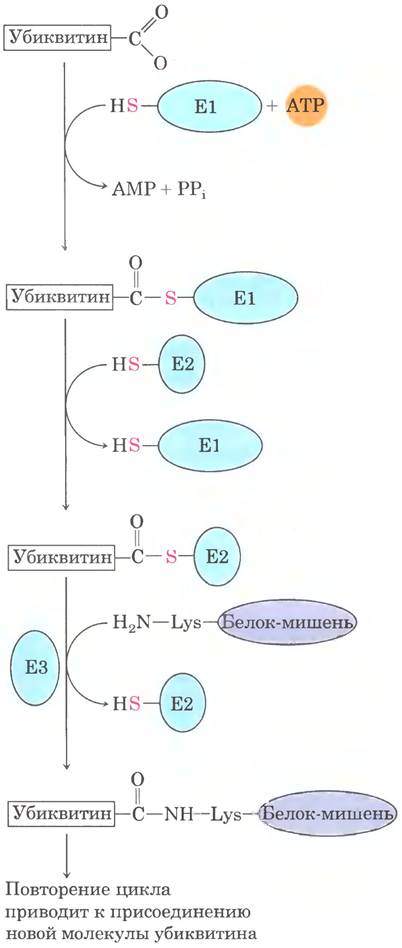
ATP-зависимый путь деградации белков в эукариотических клетках несколько отличается и зависит от действия белка убиквитина. Убиквитин (76 аминокислотных остатков) является одним из самых высококонсервативных белков, он практически идентичен у столь разных организмов, как дрожжи и человек. Убиквитин ковалентно связывается с белками, предназначенными для расщепления по ATP-зависимому пути с участием трех разных ферментов (E1, Е2 и Е3 на рис. 27-47).
Рис. 27-47. Трехстадийный процесс присоединения убиквитина к белку. Процесс происходит через образование двух разных промежуточных комплексов убиквитина с ферментами. В конечном итоге свободная карбоксильная группа С-концевого остатка Gly убиквитина через амидную (изопептидную) связь соединяется с ε-аминогруппой остатка Lys белка-мишени. При повторении цикла образуется полиубиквитин — ковалентный полимер из субъединиц убиквитина, который направляет связанный эукариотический белок к месту расщепления.
Связанные с убиквитином белки расщепляются крупным белковым комплексом, называемым 26S-протеасомой (Мr = 2,5 • 106) (рис. 27-48).
Рис. 27-48. Трехмерная структура эукариотической протеасомы. У всех эукариот 26S-протеасома высококонсервативна. Она состоит из центральной 20S-частицы и двух регуляторных 195-частиц, а — Центральная частица (РDВ ID 1IRU) состоит из четырех колец, образующих структуру в форме бочонка. Два внутренних кольца содержат по семь разных β-субъединиц (голубые), три из которых обладают протеазной активностью (темно-синие). Два внешних кольца состоят из семи разных α-субъединиц (серые), б — Центральный бочонок с двух сторон закрыт регуляторными частицами. Центральная часть изображена теми же цветами, что и на рис. а. Основание и вершина каждой регуляторной частицы изображены разными оттенками розового цвета. Регуляторная частица раскручивает убиквитинированные белки (синяя спираль) и проталкивает их в бочонок.
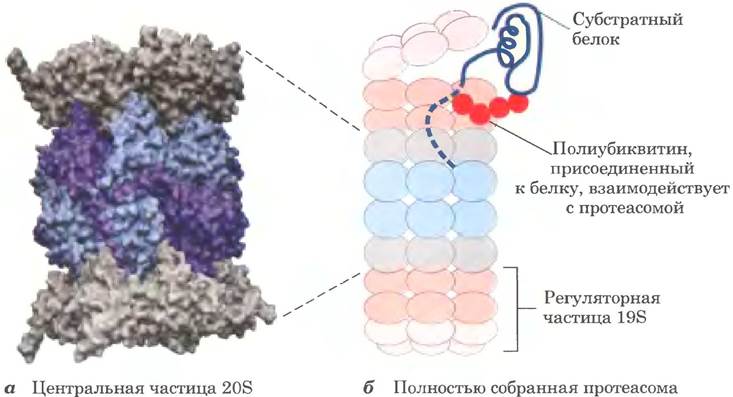
Протеасома эукариот содержит как минимум 32 разные субъединицы, представленные в двух копиях, причем большинство этих субъединиц высококонсервативно у многих видов, от дрожжей до человека. Протеасома состоит из комплексов двух типов: центральной частицы в форме бочонка и регуляторных частиц на обоих ее концах. Центральная 20S-частица состоит из четырех колец; внешние кольца сформированы из семи α-субъединиц, а внутренние кольца — из семи β-субъединиц. Три из семи субъединиц каждого β-кольца обладают протеазной активностью, причем все они различаются по субстратной специфичности. Кольца центральной частицы формируют структуру в форме бочонка, в котором происходит расщепление белков-мишеней. Регуляторные 19S-частицы на концах бочонка содержат по 18 субъединиц, включая те, которые распознают и связывают убиквитинированные белки. Шесть субъединиц являются ААА+ АТРазами (см. гл. 25), которые, вероятно, раскручивают убиквитинированные белки и направляют развернутые полипептиды в центральную частицу для разрушения. Кроме того, 19S-частица отщепляет от разрушаемых белков убиквитин. В большинстве клеток есть дополнительные регуляторные комплексы, способные заменить 19S-частицу. Эти альтернативные регуляторы не гидролизуют АТР и не связывают убиквитин, однако они необходимы для расщепления некоторых клеточных белков. В зависимости от внутриклеточных условий 26S-протеасоме могут помогать различные регуляторные комплексы.
Мы пока не понимаем всех сигналов, индуцирующих присоединение убиквитина, но один простой сигнал был обнаружен. Первая аминокислота, которая остается после удаления с N-конца остатка Met или после другого посттрансляционного протеолитического процессинга N-конца, определяет время жизни многих белков (табл. 27-9). Эти N-концевые сигналы не изменились за миллиарды лет эволюции — они одинаковые в бактериальных системах расщепления белков и в системе убиквитинирования у человека. Были обнаружены и более сложные сигналы (см. рис. 12-46, т. 1).
Таблица 27-9. Связь между временем жизни белка и его N-концевым остатком
N-концевой остаток |
Время полужизни* |
Стабилизирующий |
|
Met, Gly, Ala, Ser. Thr, Val |
> 20 ч |
Дестабилизирующий |
|
Ile, Gln |
~ 30 мин |
Tyr, Glu |
~ 10 мин |
Pro |
~ 7 мин |
Leu, Phe, Asp, Lys |
~ 3 мин |
Arg |
~ 2 мин |
* Время полужизни определяли для дрожжевой β-галактозидазы, модифицированной таким образом, что в каждом эксперименте фермент имел другой N-концевой остаток. Время полужизни разных белков и в разных организмах может быть различным, но общая тенденция, вероятно, прослеживается повсеместно.
Убиквитин-зависимый протеолиз одинаково важен как для регуляции клеточных процессов, так и для уничтожения дефектных белков. Многие белки, которые нужны только на одной стадии клеточного цикла эукариотических клеток, после выполнения своей функции быстро разрушаются по убиквитин-зависимому пути. В регуляции клеточного цикла очень важную роль играет убиквитин-зависимое разрушение циклина (рис. 12-46 в т. 1). Компоненты Е2 и Е3, участвующие в реакциях убиквитинирования (рис. 27-47), представляют два крупных семейства белков. Ферменты Е2 и Е3 проявляют разное сродство к белкам-мишеням и регулируют таким образом разные клеточные процессы. Некоторые ферменты Е2 и Е3 локализованы в строго определенных клеточных компартментах, что отражает их специализацию.
Неудивительно, что нарушения механизма убиквитинирования приводят к различным заболеваниям. Неспособность разрушать определенные белки (продукты онкогенов), которые активируют деление клеток, может привести к развитию опухолей, но и слишком быстрое разрушение белков, которые действуют в качестве опухолевых супрессоров, может вызвать тот же эффект. Предполагается, что неэффективное или очень быстрое разрушение клеточных белков обусловливает развитие болезней почек, астму, нейродегенеративные расстройства, такие как паркинсонизм и болезнь Альцгеймера (при этих болезнях обнаружены характерные белковые
структуры в нейронах), кистозный фиброз (возникает в результате слишком быстрого разрушения и нарушения функции хлорных каналов; см. доп. 11-3 в т. 1), синдрома Лиддла (натриевые каналы в почках не разрушаются, что приводит к избыточному всасыванию Nа+ и раннему развитию гипертонии) и многие другие заболевания. При лечении некоторых из этих болезней можно использовать ингибирующую активность протеасом. При изменении метаболизма разрушение белков играет такую же важную роль для выживания клетки, как и их синтез. Еще многое предстоит узнать об этих метаболических путях. ■
Краткое содержание раздела 27.3 Транспорт и расщепление белков
■ После синтеза многие белки направляются к месту своей локализации в клетке. Один из механизмов направленной доставки белка основан на узнавании сигнального пептида, чаще всего расположенного на N-конце вновь синтезированного белка.
■ В клетках эукариот один класс сигнальных последовательностей распознается сигнал- распознающей частицей (SRР), которая связывает сигнальную последовательность, как только она появляется на рибосоме, и переносит целую рибосому и незаконченный полипептид в ЭР. Полипептиды с такими сигнальными последовательностями по мере синтеза перемещаются в просвет ЭР, где они модифицируются и откуда переносятся в комплекс Гольджи. Далее белки сортируются и направляются в лизосомы, плазматическую мембрану или транспортные везикулы.
■ Эукариотические белки, доставляемые в митохондрии и хлоропласты, и секретируемые белки бактерий также имеют N-концевую сигнальную последовательность.
■ Белки, предназначенные для транспорта в ядро, содержат внутреннюю сигнальную последовательность, которая в отличие от других сигнальных последовательностей не отщепляется после того, как белок доставляется к месту назначения.
■ Некоторые клетки эукариот импортируют белки путем опосредованного рецепторами эндоцитоза.
■ Все клетки со временем разрушают белки, используя специализированные системы протеолиза. Дефектные белки и белки с коротким временем полужизни обычно разрушаются с помощью АТР-зависимой системы. В клетках эукариот белки сначала связываются с высококонсервативным белком убиквитином. Убиквитин-зависимый протеолиз осуществляется протеасомами, которые тоже высококонсервативны. Этот механизм играет очень важную роль в регуляции многих клеточных процессов.
■ Многие хорошо изученные антибиотики и токсины ингибируют некоторые стадии синтеза белка.