ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 3. ПУТИ ПЕРЕДАЧИ ИНФОРМАЦИИ - 2017
ЧАСТЬ III. ПУТИ ПЕРЕДАЧИ ИНФОРМАЦИИ
Самая важная задача химической физиологии и эмбриологии — понять, почему клетки ткани не экспрессируют постоянно все заложенные в их геномах возможности.
— Франсуа Жакоб и Жак Моно, из статьи в Journal of Molecular Biology, 1961
28. РЕГУЛЯЦИЯ ЭКСПРЕССИИ ГЕНОВ
В клетке одновременно экспрессируется только часть из 1000 генов типичного бактериального генома или же из 20 000 генов генома человека. Продукты некоторых генов находятся в клетке в очень большом количестве: например, необходимые для синтеза белка факторы элонгации — очень распространенные бактериальные белки, а рибулозо-1,5-бифосфат- карбоксилаза/оксигеназа (рубиско) растений и фотосинтезирующих бактерий, по-видимому, — самый распространенный фермент в биосфере. Продукты других генов содержатся в гораздо меньших количествах, например, в клетке может присутствовать несколько молекул ферментов, исправляющих редкие повреждения ДНК. Со временем потребность в продуктах генов может меняться. Так, в разных метаболических путях потребности в ферментах могут увеличиваться и уменьшаться при изменении источников питания или по мере их истощения. На различных стадиях развития многоклеточного организма белки, влияющие на дифференцировку клеток, присутствуют только в некоторых клетках и совсем краткое время. Специализация клеточных функций влияет на потребность в продук
тах различных генов; например, в эритроцитах только один белок (гемоглобин) присутствует в очень высокой концентрации. С учетом высокой энергетической стоимости синтеза белка регуляция экспрессии генов весьма существенна для оптимального использования энергии.
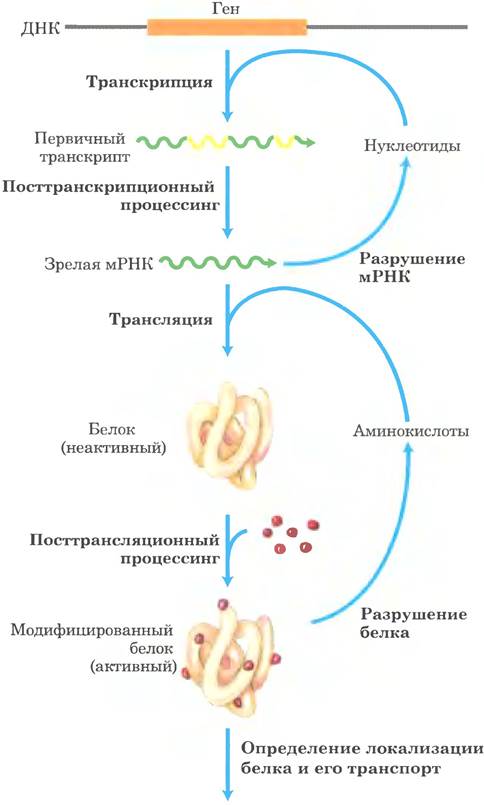
Концентрация белка в клетке определяется сложным равновесием, как минимум, семи процессов, причем каждый процесс имеет несколько активных точек регуляции.
1. Синтез первичных транскриптов РНК (транскрипция).
2. Посттранскрипционная модификация мРНК.
3. Расщепление мРНК.
4. Синтез белка (трансляция).
5. Посттрансляционная модификация белка.
6. Компартментализация и транспорт белка.
7. Расщепление белка.
Эти процессы обобщены на рис. 28-1. Некоторые механизмы мы рассмотрели в предыдущих главах. Посттранскрипционная модификация мРНК посредством таких процессов, как альтернативный сплайсинг (см. рис. 26-22) или редактирование РНК (см. рис. 27-10, 27-12), может влиять на то, какие белки синтезируются на транскриптах мРНК и в каком количестве. Скорость деградации мРНК зависит от ее нуклеотидной последовательности (разд. 26.1). Скорость трансляции мРНК и скорость посттрансляционной модификации белка, его транспорта и расщепления также зависят от множества факторов (гл. 27).
Из процессов на рис. 28-1 лучше всего исследованы те, которые действуют на уровне инициации транскрипции; они в основном и рассматриваются в данной главе. Открытия сложных, иногда даже удивительных механизмов регуляции подтверждают важность регуляции на уровне посттранскрипционной модификации и трансляции, особенно в клетках эукариот. Регуляция экспрессии многих генов происходит по сложным и даже избыточным механизмам и поэтому она сопряжена с большими затратами химической энергии.
Рис. 28-1. Семь процессов, влияющих на стационарную концентрацию белка. Каждый процесс имеет несколько точек регуляции.
Контроль инициации транскрипции синхронно регулирует многочисленные гены, кодирующие продукты с взаимозависимыми функциями. Например, при сильном повреждении бактериальной ДНК клеткам требуется координированная активизация синтеза многих ферментов репарации ДНК. Вероятно, наиболее сложная координация реализуется в регуляторных схемах, которые управляют развитием многоклеточных эукариот и используют множество регуляторных механизмов.
Мы начнем с рассмотрения взаимодействий между белками и ДНК, которые играют ключевую роль в регуляции транскрипции. Затем обсудим специфические белки, влияющие на экспрессию генов у бактерий и у эукариот. Кроме того, там, где это необходимо, мы рассмотрим элементы регуляции на уровне посттранкрипционной модификации и трансляции, что позволит полнее отразить сложность механизмов регуляции.
28.1. Принципы регуляции генов
Гены тех продуктов, которые необходимы клетке постоянно, такие как гены ферментов основных метаболических путей, экспрессируются на более или менее постоянном уровне в каждой клетке организма. Такие гены часто называют генами домашнего хозяйства. Постоянная экспрессия гена называется конститутивной экспрессией.
Концентрация продуктов других генов увеличивается и уменьшается в ответ на молекулярные сигналы; это регулируемая экспрессия гена. Гены, концентрация продуктов которых увеличивается при особых обстоятельствах, относятся к индуцибельным; увеличение экспрессии называется индукцией. Например, экспрессия многих генов, кодирующих ферменты репарации ДНК, индуцируется при сильных повреждениях ДНК. Наоборот, гены, концентрация продуктов которых уменьшается в ответ на молекулярный сигнал, относят к репрессибельным, а этот процесс называется репрессией. Например, у бактерий избыток триптофана приводит к репрессии генов
тех ферментов, которые катализируют биосинтез триптофана.
Транскрипция опосредуется и регулируется взаимодействиями белка и ДНК, в частности, с участием белковых компонентов РНК- полимеразы (гл. 26). Сначала мы обсудим регуляцию активности РНК-полимеразы, а затем перейдем к общему описанию белков, участвующих в этом процессе. После этого мы исследуем молекулярные основы распознавания различных последовательностей ДНК специфическими белками.
РНК-полимераза связывается с ДНК в области промоторов
РНК-полимеразы связываются с ДНК в области промотора и инициируют транскрипцию (см. рис. 26-5); эти участки обычно расположены вблизи точки, в которой начинается синтез РНК на матрице ДНК. Регуляция инициации транскрипции часто действует на уровне взаимодействия РНК-полимеразы с промотором.
Нуклеотидные последовательности промоторов значительно различаются, что определяет сродство РНК-полимеразы и, следовательно, частоту инициации транскрипции. Некоторые гены Escherichia coli транскрибируются один раз в секунду, другие — менее одного раза за клеточный цикл. Во многом эти различия определяются спецификой последовательностей промоторов. Даже в отсутствие регуляторных белков различия в последовательностях промоторов могут объяснять более чем 1000-кратные различия в частоте инициации транскрипции. Большинство промоторов Е. coli имеет последовательность, близкую к консенсусной (рис. 28-2). Мутации, изменяющие консенсусную последовательность, обычно снижают эффективность промотора; и, наоборот, мутации, приближающие к консенсусной последовательности, обычно усиливают промотор.
Рис. 28-2. Консенсусные последовательности промоторов Е. coli. Большинство замен оснований на участках -10 и -35 отрицательно сказывается на эффективности промотора. Некоторые промоторы также включают в себя UP-элемент (см. рис. 26-5). По договоренности, последовательности ДНК изображают в виде нематричной цепи с 5'-концом слева. Нумерация нуклеотидов начинается в точке начала транскрипции; положительные номера находятся справа от нее (в направлении транскрипции), а отрицательные номера — слева. N — любой нуклеотид.

Хотя гены домашнего хозяйства экспрессируются конститутивно, концентрация кодируемых ими продуктов в клетке изменяется в широком диапазоне. Взаимодействие РНК-полимеразы с промотором сильно влияет на вероятность инициации транскрипции этих генов; различия в последовательностях промоторов позволяют клетке синтезировать нужное количество продукта каждого конститутивного гена.
Скорость инициации транскрипции на промоторах неконститутивных генов также определяется последовательностью промотора, но далее их экспрессия модулируется регуляторными белками. Многие из этих белков действуют путем усиления или ослабления взаимодействия между РНК-полимеразой и промотором.
Последовательности эукариотических промоторов более разнообразны, чем у бактерий (см. рис. 26-9). Чтобы связаться с промотором, трем эукариотическим РНК-полимеразам обычно нужен набор основных факторов транскрипции. Тем не менее, как и при экспрессии бактериальных генов, уровень транскрипции определяется влиянием промоторных последовательностей на работу РНК-полимеразы и связанных с ней факторов транскрипции.
Инициация транскрипции регулируется белками, которые связываются с промоторами или недалеко от них
Инициацию транскрипции РНК-полимеразой регулируют, как минимум, три типа белков: факторы специфичности изменяют специфичность PHК-полимеразы по отношению к данному промотору или набору промоторов: репрессоры блокируют присоединение РНК-полимеразы к промотору; активаторы усиливают взаимодействие РНК-полимеразы с промотором.
Мы уже познакомились с бактериальными факторами специфичности в гл. 26, хотя там мы их так не называли. Фактор специфичности, который опосредует распознавание промотора и связывание с ним, — это σ-субъединица холофермента РНК-полимеразы Е. culi. Большинство промоторов Е. coli распознаются одной σ-субъединицей σ70 (Мr = 70 000). При определенных обстоятельствах некоторые σ70-субъединицы замещаются одним из шести других факторов специфичности. В частности, такая ситуация возникает, когда бактерии подвергаются тепловому шоку, что приводит к замене σ70 на σ32 (Мr = 32 000). Связанная с σ32 PHК-полимераза направляется к специализированному набору промоторов с другими консенсусными последовательностями (рис. 28-3). Эти промоторы контролируют экспрессию нескольких генов, кодирующих белки ответа на тепловой шок, в том числе некоторые белки-шапероны (с. 212). Таким образом, путем изменения сродства полимеразы, которое обеспечивает связывание с другими промоторами, достигается координированная регуляция генов, участвующих в взаимосвязанных процессах. В эукариотических клетках в качестве факторов специфичности можно рассматривать некоторые общие факторы транскрипции, такие как ТАТА-связывающий белок (ТВР, см. рис. 26-9).
Рис. 28-3. Консенсусные последовательности промоторов, которые регулируют экспрессию генов теплового шока в клетках Е. coli. Эта система реагирует на повышение температуры и на некоторые другие внешние стрессы, вызывая индукцию определенных белков. Связывание РНК-полимеразы с промоторами теплового шока опосредуется специализированной σ-субъединицей полимеразы σ32, которая заменяет σ70 в инициаторном комплексе РНК-полимеразы.

С определенными участками ДНК связываются белки-репрессоры. В бактериях их участки связывания, называемые операторами, обычно находятся вблизи промотора. Репрессор блокирует связывание РНК-полимеразы или ее продвижение вдоль ДНК. Регуляция с участием репрессора, подавляющего транскрипцию, называется отрицательной регуляцией. Связывание репрессора с ДНК регулируется сигнальной молекулой, или эффектором. Обычно эффектор - это небольшая молекула или белок, который присоединяется к репрессору и изменяет его конформацию. Взаимодействие между репрессором и эффектором либо усиливает, либо ослабляет транскрипцию. В некоторых случаях конформационные изменения приводят к отсоединению репрессора от оператора (рис. 28-4, а). После этого инициация транскрипции может продолжиться. В других случаях взаимодействие между неактивным репрессором и эффектором заставляет репрессор связаться с оператором (рис. 28-4, б). В эукариотических клетках участок связывания репрессора может находиться на некотором расстоянии от промотора; связывание приводит к тому же эффекту, что и в бактериальных клетках, ингибированию сборки или активности транскрипционного комплекса на промоторе.
Рис. 28-4. Общие схемы регуляции инициации транскрипции. Показаны два типа отрицательной регуляции, а — репрессор (розовый) связывается с оператором в отсутствие сигнальной молекулы; внешний сигнал вызывает диссоциацию репрессора и тем самым разрешает транскрипцию. б — репрессор связывается в присутствии сигнальной молекулы; при прекращении сигнала репрессор отделяется, и начинается транскрипция. Положительную регуляцию опосредуют активаторы. Показаны два типа положительной регуляции, в — активатор (зеленый) связывается с ДНК в отсутствие сигнальной молекулы, и происходит транскрипция; когда приходит сигнал, активатор отделяется и транскрипция подавляется. г — активатор связывается с ДНК под действием сигнала и отделяется только при прекращении сигнала. Обратите внимание, что термины «положительная» и «отрицательная» регуляция относятся к регуляторному белку, участвующему в этих процессах: связанный белок либо способствует, либо препятствует транскрипции. В любом случае влияние сигнальной молекулы может усиливать или ослаблять транскрипцию в зависимости от действия этого сигнала на регуляторный белок.
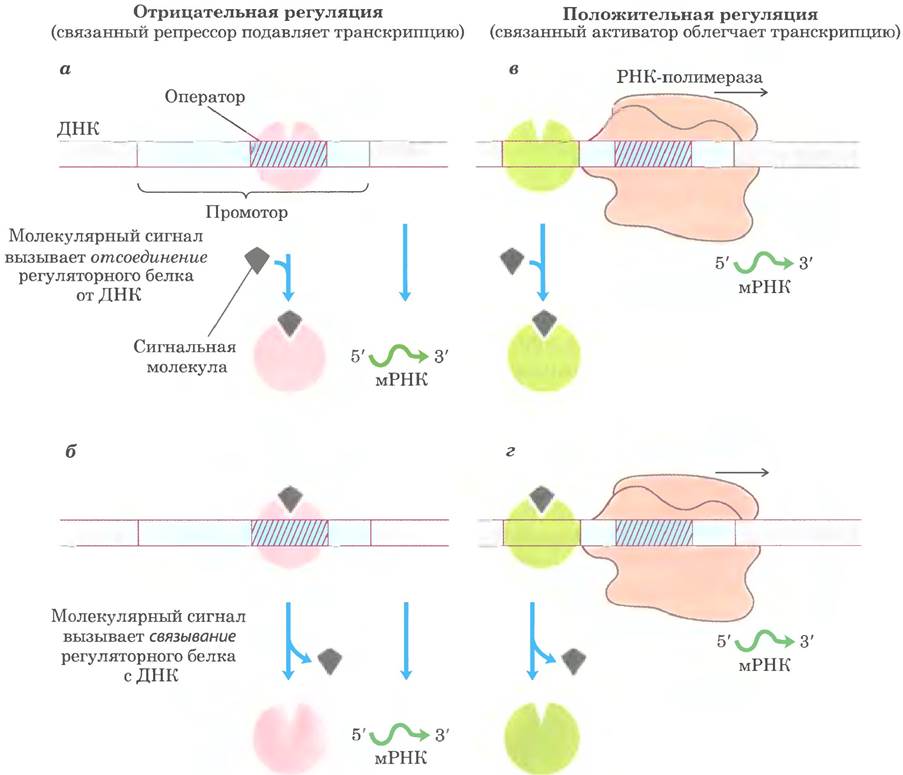
Активаторы оказывают противоположное действие; они связываются с ДНК и увеличивают активность РНК-полимеразы на промоторе. Это пример положительной регуляции. Участки связывания активатора часто примыкают к тем промоторам, с которыми РНК-полимераза сама по себе (т. е. без активаторов) не связывается совсем или связывается очень слабо, так что без активатора транскрипция осуществляется с очень низкой эффективностью. Некоторые эукариотические активаторы усиливают транскрипцию, связываясь с участками ДНК, называемыми энхансерами, которые расположены далеко от промотора (на расстоянии до нескольких тысяч пар оснований). Некоторые активаторы постоянно связаны с ДНК и усиливают транскрипцию, пока связывание сигнальной молекулы не заставляет их отделиться от ДНК (рис. 28-4. в). В других случаях активатор связывается с ДНК только после взаимодействия с сигнальной молекулой (рис. 28-4, г). Сигнальные молекулы, следовательно, могут усиливать или ослаблять транскрипцию в зависимости от характера их воздействия на активатор. Как мы увидим далее, в эукариотах чаще реализуется положительная регуляция.
Многие бактериальные гены собраны в кластеры и регулируются в виде оперонов
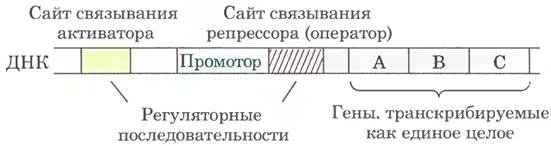
У бактерий есть общий простой механизм координации регуляции генов, продукты которых участвуют в серии взаимосвязанных процессов: эти гены образуют кластеры на хромосоме и транскрибируются вместе. Многие бактериальные мРНК полицистронные (в одном транскрипте содержится несколько генов), и единственный промотор, инициирующий транскрипцию всего кластера, служит участком регуляции экспрессии всех генов кластера. Кластер генов и промотор, а также дополнительные последовательности, которые тоже участвуют в регуляции, называются опероном (рис. 28-5). Обычно опероны содержат от двух до шести генов, транскрибируемых как единое целое; некоторые опероны объединяют 20 или более генов.
Рис. 28-5. Типичный бактериальный оперон. Гены А, В и С транскрибируются в виде одной полицистронной мРНК. К типичным регуляторным последовательностям относятся участки связывания белков, которые либо активируют, либо подавляют транскрипцию с промотора.
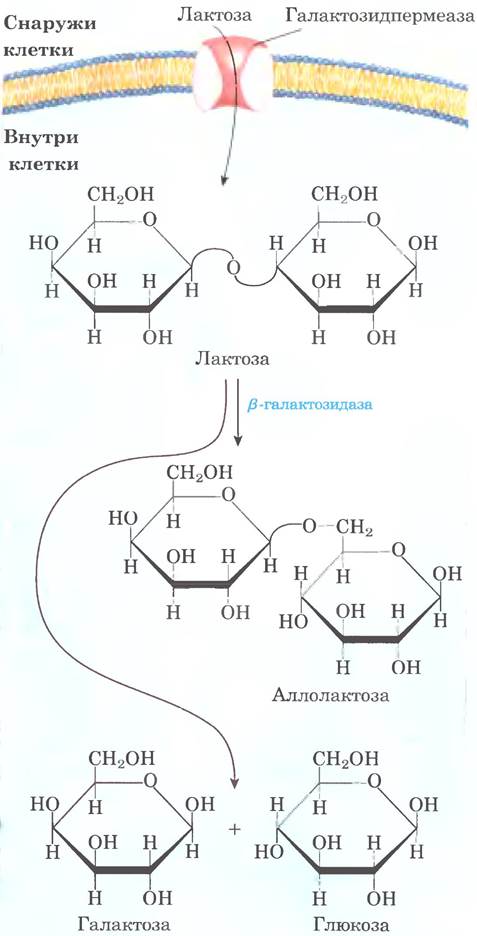
Принципы экспрессии бактериальных генов впервые были выявлены при изучении метаболизма лактозы в клетках Е. coli, которая может использовать этот сахар как единственный источник углерода. В 1960 г. Франсуа Жакоб и Жак Моно опубликовали в Трудах Французской академии наук короткую статью, в которой описали, как два соседних гена, участвующих в метаболизме лактозы, подвергаются координированной регуляции под действием генетического элемента, расположенного на одном конце этого кластера генов. Речь шла о гене β-галактозидазы, которая расщепляет лактозу на галактозу и глюкозу, и гене галактозидпермеазы (лактозопермеаза, с. 567 вт. 1), которая переносит лактозу внутрь клетки (рис. 28-6). В этой статье впервые появились термины «оперон» и «оператор». Представленная модель оперона впервые позволила рассматривать регуляцию генов на молекулярном уровне.

Рис. 28-6. Метаболизм лактозы в клетках Е. coli. Для поглощения лактозы и ее метаболизма в клетках Е. coli требуются галактозидпермеаза и β-галактозидаза. В незначительной степени β-галактозидаза также катализирует превращение лактозы в аллолактозу путем трансгликозилирования.
Отрицательная регуляция лактозного оперона
Лактозный оперон (lac) (рис. 28-7, а) содержит гены β-галактозидазы (Z), галактозидпермеазы (Y) и тиогалактозидтрансацетилазы (A). Фермент тиогалактозидтрансацетилаза, по-видимому, модифицирует токсичные галактозиды, чтобы облегчить их удаление из клетки. Каждому из этих трех генов предшествует участок связывания рибосомы (на рис. 28-7 не показан), который направляет трансляцию этого гена независимо от остальных (гл. 27). Регуляция laс-оперона laс-репрессором (Lac) происходит по схеме, представленной на рис. 28-4, я.
Рис. 28-7. Лактозный оперон. а — lac-оперон в репрессированном состоянии. Ген I кодирует Lac-peпpeccop. Гены lac Z, Y и А кодируют β-галактозидазу, галактозидпермеазу и тиогалактозидтрансацетилазу соответственно. Р — промотор lac-генов, Р1 — промотор гена I. O1 — главный оператор lac-оперона; O2 и O3 — дополнительные операторы с меньшим сродством к Lас-репрессору. б — Lac-penpeccop связывается с главным оператором и с дополнительными операторами O2 или O3, что, вероятно, приводит к образованию петли ДНК, которая обвивается вокруг репрессора, в — Lac-penpeccop, связанный с ДНК (по PDB 1D 1LBG). Видно, что белок (серый) связан с короткими участками ДНК (синие), г — изменение конформации Lac-peпpeccopa, вызванное его связыванием с искусственным индуктором изопропилтиогалактозидом (ИПТГ; по PDB 1D 1LBH и 1LBG). Структура тетрамерно- го репрессора показана без связанного ИПТГ (бледное изображение на заднем фоне) и со связанным ИПТГ (яркое изображение; ИПТГ не показан). В отсутствие ИПТГ связанная ДНК не показана. Когда ИПТГ связан, а ДНК не связана, ДНК-связывающие домены репрессора сильно дезорганизованы, и их нельзя выделить в кристаллическом виде.
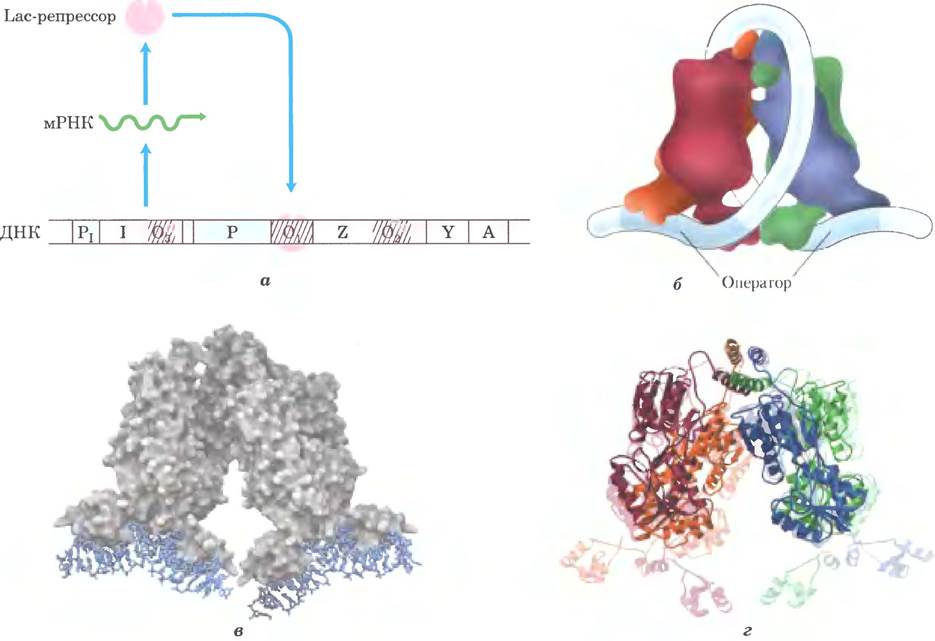
При изучении клеток с мутациями laс- оперона были установлены некоторые подробности его регуляции. В отсутствие лактозы транскрипция генов lac-оперона подавлена. Мутации в области оператора или другого гена, гена I, приводят к конститутивному синтезу продуктов. Если ген I поврежден, репрессию можно восстановить, введя в клетку нормально функционирующий ген I на другой молекуле ДНК. Это доказывает, что ген I кодирует способную диффундировать молекулу, которая и подавляет транскрипцию. Оказалось, что эта молекула — тетрамерный белок, теперь называемый Lac- репрессором, состоящий из идентичных субъединиц. Оператор О1, с которым Lac-peпpeccop связывается прочнее всего, граничит с точкой начала транскрипции (рис. 28-7, а). Ген I транскрибируется со своего собственного промотора (Р1) независимо от других генов laс-оперона. В lac-опероне есть два дополнительных участка связывания Lac-penpeccopa. Центр одного из них (O2) располагается в позиции +410 внутри гена, кодирующего β-галактозидазу (Z); центр второго (O3) — в позиции -90 внутри гена I. Чтобы подавить экспрессию оперона, Lac-penpeccop, по-видимому, связывается одновременно с главным оператором и с одним из двух дополнительных участков, так что расположенная между ними последовательность ДНК образует петлю (рис. 28-7, б, в). При любом варианте связывания инициация транскрипции блокируется.
Несмотря на образование этого сложного комплекса, транскрипция подавляется не полностью. Связывание Lac-penpeccopa уменьшает вероятность инициации транскрипции в 103 раз. Если сайты O2 и O3 повреждены в результате делеции или мутации, связывание Lac-penpeccopa с одним только оператором O1уменьшает транскрипцию в 102 раз. Даже при связывании репрессора в каждой клетке есть несколько молекул β-галактозидазы и галактозидпермеазы, по-видимому, синтезированных во время тех редких эпизодов, когда lac- penpeccop на краткое время отсоединяется от операторов. Этот минимальный уровень транскрипции необходим для регуляции оперона.
Когда в клетках появляется лактоза, происходит индукция laс-оперона. Молекула индуктора связывается с особым участком Lac-репрессора, изменяя его конформацию (рис. 28-7, г) и приводя к отделению репрессора от оператора. Индуктором в системе laс-оперона служит не сама лактоза, а ее изомер — аллолактоза (рис. 28-6). Транспорт лактозы в клетки Е. coli осуществляет присутствующий там фермент пермеаза; далее под действием β-галактозидазной активности лактоза превращается в аллолактозу. Отделение репрессора от оператора после связывания репрессора с аллолактозой позволяет начать транскрипцию генов laс-оперона и приводит к тысячекратному увеличению концентрации β-галактозидазы.
Некоторые β-галактозиды, похожие по строению на аллолактозу, индуцируют laс-оперон, но не являются субстратами ß-галактозидазы; другие, наоборот, являются субстратами β-галактозидазы, но не индукторами. В экспериментах часто используется очень эффективный (и при этом нерасщепляемый) индуктор laс-оперона изопропилтиогалактозид (IPTG):
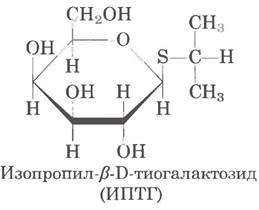
Нерасщепляемый индуктор позволяет изучать физиологическую роль лактозы как источника углерода для роста клеток независимо от ее участия в регуляции экспрессии генов.
В клетках бактерий обнаружено множество оперонов; несколько полицистронных оперонов найдено и в клетках низших эукариот. Однако в клетках высших эукариот почти все гены, кодирующие белки, транскрибируются по отдельности.
Механизмы регуляции оперонов могут значительно отличаться от простой модели, представленной на рис. 28-7. Даже laс-оперон на самом деле сложнее, чем показано здесь; как мы увидим в разд. 28.2, в системе действует еще и активатор. Прежде чем перейти к рассмотрению уровней регуляции экспрессии, мы исследуем ключевые молекулярные взаимодействия между ДНК-связывающими белками (такими как репрессоры и активаторы) и последовательностями ДНК, с которыми они связываются.
Регуляторные белки содержат специальные ДНК-связывающие домены
Регуляторные белки обычно связываются со специфическими последовательностями ДНК. Их сродство к этим последовательностям в 104-106 раз выше, чем к любым другим участкам ДНК. Большинство регуляторных белков имеет особые ДНК-связывающие домены, которые специфично и прочно связываются с ДНК. Эти связывающие домены почти всегда содержат одну или несколько небольших функциональных групп с характерными структурными мотивами.
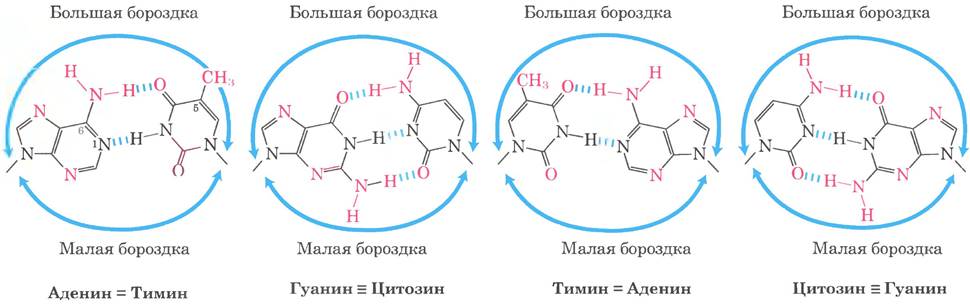
Для специфического связывания с ДНК регуляторные белки должны распознавать характерные структурные элементы ДНК. Большинство функциональных групп, определяющих различия между четырьмя азотистыми основаниями, выступают в большую бороздку ДНК, где участвуют в образовании водородных связей (рис. 28-8). Почти все специфические контакты между ДНК и белком обеспечиваются водородными связями. Примечательно, что при С-5 пиримидинового цикла тимина (в отличие от цитозина) имеется неполярная метальная группа, которая не может участвовать в образовании водородных связей. Белки могут контактировать с ДНК и в малой бороздке, но здесь они, как правило, не различают пары оснований друг от друга.
Рис. 28-8. Фнукциональные группы ДНК, участвующие в связывании белка. Показаны все четыре варианта пар оснований и их функциональные группы, которые располагаются в большой и малой бороздках ДНК. Группы, которые могут быть использованы белками для распознавания пар оснований, выделены красным цветом.
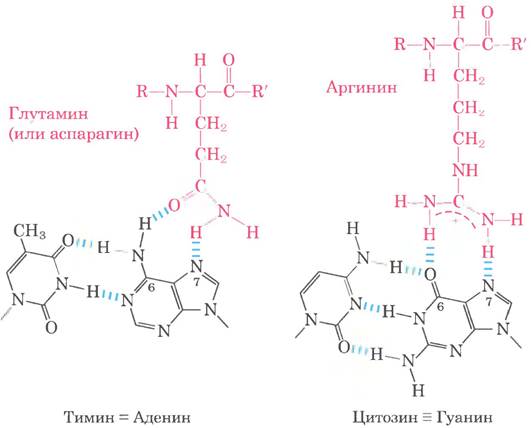
Регуляторные белки чаще всего образуют водородные связи между основаниями ДНК и боковыми цепями остатков Asn, Gin, Glu, Lys и Arg. Есть ли простой код распознавания, в соответствии с которым определенная аминокислота всегда спаривается с определенным основанием? Две водородные связи, которые образуют Asn и Gln с N6и N-7 аденина, не могут возникнуть между другими основаниями. Остаток Arg может образовать две водородные связи с N-7 и О6 гуанина (рис. 28-9). Однако изучение структур многих ДНК-связывающих белков показало, что белок может узнавать каждую пару оснований более чем одним способом; из этого следует вывод, что простого кода «аминокислота-основание» не существует. У некоторых белков взаимодействие Gln-аденин может точно идентифицировать пару А = Т, а у других белков карман для метальной группы тимина также позволяет узнавать пару оснований А = Т. Даже зная структуру ДНК-связывающего белка, пока нельзя на этой основе предложить последовательность ДНК, с которой он связывается.
Рис. 28-9. Два примера специфического взаимодействия при связывании ДНК и белка.
Для взаимодействия с основаниями в большой бороздке ДНК белок должен содержать относительно небольшой структурный фрагмент, выступающий над поверхностью белка. ДНК-связывающие домены регуляторных белков обычно небольшого размера (60-90 аминокислотных остатков), а структурные фрагменты внутри этих доменов, которые непосредственно контактируют с ДНК, еще меньше. Многие маленькие белковые молекулы нестабильны из-за своих ограниченных возможностей сформировать складки для прикрытия гидрофобных групп (с. 173 вт. 1). ДНК-связывающие мотивы либо обладают очень компактной стабильной структурой, либо обеспечивают способ, позволяющий сегменту белка выступать над его поверхностью.
В ДНК участки связывания с регуляторными белками часто представлены инвертированными повторами коротких последовательностей (палиндромами), с которыми происходит кооперативное связывание нескольких (обычно двух) субъединиц регуляторного белка. В этом смысле Вис-репрессор необычен тем, что он функционирует в виде тетрамера из двух димеров, сцепленных вместе концами, удаленными от участков связывания ДНК (рис. 28-7, б). Клетка Е. соli содержит около 20 тетрамеров Lас-репрессора. Каждый из сцепленных димеров в отдельности связывается с палиндромной последовательностью оператора и находится в контакте с 17 из 22 п. н. laс-оперона (рис. 28-10). Каждый из сцепленных димеров может независимо связываться с операторной последовательностью, причем один обычно связывается с О1, а другой — с O2 или О3 (как на рис. 28-7, б). Последовательность оператора О1 двух парных субъединиц Lac- репрессора имеет ось симметрии второго порядка. Тетрамерный Вас-репрессор in vivo связывается со своей операторной последовательностью; константная диссоциации ~10-10 М. Репрессор связывается с оператором примерно в 106 чаще, чем с другими последовательностями, таким образом. связывание именно с этими несколькими парами оснований из 4,6 млн п. н. в хромосоме Е. coli высокоспецифично.
Рис. 28-10. Связь между /ас-операторной последовательностью О1 и lас-промотором. На бежевом фоне выделены основания (образуют палиндром), симметричные относительно оси, обозначенной вертикальной пунктирной линией.

Описано несколько ДНК-связывающих мотивов, но здесь мы сосредоточим внимание на двух, которые более всего важны при связывании ДНК с регуляторными белками; это мотивы спираль-поворот-спираль и цинковый палец. Мы также рассмотрим ДНК-связывающий домен другого типа (гомеодомен), обнаруженный в некоторых эукариотических белках.
Спираль-поворот-спираль.
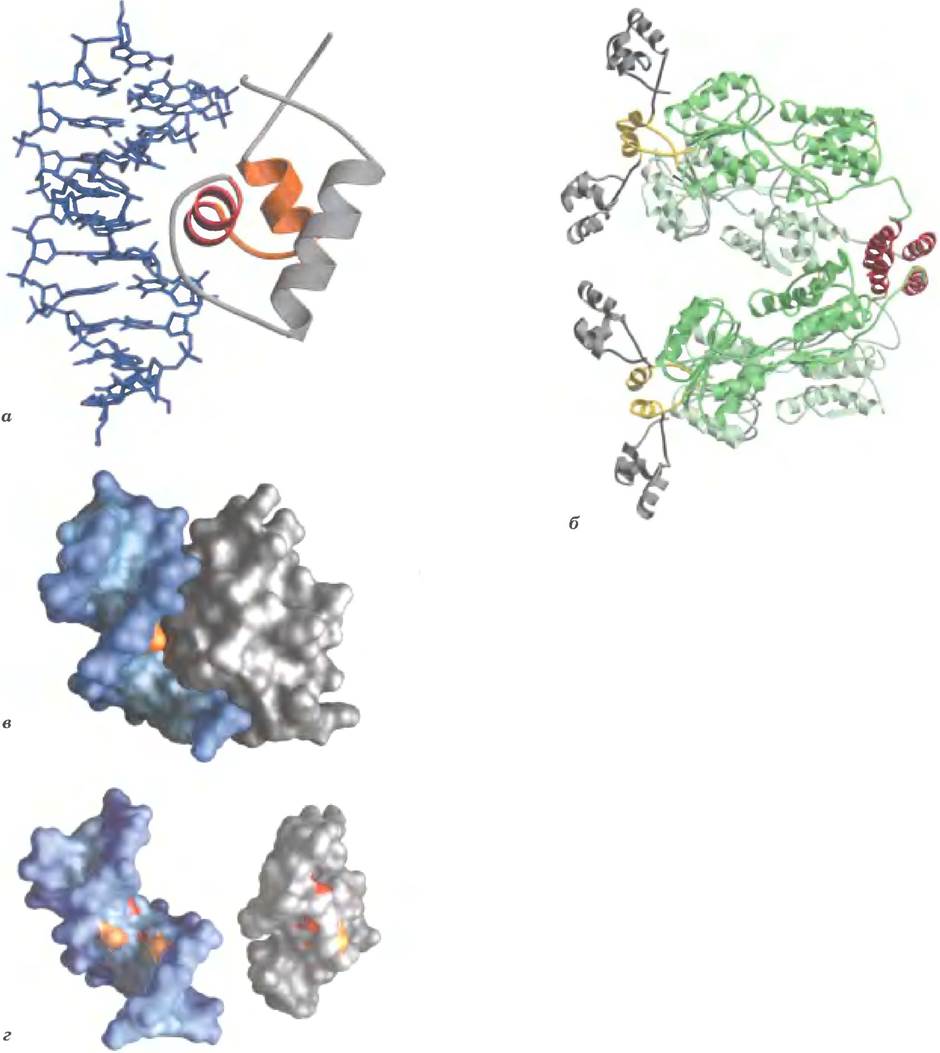
Этот ДНК-связывающий мотив играет очень важную роль при взаимодействиях с ДНК многих регуляторных белков у бактерий; похожие мотивы также обнаружены в некоторых эукариотических регуляторных белках. Мотив спираль поворот-спираль состоит примерно из 20 аминокислот, образующих два коротких α-спиральных сегмента, каждый длиной 7-9 аминокислотных остатков, разделенных β-поворотом (рис. 28-11). Сама эта структура нестабильна; она входит в более крупный ДНК-связывающий домен. Один из двух α-спиральных сегментов называется распознающей спиралью, так как здесь обычно содержатся аминокислоты, взаимодействующие с ДНК специфическим образом. Эта α-спираль лежит поверх других сегментов белковой структуры и выступает над поверхностью белка. При связывании с ДНК распознающая спираль располагается внутри или почти внутри большой бороздки. У Lac- репрессора именно такой ДНК-связывающий структурный фрагмент (рис 28-11).
Рис. 28-11. Спираль-поворот-спираль. а —ДНК-связывающий домен Бас-репрессора (РDВ 1D 1LСС). Мотив спираль-поворот-спираль изображен красным и оранжевым цветами; ДНК- распознающая спираль красная, б — Бас-репрессор целиком (по РDВ 1D 1LВС). ДНК-связывающие домены — серые, участвующие в образовании тетрамера α-спирали — красные. Оставшаяся часть белка (оттенки зеленого) содержит участки связывания с аллолактозой, соединенные с ДНК-связывающим доменом линкерными спиралями (желтые), в — поверхность ДНК-связывающего домена Lас-репрессора (серый), связанного с ДНК (синяя), г — та же ДНК-связывающая область, что и на рис. в, но отделенная от ДНК; видны поверхности белка и ДНК, взаимодействующие при связывании. Некоторые функциональные группы белка и ДНК, образующие водородные связи, выделены красным цветом; другие группы, которые связаны гидрофобными взаимодействиями, оранжевые. Эта модель позволяет увидеть только некоторые группы, участвующие в узнавании последовательности ДНК. Комплементарность двух поверхностей весьма заметна.
Цинковый палец.
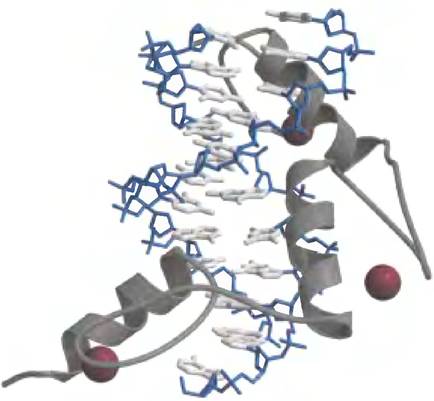
В мотиве цинкового пальца около 30 аминокислотных остатков образуют вытянутую петлю, основание которой удерживается одним ионом Zn2+, координированного с четырьмя аминокислотными остатками (четыре остатка Cys или два остатка Cys и два остатка His). Ион цинка не взаимодействует с ДНК, а служит для стабилизации этого маленького структурного мотива. Поддержанию стабильности также способствует наличие нескольких гидрофобных боковых цепей внутри структуры. На рис. 28-12 показано взаимодействие между ДНК и тремя цинковыми пальцами из одного полипептида мышиного регуляторного белка Zif 268.
Рис. 28-12. Цинковый палец. Три цинковых пальца (серые) регуляторного белка Zif 268 в комплексе с ДНК (синие и светло-серые) (PDB ID 1A1L). Каждый ион Zn2+(коричневые) координирован с двумя остатками His и двумя остатками Cys (не показано).
Многие ДНК-связывающие белки эукариот содержат мотив цинкового пальца. Взаимодействие одного цинкового пальца с ДНК обычно слабое, и многие ДНК-связывающие белки, как и Zif 268, содержат множество цинковых пальцев, что существенно усиливает связывание. Один из ДНК-связывающих белков лягушки Xenopus имеет 37 цинковых пальцев. В бактериальных белках этот мотив встречается очень редко.
В разных белках с цинковыми пальцами связывание с ДНК осуществляется по-разному. Некоторые цинковые пальцы содержат аминокислотные остатки, важные для распознавания последовательности ДНК, тогда как другие, по- видимому, связываются с ДНК неспецифическим образом (в последнем случае аминокислоты, необходимые для специфического связывания, расположены в других участках белка). Цинковые пальцы могут также участвовать в связывании РНК, например, в некоторых белках, связывающихся с эукариотической мРНК и действующих в качестве репрессоров трансляции. Мы обсудим их функцию позднее (разд. 28.3).
Гомеодомен.
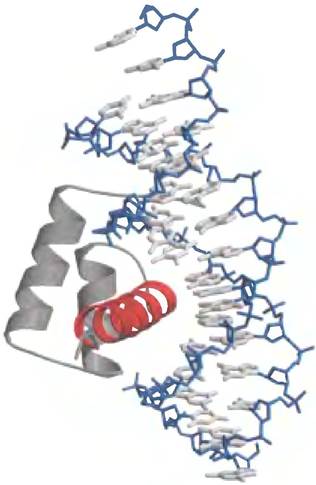
ДНК-связывающий домен другого типа был идентифицирован в ряде белков, участвующих в регуляции транскрипции, особенно в процессе развития эукариот. Этот участок из 60 аминокислот называется гомеодоменом, поскольку он был открыт в гомеозисных генах (генах, регулирующих развитие тела). Этот высококонсервативный домен обнаружен в белках широкого круга организмов, включая человека (рис. 28-13). ДНК-связывающий участок этого домена родственный мотиву спираль поворот спираль. Последовательность ДНК, которая кодирует этот домен, называется гомеобоксом.
Рис. 28-13. Гомеодомен. Показан гомеодомен, связанный с ДНК; можно видеть, что одна из α-спиралей (красная), наложенная на две другие, укладывается внутри большой бороздки ДНК (РDВ 1D 1В81). Это только небольшая часть гораздо более крупного белка Ultrabithorax (Ubх), участвующего в регуляции развития плодовой мушки (см. разд. 28.3).
Регуляторные белки содержат также домены, ответственные за взаимодействия белка с белком
Регуляторные белки содержат не только домены для связывания с ДНК, но и домены для взаимодействия с белками — с РНК-полимеразой, другими регуляторными белками или с другими субъединицами того же регуляторного белка. Это характерно, например, для многих эукариотических факторов транскрипции, функционирующих в качестве активаторов генов. Они часто связываются с ДНК в виде димеров, используя ДНК- связывающие домены с цинковыми пальцами. Некоторые структурные домены предназначены для взаимодействий, обеспечивающих образование димеров, если это необходимо для связывания с ДНК. Как и в случае ДНК-связывающих мотивов, среди структурных мотивов, обеспечивающих взаимодействия белка с белком, можно выделить мотивы несколько типов. Среди них следует упомянуть лейциновую молнию и основную спираль-петлю-спираль. Наличие этих структурных мотивов позволяет подразделить регуляторные белки на различные структурные семейства.
Лейциновая молния.
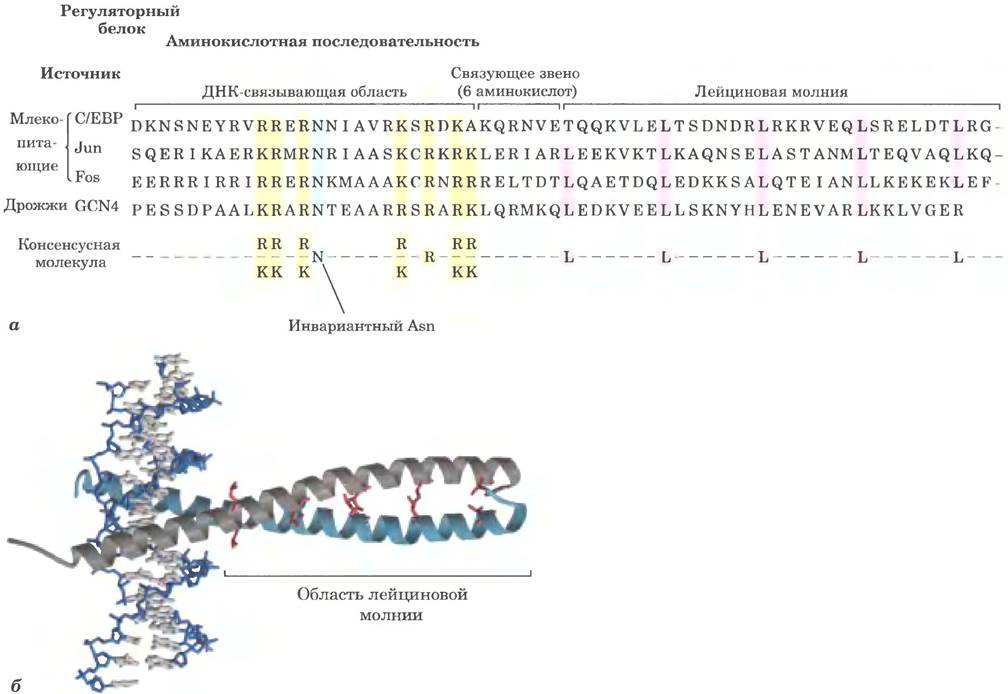
Этот мотив представлен амфифильной α-спиралью, на одной стороне которой сгруппированы гидрофобные аминокислотные остатки (рис. 28-14): гидрофобная поверхность образует зону контакта между двумя полипептидами димера. Особенность этих α-спиралей заключается в наличии в каждой седьмой позиции остатков Leu, которые образуют прямую линию вдоль гидрофобной поверхности. Ранее предполагали, что остатки Leu смыкаются, как застежка-молния, но теперь известно, что они выстраиваются в линию благодаря тому, что взаимодействующие α-спирали обвивают друг друга, образуя суперспираль (рис. 28-14, б). В регуляторных белках с лейциновыми молниями часто имеется отдельный ДНК-связывающий домен с высоким содержанием положительно заряженных остатков аминокислот (Lys или Arg), которые могут взаимодействовать с несущими отрицательный заряд фосфатными группами скелета ДНК. Лейциновые молнии обнаружены во многих эукариотических белках и в нескольких белках бактерий.
Рис. 28-14. Лейциновая молния, а — сравнение аминокислотных последовательностей нескольких белков, содержащих лейциновые молнии. Обратите внимание на остатки Leu (L) в каждой седьмой позиции в области молнии и на ряд остатков Lys (К) и Arg (R) в ДНК-связывающем участке, б — лейциновая молния из дрожжевого белка GCN4 (PDB 1D 1YSA). Показаны только «застегнутые» α-спирали (серая и голубая), относящиеся к разным субъединицам димерного белка. Две спирали оборачиваются одна вокруг другой с образованием суперспирали. Взаимодействующие остатки Leu выделены красным цветом.
Основная спираль-петля-спираль.
Этот структурный мотив встречается в некоторых эукариотических регуляторных белках, участвующих в контроле экспрессии генов при развитии многоклеточных организмов. Эти белки содержат консервативную область длиной около 50 аминокислотных остатков, которая в равной степени важна как для связывания с ДНК, так и для димеризации белка. Этот участок образует две короткие амфифильные α-спирали, соединенные петлей различной длины. Мотив спираль-петля спираль следует отличать от мотива спираль- поворот-спираль, который участвует в связывании ДНК. Мотивы спираль петля - спираль двух полипептидов взаимодействуют с образованием димеров (рис. 28-15). Связывание этих белков с ДНК опосредуют короткие смежные аминокислотные последовательности, богатые остатками основных аминокислот; эти короткие последовательности напоминают отдельные ДНК-связывающие участки в белках с лейциновыми молниями.
Рис. 28-15. Спираль-петля-спираль. Человеческий транскрипционный фактор Мах, связанный с ДНК (PDB 1D 1HLО). Белок представляет собой димер (окрашена лишь одна субъединица). ДНК-связывающий сегмент (розовый) стыкуется с первой спиралью мотива спираль-петля-спираль (красный). Вторая спираль стыкуется с С-концом этой субъединицы (фиолетовая). Взаимодействие С-концевых спиралей двух субъединиц приводит к образованию сверхспиральной структуры, очень напоминающей структуру лейциновой молнии (см. рис. 28-14, б), но в данном примере лишь с одной парой взаимодействующих остатков Leu (красные боковые цепи вверху). Всю эту структуру в целом иногда называют мотивом спираль-петля-спираль/ лейциновая молния.
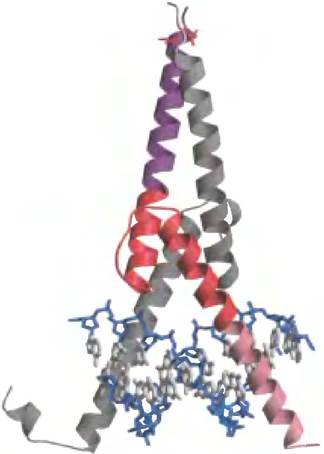
Комбинации субъединиц в регуляторных белках эукариот.
На основании близкого структурного сходства было выделено несколько семейств эукариотических факторов транскрипции. Члены каждого семейства могут образовывать димеры из двух одинаковых белков (гомодимер) или из двух разных белков, принадлежащих к одному семейству (гетеродимер). Гипотетическое семейство из четырех различных белков с лейциновыми молниями может, таким образом, образовать 10 разновидностей димеров. Во многих случаях различные комбинации, по-видимому, имеют разные регуляторные и функциональные особенности.
Наряду со структурными доменами для связывания с ДНК и для димеризации (или олигомеризации) многие регуляторные белки должны также содержать участки для взаимодействия с РНК-полимеразой и/или с неродственными регуляторными белками. Охарактеризованы дополнительные домены, как минимум, трех различных типов, они ответственны за межбелковые взаимодействия (в первую очередь у эукариот): домен, богатый глутамином, богатый пролином и кислый домены; названия отражают природу аминокислотных остатков, которые преобладают в этих доменах.
Связывание ДНК с белком — основа сложных регуляторных схем функционирования генов. Теперь мы переходим к более подробному изучению этих схем сначала в бактериальных, а затем в эукариотических системах.
Краткое содержание раздела 28.1 Принципы регуляции генов
■ Экспрессию генов регулируют процессы, влияющие на скорость синтеза и разрушения продуктов генов. В значительной степени регуляция осуществляется на уровне инициации транскрипции посредством регуляторных белков, которые либо подавляют транскрипцию (отрицательная регуляция), либо активируют ее (положительная регуляция) на специфических промоторах.
■ Гены бактерий, кодирующие продукты с взаимосвязанными функциями, часто организованы в кластеры — опероны (отдельные транскрипционные единицы). Транскрипция генов обычно блокируется при связывании специфического белка-репрессора с участком ДНК, называемым оператором. Небольшие молекулы (индукторы) могут вызывать отсоединение репрессора от оператора. Эти принципы впервые были установлены при изучении лактозного (lac) оперона. Lac- репрессор отделяется от lас-оператора, когда репрессор связывается со своим индуктором аллолактозой.
■ Регуляторные белки — ДНК-связывающие белки, распознающие специфические последовательности ДНК; в большинстве регулируемых белков имеется особый ДНК- связывающий домен. Для этих доменов характерны типичные структурные мотивы, ответственные за связывание с ДНК: спираль-поворот-спираль, цинковый палец и гомеодомен.
■ Регуляторные белки также содержат домены для межбелковых взаимодействий; это лейциновая молния и спираль-петля-спираль, необходимые для димеризации, а также другие мотивы, участвующие в активации транскрипции.