ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 3. ПУТИ ПЕРЕДАЧИ ИНФОРМАЦИИ - 2017
ЧАСТЬ III. ПУТИ ПЕРЕДАЧИ ИНФОРМАЦИИ
28. РЕГУЛЯЦИЯ ЭКСПРЕССИИ ГЕНОВ
28.2. Регуляция экспрессии генов у бактерий
Как и во многих других биохимических исследованиях, ранее регуляция экспрессии генов изучалась у бактерий, а потом уже у других организмов. Представленные ниже примеры регуляции бактериальных генов выбраны из множества хорошо изученных систем отчасти из-за их исторического значения, но прежде всего потому, что они позволяют оценить весь спектр регуляторных механизмов у бактерий. Принципы регуляции бактериальных генов помогают в понимании механизмов экспрессии генов в эукариотических клетках.
Мы начнем с изучения лактозного и триптофанового оперонов; в каждой из этих систем участвуют регуляторные белки, но общие механизмы регуляции очень различаются. Далее мы в общих чертах рассмотрим механизм SOS-ответа в клетках Е. coli и увидим, каким образом осуществляется координированная регуляция генов, рассеянных по всему геному. Затем мы исследуем две совершенно разные бактериальные системы с тем, чтобы показать разнообразие механизмов регуляции, а именно рассмотрим, во-первых, регуляцию синтеза рибосомного белка на уровне трансляции, в процессе которой многие регуляторные белки связываются с РНК, а не с ДНК; во- вторых, регуляцию так называемой фазовой вариации у сальмонеллы, которая возникает вследствие генетической рекомбинации. Наконец, мы разберем некоторые дополнительные примеры посттранскрипционной регуляции, когда РНК сама модулирует свою функцию.
Положительная регуляция лактозного оперона
Взаимодействия оператора, репрессора и индуктора, описанные здесь на примере lас-оперона (рис. 28-7), представляют собой упрощенную модель регуляции экспрессии генов по механизму включения/выключения. В действительности регуляция оперона редко бывает настолько простой. Среда обитания бактерий слишком сложная, чтобы их гены можно было контролировать одним-единственным сигналом. Наряду с лактозой на экспрессию laс-генов влияют и другие факторы, например, глюкоза. Для Е. coli глюкоза, расщепляемая в процессе гликолиза, предпочтительна как источник энергии. Другие сахара тоже могут служить главным или единственным питательным субстратом, но для их включения в гликолиз требуются дополнительные реакции, для которых нужны специфические ферменты. Очевидно, что экспрессия генов белков, расщепляющих такие сахара, как лактоза или арабиноза, совершенно не оправдана при наличии достаточного количества глюкозы.
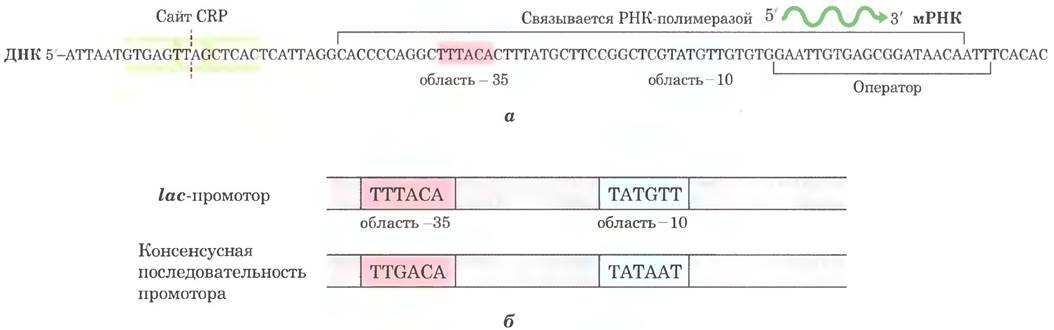
А как происходит экспрессия laс-оперона, если в среде одновременно присутствуют и глюкоза, и лактоза? В присутствии глюкозы экспрессию генов, необходимых для к атаболизма лактозы, арабинозы и других вторичных сахаров, ограничивает регуляторный механизм, называемый катаболитной репрессией. Влияние глюкозы опосредует сАМР, выступающий в качестве коактиватора, и активаторный белок, называемый cAMP-рецепторным белком (CRP, или САР — от англ. catabolite gene activator protein — белок-активатор катаболитных генов). Белок CRP представляет собой гомодимер (масса субъединицы Мr = 22 000), содержащий участки для связывания ДНК и сАМР. Связывание осуществляется через мотив спираль-поворот спираль в ДНК-связывающем домене белка (рис. 28-16). В отсутствие глюкозы комплекс CRP-cAMP связывается с ДНК вблизи lас- промотора (рис. 28-17, а) и в 50 раз усиливает транскрипцию РНК. Следовательно, комплекс CRP-cAMP — положительный регуляторный элемент, реагирующий на концентрацию глюкозы, а Lас-репрессор - отрицательный регуляторный элемент, реагирующий на лактозу. Оба элемента действуют согласованно. Когда Lас- репрессор блокирует транскрипцию, комплекс CRP- сАМР оказывает незначительное влияние на lac-оперон, и диссоциация репрессора от lас-оператора мало изменяет транскрипцию lас- оперона, если не присутствует комплекс CRP- сАМР, облегчающий транскрипцию. Без связанного CRP laс-промотор дикого типа является довольно слабым промотором (рис. 28-17. б). В отсутствие комплекса CRP-cAMP открытый комплекс РНК-полимеразы и промотора (см. рис. 26-6) образуется с трудом. Белок CRP взаимодействует непосредственно с α-субъединицей РНК-полимеразы (рис. 28-16).
Рис. 28-16. Гомодимер CRP (PDB ID 1RUN). Связанная молекула cAMP показана красным цветом. Обратите внимание, как ДНК изгибается вокруг белка. Область, которая взаимодействует с РНК-полимеразой (желтая).
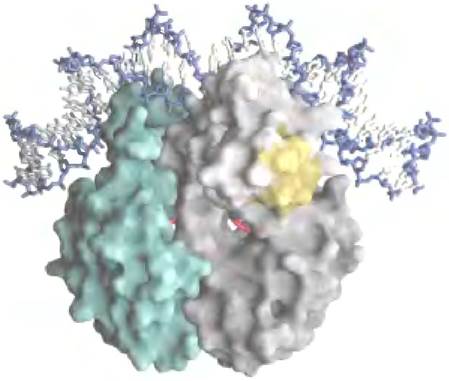
Рис. 28-17 Активация транскрипции lас-оперона под действием CRP. а — участок связывания комплекса CRP-cAMP находится вблизи промотора. Как и последовательность lас- оператора, этот участок двухцепочечной ДНК симметричен относительно оси, обозначенной штриховой линией (комплементарные основания бежевые). б — последовательность Zac-промотора по сравнению с консенсусной последовательностью промотора. Различия с консенсусной последовательностью обусловливает относительно слабое связывание РНК-полимеразы с Zac-промотором до тех пор, пока ее не активирует комплекс CRP-cAMP.
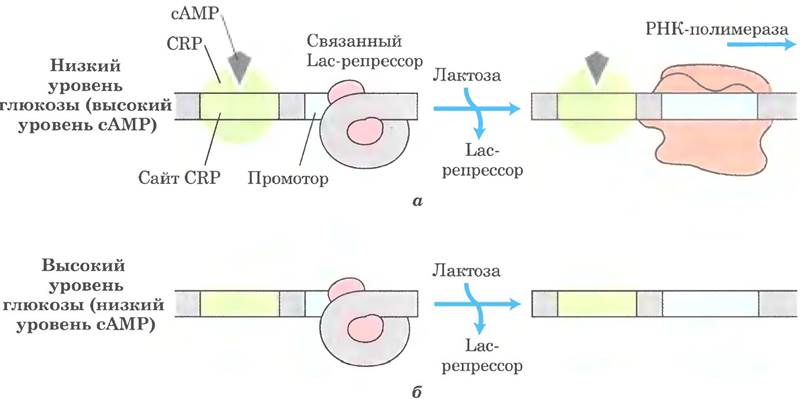
Действие глюкозы на CRP опосредовано сАМР (рис. 28-18). Наиболее активно CRP связывается с ДНК при высокой концентрации сАМР. В присутствии глюкозы синтез сАМР подавляется, и стимулируется его выход из клетки. По мерс снижения концентрации сАМР ослабевает связывание CRP с ДНК, что снижает экспрессию lас-оперона. Поэтому для сильной индукции lас- оперона необходимо присутствие и лактозы (для инактивации /ас-репрессора), и глюкозы в низкой концентрации (для повышения концентрации сАМР и усиления связывания сАМР с CRP).
Рис. 28-18. Влияние глюкозы и лактозы на экспрессию lас-оперона. а — высокий уровень транскрипции достигается только при достаточно низкой концентрации глюкозы (когда концентрация сАМР высокая, и комплекс СRР-сАМР связан с ДНК) и высокой концентрации лактозы (когда Lас-репрессор не связан с ДНК), б — без связанного активаторного комплекса СRР-сАМР транскрипция с lас-промотора слабая, даже когда концентрация лактозы высокая, и Lас-репрессор не связан с ДНК.
CRP и сАМР участвуют в координированной регуляции многих оперонов, прежде всего тех, которые кодируют ферменты метаболизма сахаров, таких как лактоза и арабиноза. Несколько оперонов с общим регулятором называется регулоном. Эта структура из сотен генов участвует в координации и изменении клеточных функций, а также играет центральную роль в регуляции экспрессии генов, рассеянных по геному эукариот. Приведем примеры бактериальных регулонов: система генов теплового шока, которая реагирует на изменения температуры (разд. 26.1), и система генов, индуцируемых в клетках Е. coli в рамках SOS-ответа на повреждения ДНК; эти регулоны описаны ниже.
Многие гены ферментов биосинтеза аминокислот регулируются путем аттенюации транскрипции
Для синтеза белка требуются 20 незаменимых аминокислот в больших количествах. Е. coli может синтезировать их все. Гены ферментов, необходимых для синтеза каждой аминокислоты, обычно образуют оперон и экспрессируются по мере необходимости. Если аминокислоты достаточно, ферменты биосинтеза не нужны и экспрессия оперона подавляется.
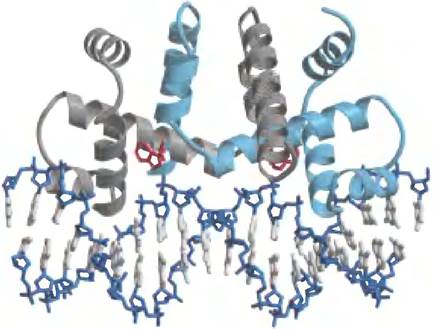
Триптофановый оперон (trp) Е. coli содержит пять генов ферментов, необходимых для превращения хоризмата в триптофан (рис. 28-19). Два из этих ферментов катализируют более одного этапа биохимического пути. Время полужизни мРНК trp-оперона составляет лишь около трех минут, поэтому-то клетка может быстро реагировать на изменяющиеся потребности в этой аминокислоте. Тrр-репрессор представляет собой гомодимер, каждая субъединица которого содержит 107 аминокислотных остатков (рис. 28-20). Когда триптофана много, он связывается с Тtр- репрессором и изменяет его конформацию, что позволяет репрессору связаться с trp-оператором и блокировать экспрессию trp-оперона. Участок trp-оператора перекрывается с промотором, поэтому связывание репрессора блокирует связывание РНК-полимеразы.
Рис. 28-19. Триптофановый оперон. Этот оперон регулируется двумя механизмами: (1) при высокой концентрации триптофана репрессор (вверху слева) связывается со своим оператором, и (2) происходит аттенюация транскрипции trр-мРНК (см. рис. 28-21). Внизу представлена схема биосинтеза триптофана ферментами, закодированными в trр-опероне (также см. рис. 22-17).
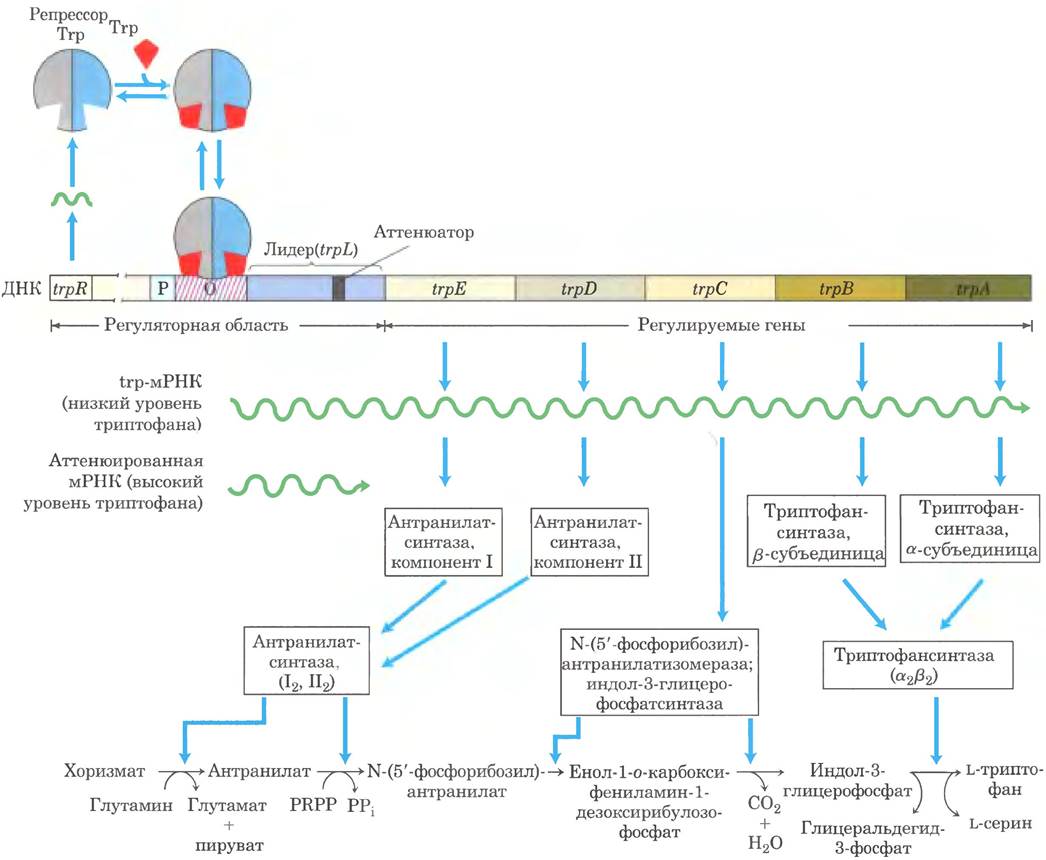
Рис. 28-20. Триптофановый репрессор. Репрессор представляет собой димер, обе субъединицы которого (серая и голубая) связываются с ДНК через мотивы спираль- поворот-спиралъ (1РDВ 1D 1ТRO). Связанные молекулы триптофана показаны красным цветом.
Опять-таки, такая простая схема опосредованного репрессором механизма включения/выключения экспрессии не описывает всю систему в полной мере. При колебании концентрации триптофана в клетке скорость синтеза ферментов этого пути биосинтеза меняется более чем в 700 раз. Когда действие репрессора ослабевает и начинается транскрипция, скорость транскрипции тонко регулируется с помощью второго процесса. называемого аттенюацией транскрипции, при котором транскрипция начинается в обычном порядке, но внезапно останавливается, не доходя до генов оперона. Аттенюация транскрипции регулируется наличием триптофана и основана на непосредственной связи транскрипции и трансляции в клетках бактерий.
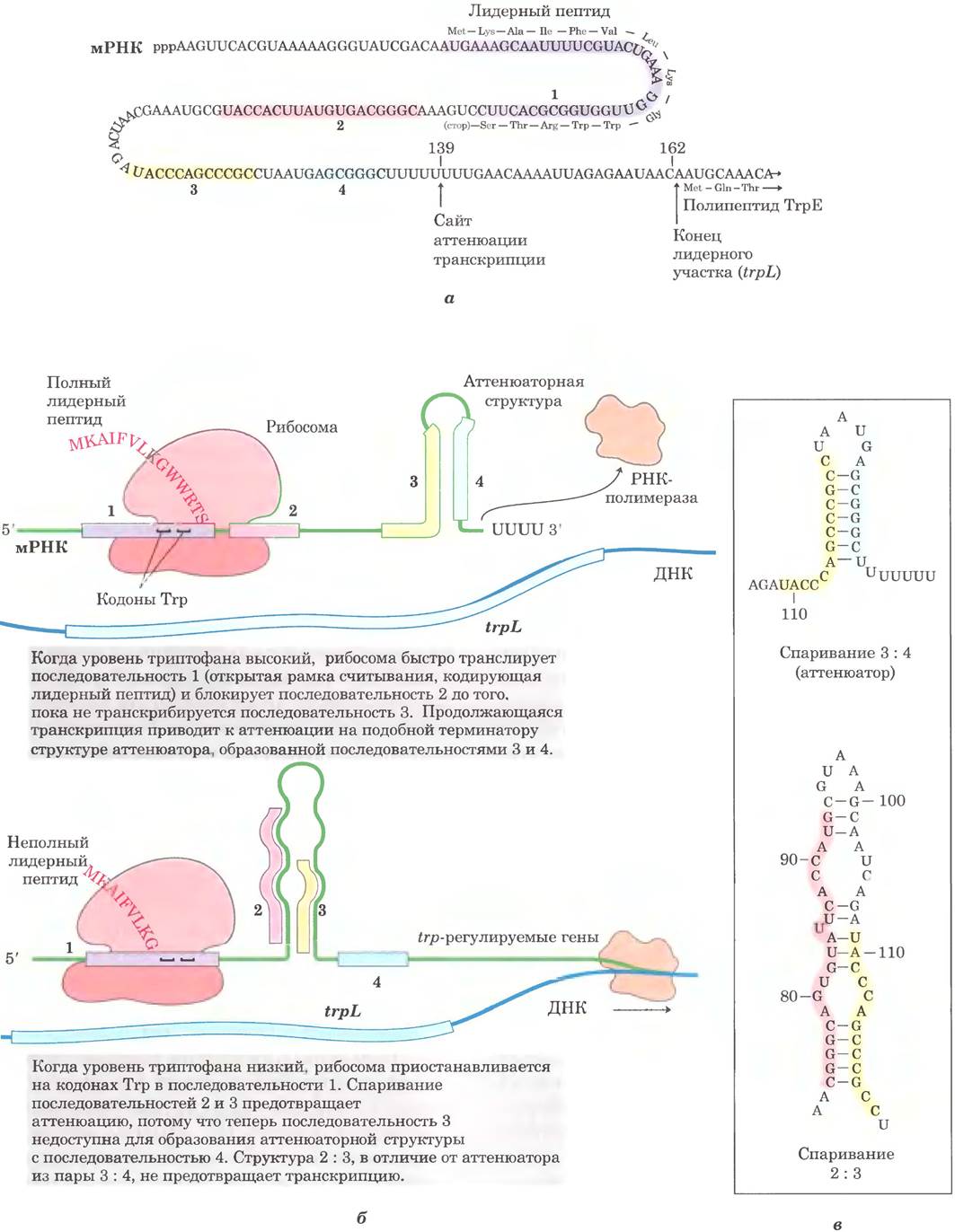
Механизм аттенюации trp-оперона использует сигналы, закодированные в четырех последовательностях внутри 162-нуклеотидного лидерного участка на 5'-конце мРНК, предшествующего инициаторному кодону первого гена (рис. 28-21, а). Внутри лидерного участка находится так называемый аттенюатор, состоящий из последовательностей 3 и 4. Основания этих последовательностей спариваются с образованием G = С-богатой шпильки (стебель и петля), сразу за которой следует серия остатков U. Аттенюатор выступает в роли терминатора транскрипции (рис. 28-21, б). Последовательность 2 также может спариваться с последовательностью 3 (рис. 28-21, в). Тогда аттенюатор не образуется, и гены ферментов биосинтеза триптофана нормально транскрибируются; петля, образующаяся при спаривании последовательностей 3 и 2, не мешает транскрипции.
Регуляторная последовательность 1 играет главную роль в механизме чувствительности к триптофану; она определяет, спаривается ли последовательность 3 с последовательностью 2 (что позволит продолжать транскрипцию) или с последовательностью 4 (что приведет к аттенюации транскрипции). Формирование шпильки зависит от событий, которые происходят при трансляции регуляторной последовательности 1; она кодирует лидерный пептид (названный так, потому что он кодируется лидерной последовательностью мРНК), состоящий из 14 аминокислот, среди которых два остатка триптофана. Лидерный пептид не выполняет никаких других функций, его синтез нужен только для регуляции экспрессии оперона. Этот пептид транслируется сразу же после транскрипции на рибосоме, которая по мере продвижения транскрипции следует непосредственно за РНК-полимеразой.
Когда концентрация триптофана высокая, в клетке содержится много нагруженной триптофаном тРНК (Тrр-тРНКТгР). В таких условиях происходит быстрая трансляция двух кодонов Тrр в последовательности 1 и переход к трансляции последовательности 2 до того, как РНК-полимераза синтезирует последовательность 3. При этом последовательность 2 закрыта рибосомой и недоступна для спаривания с синтезируемой последовательностью 3. В результате при спаривании последовательностей 3 и 4 образуется аттенюатор, и транскрипция останавливается (рис. 28-21, б, вверху). Однако при низкой концентрации триптофана рибосома задерживается на двух кодонах Тrр в последовательности 1 из-за недостатка Тrр-тРНКТrр. В этом случае во время синтеза последовательности 3 последовательность 2 остается свободной, что приводит к их спариванию и продолжению транскрипции (рис. 28-21, б, внизу). Таким образом, по мере уменьшения концентрации триптофана уменьшается и вероятность аттенюации транскрипции.
Рис. 28-21. Аттенюация транскрипции в trp-опероне. Транскрипция инициируется в начале 162-нуклеотидой лидерной последовательности мРНК, которая закодирована в так называемом trpL-участке ДНК (см. рис. 28-19). Существует механизм регуляции, который определяет, произойдет ли аттенюация транскрипции в конце лидерной последовательности или считывание продолжится в область структурных генов, а — лидерный участок trр-мРНК (trрL. В механизме аттенюации в trр-опероне задействованы последовательности 1-4 (выделены цветом). б — последовательность 1 кодирует небольшой лидерный пептид, содержащий два остатка Тrр (W); он транслируется сразу же после начала транскрипции. Последовательности 2 и 3 комплементарны друг другу, как и последовательности 3 и 4. Аттенюатор формируется при спаривании последовательностей 3 и 4 (вверху). По структуре и функции он напоминает терминатор транскрипции (см. рис. 26-8). Спаривание последовательностей 2 и 3 (внизу) предотвращает формирование аттенюатора. Обратите внимание, что лидерный пептид не выполняет других функций в клетке. Трансляция его открытой рамки считывания играет исключительно регуляторную роль, определяя, какие комплементарные последовательности (2 и 3 или 3 и 4) образуют пары. в — спаривание комплементарных участков лидерной последовательности trр-мРНК.
Во многих других оперонах биосинтеза аминокислот также используется механизм аттенюации, позволяющий корректировать уровень синтеза ферментов в соответствии с текущими потребностями клетки. Лидерный пептид, образуемый рhе-опероном, состоит из 15 аминокислот и содержит семь остатков Phe. Лидерный пептид leu-оперона содержит четыре расположенных подряд остатка Leu. Лидерный пептид his-оперона содержит семь расположенных подряд остатков His. Заметим, что механизм аттенюации в his-опероне и ряде других оперонов настолько чувствителен, что является единственным регуляторным механизмом соответствующего пути биосинтеза.
При индукции SОS-ответа происходит разрушение репрессорных белков
Значительные повреждения ДНК в бактериальной хромосоме запускают индукцию многих генов, расположенных далеко друг от друга. Этот процесс, называемый SOS-ответом (разд. 25.2), является еще одним хорошим примером координированной регуляции генов. Многие из индуцированных генов участвуют в репарации ДНК (см. табл. 25-6). Ключевые роли в этом процессе играют белок RесА и репрессор LехА.
Репрессор LехА (Mr = 22 700) подавляет транскрипцию всех SOS-генов (рис. 28-22), поэтому индукция SОS-ответа требует удаления LехА. В данном случае происходит не просто отсоединение репрессора от ДНК в ответ на связывание небольшой молекулы, как в lас- опероне. Репрессор БехА инактивируется, катализируя собственное специфическое расщепление по пептидной связи Аlа-Glу с образованием двух приблизительно равных по длине белковых фрагментов. При физиологическом значении pH для этой автокаталитической реакции расщепления необходим белок RесА. Этот белок не протеаза в классическом смысле, но его взаимодействие с LехА облегчает реакцию расщепления репрессора. Эту активность RесА иногда называют сопутствующей протеазной активностью.
Рис. 28-22. SOS-ответ в клетках Е. coli. В табл. 25-6 перечислены функции многих генов SOS-ответа. Белок LexA выполняет функцию репрессора; его операторные участки (красные) расположены у каждого гена. Поскольку ген rесА не полностью подавляется репрессором LexA, нормальная клетка содержит около 1000 мономеров RecA. ① При значительных повреждениях ДНК (например, под действием УФ- облучения), репликация ДНК останавливается, и число одноцепочечных разрывов в ДНК увеличивается. Белок RecA связывается с поврежденной одноцепочечной ДНК, что активирует его протеазную активность. I В связанном с ДНК состоянии белок RecA облегчает расщепление и инактивацию репрессора LexA. Инактивация репрессора приводит к индукции генов SOS-ответа, включая ген rесА; концентрация RecA увеличивается в 50-100 раз.
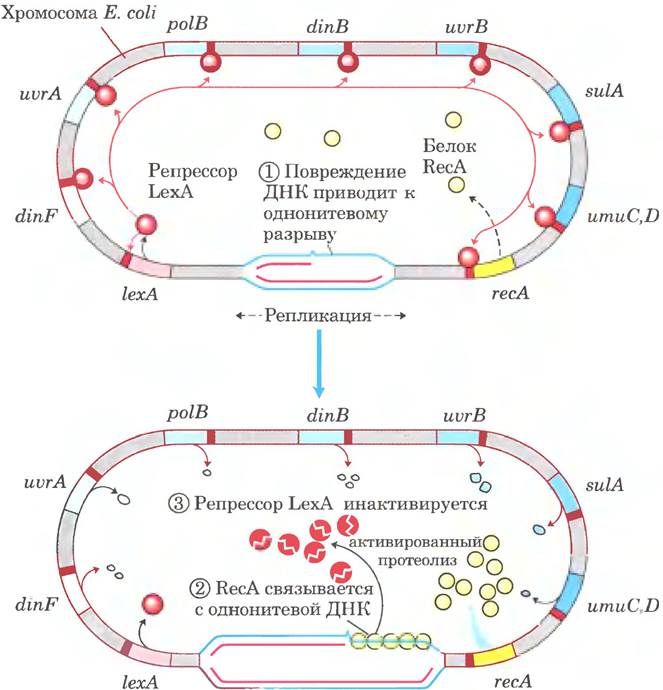
Белок RесА обеспечивает функциональную связь между биологическим сигналом (повреждением ДНК) и индукцией SOS-генов. Значительное повреждение ДНК приводит к многочисленным одноцепочечным разрывам в ДНК, и только RесА, который связывается с одноцепочечной ДНК, может облегчить расщепление репрессора LехА (рис. 28-22, внизу). Связывание RесА в области разрыва, в конечном итоге, активирует его протеазную активность, что приводит к расщеплению репрессора LехА и индукции SОS-ответа.
При индукции SОS-ответа в сильно поврежденных клетках RесА также расщепляет и тем самым инактивирует репрессоры, которые поддерживают в спящем состоянии некоторые лизогенные вирусы, находящиеся в бактериальной клетке. Это замечательный пример эволюционной адаптации. Эти репрессоры, как и LехА, тоже расщепляют сами себя по специфической пептидной связи Аlа—Glу, поэтому индукция SОS- ответа приводит к репликации вирусов и лизису клетки с высвобождением новых вирусных частиц. Так бактериофагу удается «сбежать» из поврежденной клетки.
Синтез рибосомных белков происходит координированно с синтезом рРНК
Когда бактериальной клетке требуется больше белка, в ней не повышается активность каждой рибосомы, а увеличивается их общее число. С увеличением скорости роста клеток увеличивается и численность рибосом. При высокой скорости роста клеток рибосомы составляют приблизительно 45% сухой клеточной массы. Ресурсы, предназначенные для производства рибосом, так велики, а функция рибосом так важна, что клеткам приходится координировать синтез компонентов рибосом — рибосомных белков и РНК (рРНК). Механизмы регуляции этого процесса отличаются от описанных выше механизмов, поскольку здесь регуляция осуществляется в основном на уровне трансляции.
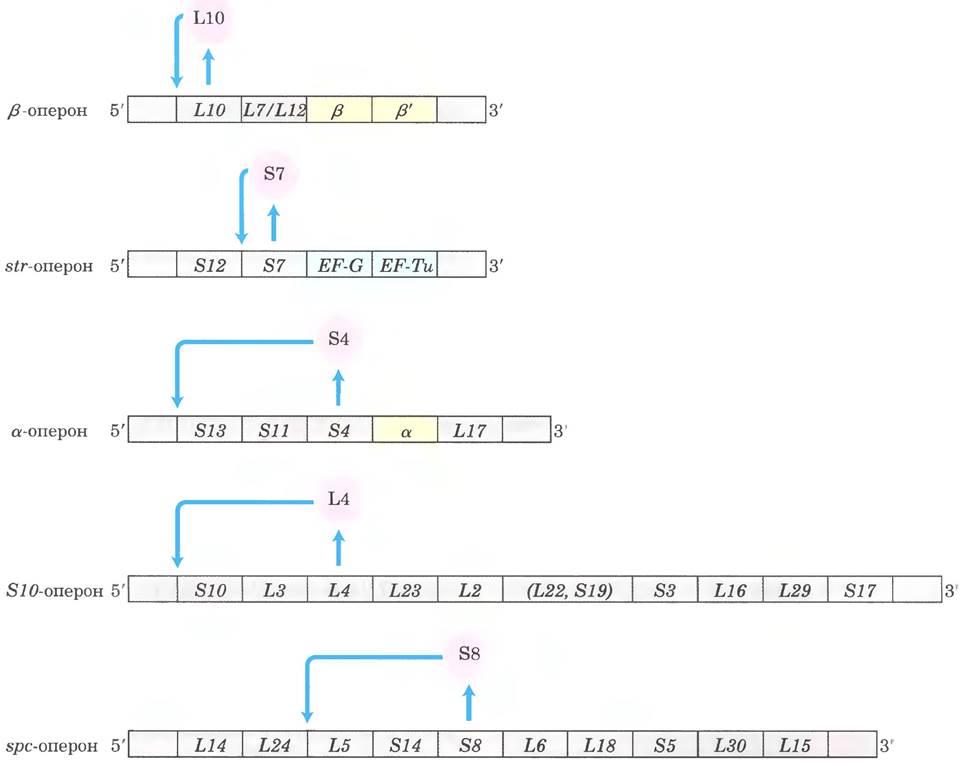
Рибосомные белки кодируются 52 генами, которые расположены, как минимум, в 20 оперонах по 1-11 генов в каждом. Некоторые из этих оперонов также содержат гены субъединиц ДНК- праймазы (см. рис. 25-13), РНК-полимеразы (см. рис. 26-4) и факторов элонгации синтеза белка (см. рис. 27-28), что обеспечивает тесное сопряжение репликации, транскрипции и синтеза белка в процессе роста клетки.
Опероны рибосомных белков регулируются главным образом на уровне трансляции по механизму обратной связи. Один из рибосомных белков, кодируемых каждым опероном, функционирует как репрессор трансляции: он связывается с мРНК, транскрибируемой с данного оперона, и блокирует трансляцию всех генов, закодированных этой мРНК (рис. 28-23). Обычно рибосомный белок, который играет роль репрессора, сам связывается с рРНК. Каждый белок-репрессор трансляции связывается с соответствующей рРНК с более высоким сродством, чем со своей мРНК, поэтому связывание мРНК и подавление трансляции происходит только тогда, когда концентрация рибосомного белка превышает концентрацию рРНК. В результате трансляция мРНК рибосомных белков подавляется только тогда, когда уровень синтеза этих рибосомных белков превышает запросы для сборки функциональных рибосом. Таким образом, скорость синтеза рибосомных белков координирована с наличием рРНК.
Участок связывания репрессора трансляции с мРНК находится вблизи точки начала трансляции одного из генов оперона, обычно первого гена (рис. 28-23). В других оперонах это повлияло бы только на трансляцию этого конкретного гена, потому что в полицистронных мРНК бактерий большинство генов имеет независимые сигналы трансляции. Однако в оперонах рибосомных белков трансляция каждого гена зависит от трансляции всех остальных. Подробности механизма такого трансляционного сопряжения пока не ясны. В некоторых случаях трансляция многочисленных генов, по-видимому, блокируется из-за формирования сложной трехмерной структуры мРНК, которая стабилизируется при спаривании оснований внутри цепи (как на рис. 8-23) и связывании белка-репрессора трансляции. Когда репрессор трансляции отсутствует, связывание рибосомы и трансляция одного или нескольких генов разрушают трехмерную структуру мРНК, что позволяет транслироваться всем остальным генам.
Рис. 28-23. Принцип обратной связи в регуляции трансляции оперонов некоторых рибосомных белков. В виде розовых кружков изображены рибосомные белки, выполняющие функцию репрессоров трансляции. Каждый репрессор трансляции блокирует трансляцию всех генов оперона, связываясь с указанным участком мРНК. Гены субъединиц РНК-полимеразы изображены желтым цветом; гены факторов элонгации — голубым. L1-L34 — белки большой субъединицы (50S) рибосомы, S1-S21 — белки малой (30S) субъединицы.
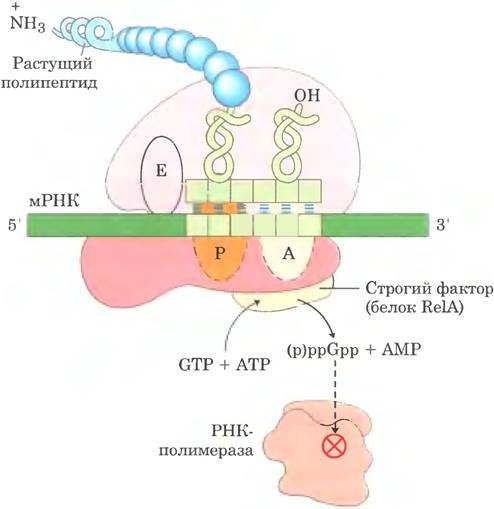
Поскольку синтез рибосомных белков координирован с уровнем рРНК, регуляция образования рибосом соотносится с регуляцией синтеза рРНК. В клетках Е. coli синтез рРНК с семи оперонов коррелирует со скоростью клеточного роста и наличием основных питательных веществ, особенно аминокислот. Регуляцию, зависящую от концентрации аминокислот, называют строгим ответом (рис. 28-24). При низкой концентрации аминокислот синтез рРНК останавливается. Аминокислотное голодание приводит к связыванию ненагруженных тРНК с A-сайтом рибосомы; это запускает цепь событий, которая начинается со связывания с рибосомой фермента, называемого строгим фактором (белком RelA). При связывании с рибосомой строгий фактор катализирует образование необычного нуклеотида (гуанозин- тетрафосфата ppGpp, см. рис. 8-39) — пирофосфат присоединяется по 3'-положению в GTP:
GTP + ATP = pppGpp + АМР
и фосфогидролаза отщепляет один фосфат с образованием ppGpp. Резкое повышение уровня ppGpp при недостатке аминокислот приводит к значительному снижению синтеза рРНК, отчасти вызванному связыванием ppGpp с РНК- полимеразой.
Как и сАМР, нуклеотид ppGpp относится к модифицированным нуклеотидам, которые действуют в клетке как вторичные мессенджеры (с. 427 в т. 1). В клетках Е. coli эти два нуклеотида служат сигналами голодания; они вызывают значительные изменения клеточного метаболизма путем усиления или ослабления транскрипции сотен генов. В эукариотах нуклеотидные вторичные мессенджеры тоже выполняют многочисленные регуляторные функции. Координация роста клетки и ее метаболизма весьма сложна, и, несомненно, со временем нам станут известны и другие механизмы регуляции этих процессов.
Рис. 28-24. Строгий ответ в клетках Е. coli. Ответ на аминокислотное голодание запускается связыванием ненагруженной тРНК с А-сайтом рибосомы. Белок, называемый строгим фактором, связывается с рибосомой и катализирует синтез pppGpp, который под действием фосфогидролазы превращается в ppGpp. Сигнал ppGpp ослабляет транскрипцию одних генов и усиливает транскрипцию других, отчасти за счет связывания с β-субъединицей РНК-полимеразы и изменения специфичности промотора этого фермента. При увеличении концентрации ppGpp синтез рРНК ослабевает.
Функция некоторых мРНК регулируется малыми РНК по цис- или транс-механизму
Как неоднократно отмечалось в данной главе, белки играют важную и вполне понятную роль в регуляции экспрессии генов. Однако существенную роль играют и РНК, что становится все более очевидным по мере обнаружения новых примеров регуляторных РНК. Функцию только что синтезированной мРНК могут контролировать либо РНК-связывающие белки, как мы видели в случае оперонов рибосомных белков, либо другие типы РНК. С молекулой мРНК может связаться другая молекула РНК и регулировать ее активность; это так называемая транс-регуляция. Кроме того, сама молекула мРНК может регулировать свою функцию. Регуляция функций одной части молекулы под действием другой части той же молекулы называется цис-регуляцией.
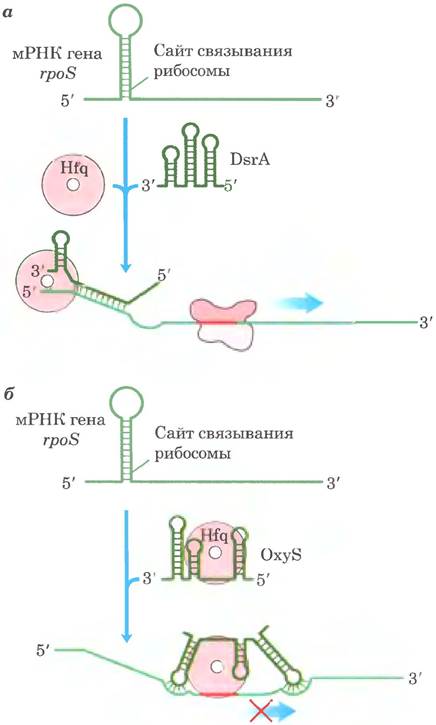
Хороши изученным примером трансрегуляции РНК является регуляция мРНК гена rpoS (RNA polymerase sigma factor), кодирующего σS — один из семи сигма-факторов Е. coli (см. табл. 26-1). Клетки используют этот фактор в определенных стрессовых ситуациях, например, в стационарной фазе (состояние, при котором клетка не растет из-за недостатка питательных веществ); σS необходим для транскрипции многих генов, участвующих в ответе на стресс. Почти в любых условиях мРНК фактора σS в небольшом количестве присутствует в клетке, но не транслируется, поскольку расположенная выше кодирующей области крупная шпилька препятствует связыванию с рибосомой (рис. 28-25). В некоторых стрессовых условиях происходит индукция одной или обеих специализированных малых РНК — DsrA (downstream region А) и RprA (Rpos regulator RNA А). Обе могут спариваться с одной цепью шпильки мРНК σS, разрушая ее структуру и тем самым позволяя осуществлять трансляцию rpoS. Еще одна малая РНК, OxyS (oxidative stress gene S), индуцируется в условиях окислительного стресса и ингибирует трансляцию rpoS. вероятно, путем спаривания с участком мРНК, ответственным за связывание с рибосомой. OxyS экспрессируется при клеточном ответе на другой тип стресса (окислительное повреждение), а не тот. за который отвечает rpoS, и задача этой РНК состоит в предотвращении ненужных в данный момент путей репарации. DsrA, RprA и OxyS представляют собой сравнительно небольшие (менее 300 нуклеотидов) молекулы бактериальной РНК (в эукариотах существуют другие малые РНК, которым соответствуют другие обозначения). Всем РНК для осуществления их функций требуется белок Hfq, т. е. РНК-шаперон, облегчающий образование пар РНК-РНК. Бактериальных генов, регулируемых таким образом, известно немного — всего несколько десятков. Однако эти примеры служат прекрасными модельными системами для изучения более сложных и более многочисленных случаев опосредованной РНК регуляции в эукариотах.
Рис. 28-25. транс-Механизм регуляции функций бактериальной мРНК под действием малых РНК. Некоторые малые РНК — DsrА, RprА и ОхуS — участвуют в регуляции гена rроS. Для проявления активности им нужен белок Hfq — РНК-шаперон, облегчающий образование РНК-дуплекса. Белок Hfq имеет геометрию тороида с порой в центре, а — DsrА стимулирует трансляцию путем спаривания с одной цепью шпильки, что блокирует участок связывания рибосомы. Аналогичным образом действует RprА. б — ОхуS блокирует трансляцию, спариваясь с участком связывания рибосомы.
В регуляции по цис-механизму задействованы РНК, относящиеся к классу так называемых «рибопереключателей». Как говорилось в доп. 26-3, аптамерами называют синтезируемые in vitro молекулы РНК, которые способны специфическим образом связываться с определенными лигандами. Как можно ожидать, такие лиганд-связывающие домены в молекулах РНК существуют и в природе (в рибопереключателях) во многих бактериальных мРНК (и даже в некоторых мРНК эукариот). Эти природные аптамеры представляют собой структурные домены, расположенные в нетранслируемых участках на 5'-конце некоторых бактериальных мРНК. Связывание такого домена со специфическим лигандом приводит к изменениям конформации молекулы мРНК, в результате чего происходит либо остановка транскрипции, обусловленная стабилизацией структуры, вызывающей преждевременную остановку транскрипции, либо остановка трансляции (по цис-механизму) в результате блокирования участка связывания рибосомы (рис. 28-26). В большинстве случаев рибопереключатели действуют по механизму обратной связи. Многие регулируемые таким образом гены участвуют в синтезе или транспорте лигандов, связывающихся с рибопереключателями. Таким образом, при высокой концентрации лиганда рибопереключатели ингибируют экспрессию генов, необходимых для пополнения содержания этого лиганда.
Рис. 28-26. цис-Механизм регуляции функций бактериальной мРНК при участии рибопереключателей. Несколько примеров различных рибопереключателей, действие которых основано на связывании распространенного природного аптамера с тиаминпирофосфатом. Связывание тиаминпирофосфата (ТРР) с аптамером приводит к изменению конформации с различными последствиями, как показано на рис. (а-в).
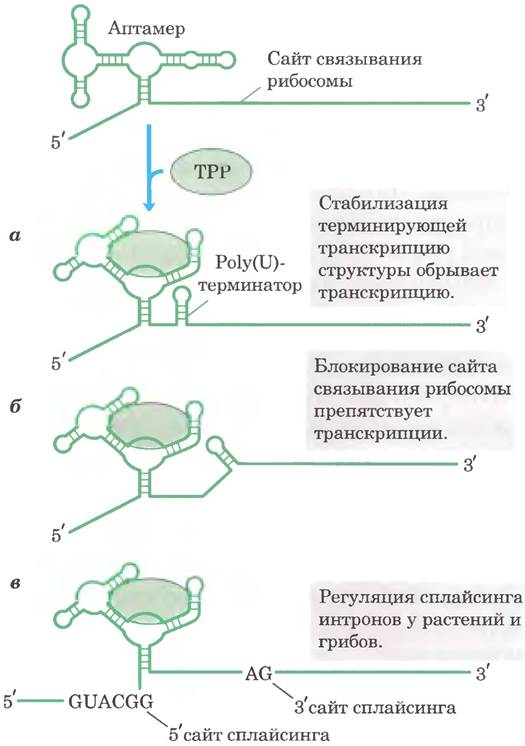
Каждый рибопереключатель связывается лишь с одним лигандом. Обнаружено более 10 видов рибопереключателей, которые реагируют на такие лиганды, как тиаминпирофосфат (ТРР, витамин В1), кобаламин (витамин В12), флавин- мононуклеотид. лизин, S-аденозинметионин (adoMet), пурины, N-ацетилглюкозамин-6-фосфат и глицин. Вполне вероятно, что в будущем будут найдены и другие рибопереключатели. По-видимому, наиболее распространен рибопереключатель, реагирующий на ТРР. Он обнаружен во многих бактериях, грибах и в некоторых растениях. У некоторых бактерий этот участок ингибирует трансляцию, а в других индуцирует преждевременную остановку транскрипции (рис. 28-26). В эукариотах ТРР-связывающий рибопереключатель обнаружен в нитронах некоторых генов; его функция состоит в модуляции альтернативного сплайсинга этих генов (см. рис. 26-22). Пока неизвестно, насколько распространены такие структуры. По некоторым оценкам, рибопереключатели регулируют экспрессию более 4% генов бактерии Bacillus subtilis.
По мере расширения знаний о рибопереключателях ученые стали находить им медицинское применение. Например, большинство описанных на настоящий момент рибопереключателей, включая тот, что реагирует на сигнал adoMet, обнаружено только в бактериях. Лекарственный препарат, связывающийся с этим переключателем и активирующий его, мог бы отключать гены ферментов, синтезирующих и транспортирующих adoMet, лишая бактериальные клетки этого важного кофактора. Лекарства подобного типа, возможно, станут антибиотиками нового поколения. ■
Открытия новых функциональных типов РНК продолжаются, что подтверждает гипотезу о важной роли РНК в эволюции жизни (гл. 26). Малые РНК и рибопереключатели, подобно рибозимам и рибосомам, возможно, представляют собой рудименты, оставшиеся из далекого прошлого мира РНК, которые до сих пор функционируют в современной биосфере. Лабораторный скрининг аптамеров и рибозимов с новыми лиганд-связывающими и каталитическими функциями (см. доп. 26-3) показывает, что РНК может обладать активностями, необходимыми для существования жизнеспособного мира РНК. Открытие многих типов РНК с одинаковыми функциями в различных живых организмах говорит о том, что должны существовать ключевые элементы метаболизма на основе РНК. Например, природные аптамеры (рибопереключатели) могут происходить из молекул РНК, которые миллиарды лет назад связывались с кофакторами, участвовавшими в каталитических процессах метаболизма в мире РНК.
Некоторые гены регулируются путем генетической рекомбинации
Теперь мы обратимся к рассмотрению другого типа регуляции бактериальных генов, происходящей на уровне перестройки ДНК, — рекомбинации. Бактерия Salmonella typhimurium, которая может поселяться в кишечнике млекопитающих, передвигается благодаря вращению находящихся на поверхности клетки жгутиков (рис. 28-27). Многочисленные копии белка флагеллина (Мr = 53 000), из которых образованы жгутики, являются мишенью для атаки иммунной системы млекопитающих. Но клетки Salmonella выработали механизм, предохраняющий их от уничтожения иммунной системой: примерно через каждую тысячу поколений они переключаются с синтеза одного варианта флагеллина на другой (FljB и FliC) при помощи процесса, называемого фазовой вариацией.
Рис. 28-27. Salmonella typhimurium с множеством жгутиков.
Переключение достигается путем периодической инверсии участка ДНК, содержащего промотор гена флагеллина. Инверсия осуществляется по механизму сайт-специфической рекомбинации (см. рис. 25-41) и происходит под действием рекомбиназы Hin в определенной последовательности из 14 п. н. (последовательность his) на любом конце упомянутого участка ДНК. Когда этот участок находится в одной ориентации, происходит экспрессия гена флагеллина FljB и гена репрессора FljA (рис. 28-28. я); репрессор блокирует экспрессию гена флагеллина FliC. Когда участок ДНК перевернут (рис. 28-28, б), гены fljA и fljB больше не транскрибируются, и при исчерпании репрессора происходит индукция гена fliC. Рекомбиназа Hin, кодируемая геном hin в инвертируемом участке, экспрессируется при любой его ориентации, поэтому клетка всегда может переключиться из одного состояния в другое.
Рис. 28-28. Регуляция генов флагеллинов сальмонеллы: фазовая вариация. Продукты генов fli С и fljB — различные флагеллины. Ген hin кодирует рекомбиназу, катализирующую инверсию участка ДНК, содержащего промотор fljB и ген hin. Сайты рекомбинации (инвертированные повторы) названы hix (желтые), а — в одной ориентации экспрессируется ген fljB вместе с репрессорным белком (продуктом гена fljA), который подавляет транскрипцию гена fliC. б — в противоположной ориентации экспрессируется только ген fliС; гены fljA и fljB не могут транскрибироваться. В переключении между этими двумя состояниями, называемых фазовой вариацией, также участвуют два неспецифических ДНК-связывающих белка — HU и FIS (не показаны).
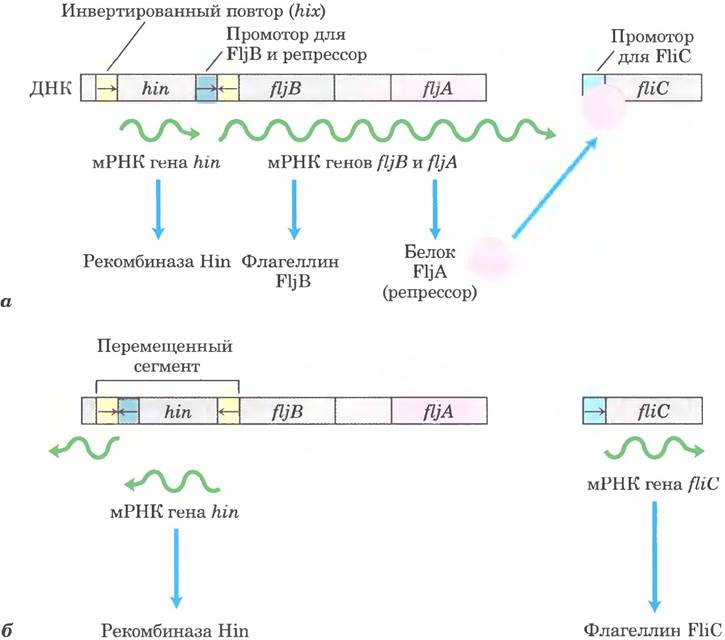
Таблица 28-1. Примеры регуляции генов путем рекомбинации
Система |
Рекомбиназа/ сайт рекомбинации |
Тип рекомбинации |
Функция |
Фазовая вариация (Salmonella) |
Hin/hix |
Сайт-специфическая |
Альтернативная экспрессия двух генов флагеллина позволяет избежать иммунного ответа хозяина |
Круг хозяев (бактериофаг μ) |
Gin /gix |
Сайт-специфическая |
Альтернативная экспрессия двух наборов генов хвостового отростка позволяет менять круг хозяев |
Переключение типов спаривания (дрожжи) |
Эндонуклеаза НО, белок RAD52, другие белки/МАТ |
Нереципрокнаяа |
В результате альтернативной экспрессии группы генов образуются клетки дрожжей с разными типами спаривания а и а, которые могут спариваться и подвергаться мейозу |
Антигенная вариация (трипаносомы)б |
Разные |
Нереципрокнаяа |
Последовательная экспрессия различных генов, кодирующих вариабельные поверхностные гликопротеины (VSG), позволяет избежать иммунного ответа хозяина |
а При нерецинрокной рекомбинации (этот тип рекомбинации не обсуждался в гл. 25) генетическая информация перемещается из одной части генома (где она «молчит») в другую (где она экспрессируется). Этот процесс напоминает репликативную транспозицию (см. рис. 25-15).
б Трипаносомы вызывают африканскую сонную болезнь и другие заболевания (см. доп. 22-3 в т. 2). Внешняя поверхность трипаносомы состоит из многочисленных копий одного только VSG, главного поверхностного антигена. Поверхностные антигены могут принимать до 100 различных форм, избегая атаки иммунной системы хозяина.
Преимущество этого типа регуляции заключается в его однозначности: экспрессия гена невозможна, когда ген физически отделен от своего промотора (обратите внимание на положение промотора fljВ на рис. 28-28, в). Абсолютное включение/выключение экспрессии важно по той причине, что жгутик, содержащий хотя бы одну копию «неправильного» флагеллина, может оказаться уязвимым для антител хозяина против этого белка. Такая система существует отнюдь не только в клетках сальмонеллы. Подобные схемы регуляции есть у ряда других бактерий и некоторых бактериофагов; системы рекомбинации с похожими функциями найдены и в эукариотах (табл. 28-1). Регуляция генов путем перестановок в ДНК, в результате которых происходят перемещения генов и/или промоторов, особенно распространена у патогенов, которые получают возможность менять хозяев или менять состав своих поверхностных белков, опережая иммунную систему хозяина.
Краткое содержание раздела 28.2 Регуляция экспрессии генов у бактерий
■ Lac-оперон Е. coli не только подавляется Lac- репрессором, но и подвергается положительной регуляции сАМР-рецепторным белком (CRP). Когда концентрация глюкозы низкая, концентрация сАМР высокая, и комплекс CRP-cAMP связывается со специфическим участком ДНК, стимулируя транскрипцию laс-оперона и образование ферментов метаболизма лактозы. При наличии глюкозы концентрация сАМР снижается, что ослабляет экспрессию lac и других генов, участвующих в метаболизме вторичных сахаров. Группа координированно регулируемых оперонов называется регулоном.
■ Опероны, в которых закодированы ферменты биосинтеза аминокислот, подчиняются регуляторному механизму, называемому аттенюацией; в этом механизме задействован участок терминации транскрипции (аттенюатор) в мРНК. Образование аттенюатора модулируется путем сопряжения транскрипции и трансляции и зависит от небольших изменений концентрации аминокислот.
■ Действие SOS-системы заключается в одновременной индукции множества несвязанных генов, подавляемых одним репрессором; повреждение ДНК при посредничестве белка RecA запускает автокаталитический протеолиз репрессора.
■ При синтезе рибосомных белков один белок в каждом опероне рибосомных белков действует как репрессор трансляции. Он связывается с мРНК и блокирует трансляцию, только когда находится в избытке к рРНК.
■ Посттранскрипционная регуляция некоторых мРНК опосредована малыми РНК, которые действуют по транс-механизму, или частями самой мРНК (рибопереключателями), которые действуют по цис-механизму.
■ Некоторые гены регулируются с помощью генетической рекомбинации, в результате которой промоторы перемещаются относительно регулируемых генов. Кроме того, регуляция может происходить на уровне трансляции.